G4 型髓母细胞瘤患儿预后影响因素及生存状况分析
2023-09-20武跃芳孙艳玲武万水杜淑旭孙黎明
武跃芳 孙艳玲 武万水 杜淑旭 李 苗 孙黎明
首都医科大学附属世纪坛医院(北京 100038)
髓母细胞瘤(medulloblastoma,MB)是儿童时期最常见的一种后颅窝恶性脑肿瘤(WHO Ⅳ级),多数认为其来源于脑发育过程中的祖细胞群[1-2]。MB 常见于10 岁以下,发病高峰为3~7 岁,男童患病率高于女童[3-5]。组织病理学分为经典型、促纤维增生/结节型(desmoplastic/nodular,DN)、广泛结节型(extensive nodularity,EN)、大细胞型/间变型(anaplastic/large cell,LC/A);分子分型分别为WNT型(wingless)、SHH型(sonic hedgehog)、3型(Group 3,G3)和4型(Group 4,G4)[6-8]。目前MB患儿的治疗主要为手术联合放疗和化疗,不同分型之间预后不同,G4型MB患儿生存率居中[9-10]。本文旨在分析G4型MB患儿生存情况,并探讨其预后影响因素。
1 对象与方法
1.1 研究对象
回顾性分析2016年5月1日至2020年8月31日经组织病理学诊断为MB 并在首都医科大学附属北京世纪坛医院儿科治疗的患儿生存情况。纳入标准:①年龄<18 岁;②组织病理学诊断为MB;③分子分型诊断为G4型;④在本院接受化学治疗的患儿。排除标准:①继发第二肿瘤;②非疾病本身因素放弃治疗或失访者。
本研究中所用资料均在临床治疗过程中及后续随诊中收集获得,监护人均对此研究知情同意,医院医学伦理委员会已批准该研究方案(批准号:sjtky11-jy-2020)。
1.2 方法
1.2.1 手术治疗 所有患儿的治疗均以手术开始,对肿瘤进行最大程度切除,切除范围包括全部切除(GTR)、近全切除(肿瘤残留<1.5 cm3)(NTR)和次全切除(肿瘤残留≥1.5 cm3)(STR)[11]。
1.2.2 分期与治疗原则 对肿瘤有无转移进行分期:M0期,无转移证据;M1期,显微下脑脊液转移;M2期,肉眼可见,颅内软脑膜转移;M3期,椎管内软脑膜内转移;M4期,脑脊髓轴外转移[12]。治疗基于欧洲血液肿瘤协作组脑肿瘤2000(HIT SKK 2000)治疗方案:①环磷酰胺800 mg/m2×3 d+长春新碱1.5 mg/m2×1 d;②甲氨蝶呤5 g/m2×24 h+长春新碱1.5 mg/m2×1 d;③甲氨蝶呤5 g/m2×24 h+长春新碱1.5 mg/m2×1 d;④卡铂200 mg/m2×3 d+依托泊苷150 mg/m2×3 d。<3岁及M+患儿序贯上述HIT SKK 2000方案化疗,待年龄≥3岁或存在疾病进展时行放射治疗;≥3岁患儿,术后尽快进行放射治疗,对于不能配合的患儿,序贯上述①④治疗方案后进行放射治疗[13-14]。
1.2.3 放射治疗及维持性化学治疗 所有患儿均接受放射和化学的联合治疗。放射治疗剂量为颅脑23.4~26.0 Gy,颅窝增强照射至54.0~55.8 Gy;在放射治疗结束后6 周开始接受顺铂、长春新碱及洛莫司汀或替莫唑胺的化学治疗,每4~6 周重复1次,共6~8个疗程[13-14]。对于复发患儿,确诊复发后则采用INE方案(异环磷酰胺2 g/m2×3 d、奈达铂30 mg/m2×3 d、依托泊苷100 mg/m2×3 d)或卡铂(200 mg·m-2·d-1)+依托泊苷(100 mg·m-2·d-1)持续96小时静滴等方案治疗。
1.2.4 疗效评价 化学治疗期间每2~4个疗程复查头部和脊柱核磁共振成像(MRI),治疗结束2 年内每3 个月行头部和脊柱MRI 检查;结束治疗后2~5年,每6个月行头部和脊柱MRI检查;治疗结束5年后每年行头部和脊柱MRI检查。疗效评价标准:①完全缓解(CR)为MRI 检查结果显示肿瘤信号完全消失;②疾病稳定(SD)为MRI 检查结果显示肿瘤减小或者增大<25.0%;③疾病进展(PD)为MRI检查结果显示肿瘤增大≥25.0%或出现明显肿瘤继发的神经系统后遗症[15]。
1.2.5 化疗主要不良反应 根据国家癌症研究所常见毒性指标及分级标准的评定[16],血液不良反应主要表现为Ⅰ~Ⅳ级不同程度的骨髓抑制,而胃肠道不良反应主要包括食欲下降、恶心、呕吐、腹痛、腹泻、便秘等。
1.2.6 随访 收集患儿性别、年龄、手术方式、肿瘤分期、病理分型、染色体改变等临床资料。定期监测患儿全脑全脊髓MRI结果评价疗效。总生存(OS)期指从手术切除肿瘤至患儿因疾病进展或其他原因死亡的时间,这段时间的生存率为OS率;无进展生存(PFS)期指从切除肿瘤开始至患儿出现病情进展、复发等情况的时间,此期间的生存率为PFS率。
1.3 统计学分析
采用SPSS 23.0 统计软件进行数据分析。非正态分布计量资料以中位数(M)(P25~P75)表示,计数资料以例数(百分比)表示。采用 Kaplan-Meier 法计算患儿的OS率和PFS率(存活时间截至随访时间),以Log-rank检验比较各组间生存率差异;采用Cox回归模型分析影响G4 型MB 患儿生存的因素。以P<0.05为差异有统计学意义。
2 结果
2.1 一般情况
研究期间MB 患儿共445 例,其中分子分型为G4型148例,排除失访1例,年龄>18岁1例,继发第二肿瘤1例,共145例G4型MB患儿入组。男106例、女39例,中位确诊年龄7.5(5.7~9.6)岁,GTR 103例、NTR 40 例、STR 2 例。M0期91 例,M+期54 例(M1期1例、M2期12例、M3期41例);病理分型为经典型127例、DN 8例、LC/A 8例、EN 1例、未分型1例。本组患儿常见7号染色体(chromosome,Chr)扩增(67例)和Chr 17扩增(74例)。见表1。
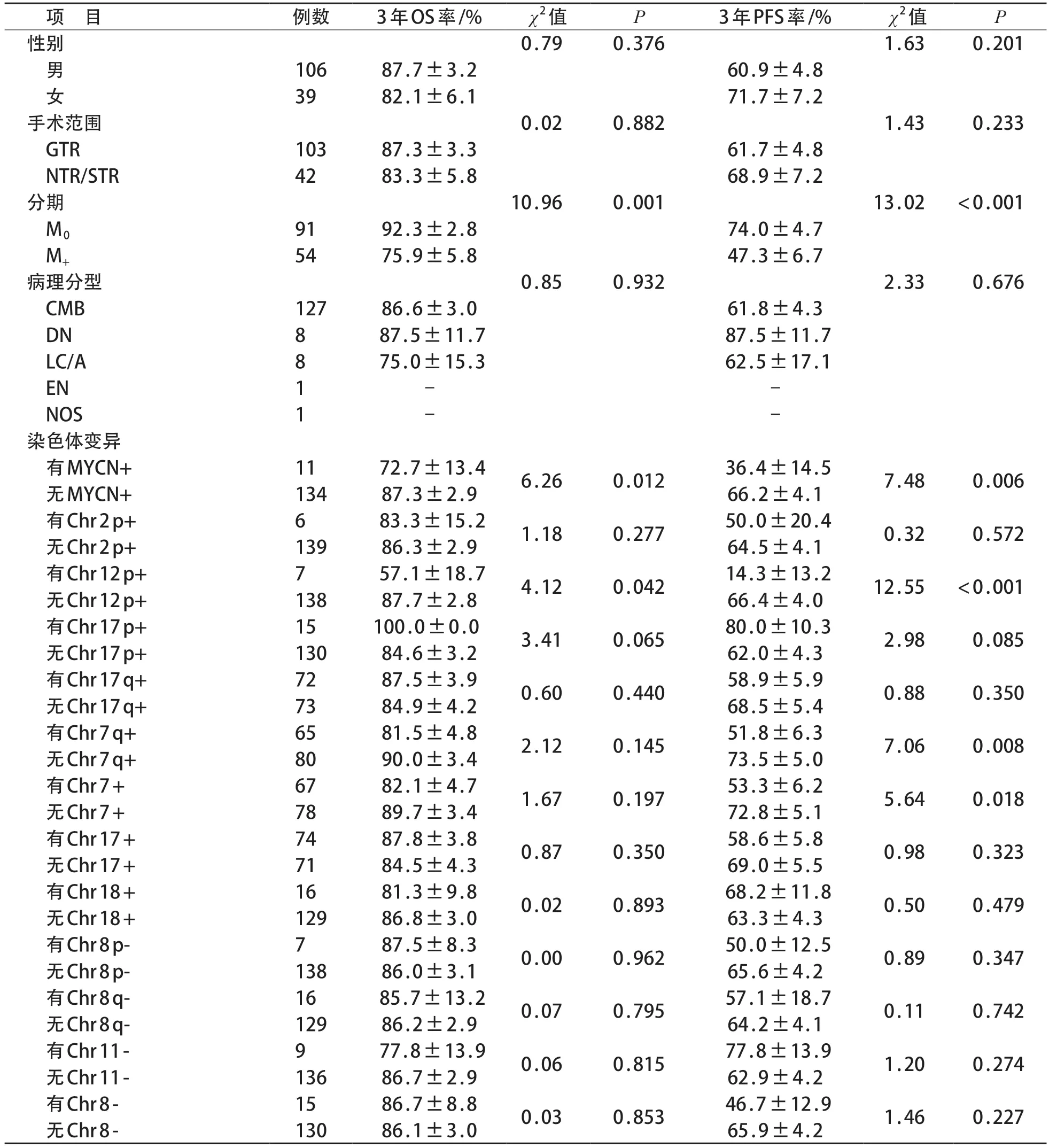
表1 G4型MB患儿总体OS率及PFS率单因素生存分析
2.2 生存分析
截至2022年8月31日,145例患儿中位随访时间为47.9(36.5~59.3)月,其中复发37例(25.5%)。患儿3 年OS 率和PFS 率分别为(86.2±2.9)%和(63.8±4.0)%,5 年OS 率和PFS 率分别为(80.8±3.4)%和(55.4±4.7)%。M0期患儿3年和5年OS率为(92.3±2.8)%和(89.6±3.3)%,3 年和5 年PFS 率分别为(74.0±4.7)%和(64.0±5.9)%;M+期患儿3 年和5 年OS 率为(75.9±5.8)%和(66.1±6.9)%,3年和5年PFS率为(47.3±6.7)%和(43.1±6.7)%,M0期和M+期组间比较差异均有统计学意义(χ2OS=10.96,POS=0.001;χ2PFS=13.02,PPFS<0.001)。MYCN扩增患儿5年OS率为(51.9±15.7)%。
2.3 预后影响因素分析
根据Log-rank检验分析结果,M0期患儿3年OS率及PFS率高于M+患儿;与无染色体变异的患儿相比,有MYCN扩增、Chr12p+变异的患儿3年OS率及PFS率较低,有Chr7q+、Chr7+的患儿3年PFS率较低,差异均有统计学意义(P<0.05)。见表1。
Cox 回归分析结果提示,M+期,MYCN 扩增、Chr12p+变异是影响预后的独立危险因素(P<0.05)。见表2。
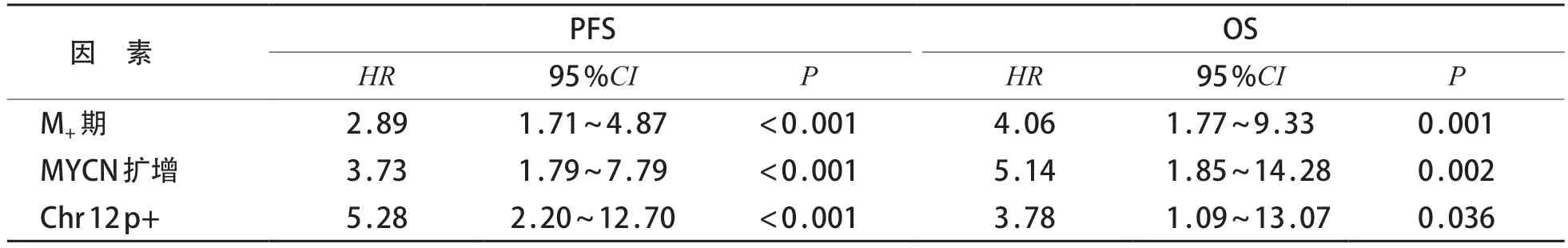
表2 Cox 回归模型分析G4型MB患儿总体OS率及PFS率影响因素
2.4 化疗主要不良反应
主要不良反应表现为胃肠道不良反应及不同程度骨髓抑制,胃肠道不良反应主要表现为食欲减退(72 例)、腹部不适(51 例)、恶心(39 例)、呕吐(24 例)、便秘(13 例)等,腹泻发生较少(5 例),仅1 例患儿出现消化道出血;14 例患儿出现轻度肝酶升高,2 例出现中重度肝酶升高。所有患儿均出现不同程度骨髓抑制情况,54 例患儿出现Ⅳ级骨髓抑制,治疗过程中需输注血小板或红细胞支持治疗者29例。
3 讨论
MB 是儿童期常见的神经系统恶性肿瘤,不同亚群中以G4型最为常见,约占35.0%,各年龄段儿童均可发病,但婴儿期少见,有明显的男性优势。不同亚群MB 的临床特征及预后不同,其中WNT 组患儿预后最好,5年OS率可达90.0%以上;SHH和G4型患儿生存率居中,G3组患儿预后相对最差[6-9]。相关研究对7 项研究中550 例MB 患者治疗后的生存情况进行mexa 分析,结果显示G4 型患者5 年OS 率为70.0%~80.0%,其中M0期5 年OS 率为80.0%~90.0%,M+期为60.0%~70.0%[7]。有研究对1 126例MB患者预后进行分析,结果显示G4型患儿5 年OS 率稍低于80.0%[17];而另有两项研究报道G4 型MB 患者的5 年OS 率分别为77.0%和70.0%[18-19]。相关研究分析不同风险分层的MB患者治疗后的生存情况,结果显示G4型MB患儿(10例)存活率为70.0%,5年PFS为13.3%[20]。
本研究患儿的中位确诊年龄为7.5 岁,所有患者确诊时年龄均>3岁,男性患儿多于女性(2.7:1),病理分型中87.6%为经典型MB,与既往报道的G4型MB临床特点一致[6-9]。145例患儿的5年OS率为(80.9±3.4)%,略高于既往研究报道的OS率[17-19];而5年PFS率为(55.0±4.7)%,明显高于相关研究结果[20],可能与治疗方法及病例数差异有关。M0期和M+期患儿的5年OS率为分别为(89.7±3.3)%和(66.1±6.9)%,本研究中不同M分期的生存率比较差异有统计学意义,与既往报道结果一致[7,18-20]。
因既往相关研究较少,目前对G4型MB潜在的生物学特性了解不多。随着对G4 型患儿遗传特性及临床特征的深入研究,发现了一些可能影响其预后的危险因素。相关研究发现有Chr11-或Chr17+的G4 型MB 患儿,无论是否存在转移,均有良好的生存情况[17];同时Chr10p-也提示着相对更好的预后。然而有研究提示G4 型中常见的Chr 17 变异与预后不良有一定相关性,发生了转移或存在MYCN扩增的患者预后更差[9]。相关研究将G4 型MB 患儿分为高风险组和低风险组,发现高风险组中的患儿富含等臂Chr17q,其10年生存率为36.0%,低危组患儿中含有Chr2p+、Chr3-、Chr7+、Chr8-、Chr17p+及Chr18+,对预后均有影响,其10年生存率为72.0%,同时发现Chr13-是良好预后的标志[21]。有研究也发现G4型MB患儿在遗传学上存在Chr8p和Chr 8 q 显著缺失,但是未明确提出其与预后的关系[18]。
本研究显示M+期、MYCN扩增的患儿生存率较低,说明预后较差,与既往报道一致[7,9]。本研究中51.0%患儿有Chr17+,但未发现其对预后的影响;而有Chr7q+、Chr7+患儿的PFS率较无变异者低,但Cox 回归分析显示其并非为影响预后的独立危险因素。本研究Cox回归分析显示有Chr12p+患儿的OS率和PFS率低于无上述染色体变异者,但既往研究中未提出此变异对于G4 型MB 患儿预后的影响,可能与本研究样本中含有此变异病例数过少相关,此结果存在一定的局限性,有待进行更大样本量的临床观察研究及进一步验证,以期得出更明确的结论。
本研究患儿化疗主要不良反应为胃肠道反应及骨髓抑制。所有治疗方案中,约半数患儿出现食欲减退,部分患儿表现腹部不适,而便秘、腹泻发生相对较少;患儿在甲氨蝶呤治疗后易出现肝脏功能受损,其中14例患儿出现肝酶轻度升高,2例患儿出现中重度肝酶升高。所有治疗方案中患儿均出现不同程度的骨髓抑制情况,54例患儿出现重度骨髓抑制,铂类药物治疗后更易出现血小板及血红蛋白重度降低的情况,其中29例患儿需要输注血红蛋白或血小板支持治疗。但没有患儿因化疗出现威胁生命的严重并发症。
综上,G4型MB患儿的5年OS率达80.0%,M+期、MYCN 扩增的患儿5 年OS 率为66.1%和51.9%,预后较差。虽然结果显示Chr12p+患儿预后较差,但是含有此变异病例数过少,可能存在统计学上的偏倚,所以仍有待进行更大样本量的临床观察研究及进一步验证,以期得出更明确的结论,为MB患儿今后的精准治疗提供一定的指导。
