基于mRNA转录组及sRNA测序技术探讨益肾方干预糖尿病肾病的机制
2023-09-20何新荣卢汉祺邓丽娥钟云良李强
何新荣, 卢汉祺, 邓丽娥, 钟云良, 李强
(1.广州中医药大学,广东广州 510006;2.东莞市中医院,广东东莞 523000)
糖尿病肾病(diabetic kidney disease,DKD)是糖尿病(diabetes mellitus,DM)最常见的微血管并发症,是在全球范围内严重影响人类生命健康的三大非传染性疾病之一[1]。在患2 型糖尿病(type 2 diabetes mellitus,T2DM)的人群中有高达40%的患者会出现肾脏并发症[2],临床上定义为肾功能受损或尿白蛋白排泄升高或二者皆有[3-5]。中国成人的糖尿病患病率已经从2007 年的9.7%上升到了2017 年的11.2%[6]。DKD 的早期症状不明显,主要表现为蛋白尿、肾小球高滤过,通常最先在随诊过程中的尿检及肾功能检查时发现异常,否则难以引起患者的关注。随着病程进展,肾小球滤过率(eGFR)进行性下降,患者临床表现可涉及多系统、多器官,包括终末期肾病(end-stage renal disease,ESRD)、其他部位进行性靶器官损害等。一旦进入ESRD,患者将需要依赖肾脏替代治疗以改善症状、延长寿命,严重影响患者的生活质量。因此,预防和管理糖尿病患者的肾脏并发症是其整体管理的关键目标。但是,DKD 发病机制复杂,其发病率逐年上升,干预手段有限。
益肾方是东莞市中医院的协定方。多年的临床实践表明,益肾方在改善DKD 患者症状及延缓DKD 进展方面疗效显著,但其作用机制尚未明确,这在一定程度上影响了其临床的推广与应用。因此,为阐明益肾方改善DKD 潜在的机制,筛选DKD 治疗的新靶点及探索中药新适应症提供新思路,本研究观察了益肾方对db/db 小鼠体质量、血糖、尿微量白蛋白/肌酐比值(UACR)、尿微量白蛋白(MAU)、血清胱抑素C(Cys-C)及肾脏病理改变的影响,并采用转录组、小RNA(sRNA)测序技术检测肾脏组织RNA、微小RNA(microRNA,miRNA)表达变化,进行生物信息学分析,现将研究结果报道如下。
1 材料与方法
1.1 实验动物28 只无特定病原体(SPF)级6 周龄雄性(Lepr)ko/ko db/db 糖尿病小鼠和7 只同遗传背景雄性(Lepr)db/m 小鼠,体质量22 ~50 g,均购自江苏集萃药康生物科技有限公司,动物生产许可证号: SCXK(苏)2015-0001。动物在暨南大学动物实验中心SPF级动物房进行饲养。每天自由摄食、饮水,12 h/12 h光暗循环,室内温度保持在(24±1)℃,环境湿度保持在45% ± 10%。本研究获暨南大学动物伦理委员会审批同意(伦理批号:PZ22033)。
1.2 主要药物及制备益肾方组成:黄芪30 g、山茱萸15 g、柴胡10 g、当归10 g、菟丝子20 g、僵蚕15 g。中药材由东莞市中医院提供。将上述药材加入5 倍量蒸馏水煎煮30 min,煎煮2 次,混合过滤后将水煎液浓缩到200 g,于4 ℃冰箱中存储备用。洛汀新(北京诺华制药有限公司生产,批准文号:国药准字H20000292),将洛汀新研磨成粉,每500 mL 生理盐水中加入500 mg 粉剂混匀,制备成洛汀新混悬液后常温保存备用。
1.3 试剂与仪器Cys-C 酶联免疫吸附分析(ELISA)试剂盒(武汉伊莱瑞特生物公司);尿肌酐(UCr)ELISA 试剂盒、MAU ELISA 试剂盒(武汉酶免生物公司);苏木精染液和伊红染液(武汉塞维尔生物科技有限公司);糖原PAS 染色试剂盒(北京索莱宝科技有限公司);神经钙黏蛋白(Ncad)、纤维连接蛋白(FN)、α-平滑肌肌动蛋白(α-SMA)和上皮钙黏蛋白(E-cad)等抗体(武汉塞维尔生物科技有限公司);GAPDH抗体、辣根过氧化物酶(HRP)标记山羊抗兔IgG 二抗、HRP 标记驴抗山羊IgG 二抗(武汉生物科技有限公司);Agilent BioAnalyzer 2100 系统的RNA Nano 6000 检测试剂盒(美国Agilent Technologies 公司)。BV-2 垂直电泳仪(武汉Servicebio 公司);RT-6100酶标仪(美国Rayto 公司);BT-2 转印电泳仪(武汉Servicebio 公司);CFX-96 PCR 扩增仪(美国伯乐公司)。
1.4 分组与给药共分5 组。正常组:7 只db/m小鼠,给予10 mL·kg-1·d-1生理盐水灌胃12 周;模型组:7只db/db糖尿病小鼠,给予10 mL·kg-1·d-1生理盐水灌胃12 周;益肾方低剂量组:7 只db/db 糖尿病小鼠,给予2.5 g·kg-1·d-1益肾方水煎液灌胃12 周;益肾方高剂量组:7 只db/db 糖尿病小鼠,给予5.0 g·kg-1·d-1益肾方水煎液灌胃12周;洛汀新组:7 只db/db 糖尿病小鼠,给予10 mg·kg-1·d-1洛汀新混悬液灌胃治疗12 周。db/db 糖尿病小鼠采用抽签随机分组法。小鼠进入动物房环境适应1周后即小鼠第7 周龄开始灌胃,每日1 次。其中,益肾方低剂量组及洛汀新组小鼠的灌胃量根据人与动物间按体表面积折算表[7]计算得出,益肾方高剂量组的灌胃剂量为益肾方低剂量组的2倍。
1.5 观察指标与方法
1.5.1 体质量 分别于给药前、给药后每周固定时间以及处死小鼠前,记录小鼠的体质量。
1.5.2 血糖仪检测空腹血糖 应用快速血糖仪检测小鼠空腹8 h尾静脉血糖浓度,每周检测1次。
1.5.3 ELISA 法检测生化指标 代谢笼收集尿液,按照试剂盒说明书测定MAU 及UCr 水平,并计算得出UACR。给药结束后,眼眶采血,按照试剂盒说明书检测血清Cys-C水平。
1.5.4 Western Blot法检测肾间质纤维化相关蛋白N-cad、FN、α-SMA、E-cad 的表达水平 取肾脏组织加入放射免疫沉淀分析(RIPA)裂解液(使用前数分钟内加入蛋白酶抑制剂),匀浆,离心(12 000g,4 ℃,10 min),取上清液(即为总蛋白溶液),应用二喹啉甲酸(BCA)蛋白浓度测定试剂盒测定上清液蛋白浓度。10%十二烷基硫酸钠-聚丙烯酰氨凝胶电泳(SDS-PAGE),转膜,脱脂奶粉封闭1 h。加入以TBST 稀释的一抗(1∶5 000),4 ℃孵育18 h,TBS液洗涤3次,加入以TBST稀释的二抗(1∶5 000),37 ℃孵育30 min,TBS 液洗涤3 次。加入化学发光试剂(ECL)显色,进行显影,定影。根据不同的发光强度调整曝光条件。将胶片扫描存档,PhotoShop整理去色,Alpha软件处理系统分析目标带的光密度值。
1.5.5 光镜观察肾脏病理改变 取肾脏组织,石蜡包埋后切片(厚度约4 μm),进行苏木素-伊红(HE)染色和PAS染色。
1.5.6 RNA-seq测序与sRNA-seq测序
1.5.6.1 RNA 提取及质量检测 按照试剂盒说明书提取正常组、模型组及益肾方治疗组小鼠肾脏组织总RNA,其中益肾方治疗组包含低、高剂量组中随机选出的7 个小鼠肾脏样本。在1%琼脂糖凝胶上监测RNA 降解和污染;RNA 纯度用Nanophotometer 分光光度计检查;RNA 浓度用Qubit 2.0 荧光分光光度计中的Qubit RNA 检测试剂盒进行检测;使用Agilent BioAnalyzer 2100 系统的RNA Nano 6000检测试剂盒评估RNA完整性。
1.5.6.2 文库构建与测序 根据制造商建议,按说明书使用NEBNext®UltraTMRNA Library Prep Kit for Illumina 生成RNA 测序文库,使用NEBNEXT®Multiplex Small RNA Library Prep Set for Illumina®生成sRNA 测序库。将纯化产物合成的cDNA 文库在Agilent BioAnalyzer2100 系统上使用DNAHigh Sensition 芯片进行质量评估。根据制造商的说明,使用Truseq SR 集群工具包V3-CBOT-HS(Illumia)在CBOT 集群生成系统上对索引编码样本进行聚类。聚类后,在Illumina HiSeq 2500 平台上对文库制剂进行双端RNA 测序和sRNA 测序,并产生125 bp/150成对末端reads以及50 bp的单端reads。
1.5.6.3 测序数据质量控制 本次分析中,所用质量评估软件为FastQC,所用处理软件为Trimmomatic,筛选规则为以TruSeq3-PE.fa 为模板去除接头,限定最小序列长度RNA为50 nt、miRNA为17,去除序列开头末尾质量分数低于3 的碱基,以4 nt为滑窗长度,去除序列中平均质量分数低于16的片段。
1.5.6.4 表达量检测 在GENCODE 网站(https://www.gencodegenes.org/)获取小鼠(Genome assembly version:GRCm39;GENCODE release:M26;Release Date:2021.02)的参考基因组序列、参考转录本序列和基因组注释文件,并根据物种的参考基因组、参考转录本和基因组注释信息将处理后的测序数据比对到小鼠基因组上,并对每个转录本进行定量。RNA-Seq 所用比对软件为STAR,miRNA为bwa 的aln 子程序,RNA 使用的定量软件为HTSeq-count,miRNA为miRdeep2。
1.6 基因表达差异分析上述步骤获得表达矩阵后,取10个及以上样本表达量>0的基因进行主成分分析(PCA),将离群剔除后再进行差异分析。R 语言DESeq2 包基于负二项式广义线性模型检测RNA、 miRNA 表达的差异性。 使用DESeq2(v1.32.0)R 包对各实验组和对照组的基因差异分析,表达量差异倍数≥2以及调整后P值<0.05 的基因被定义为差异表达基因。另外,使用R 包ggplot2 以火山图形式对各实验组和对照组的差异基因进行可视化。
1.7 基因本体论(GO)及京都基因与基因组百科全书(KEGG)分析上述步骤获得的差异表达RNA使用R 包clusterProfiler 进行GO 和KEGG 通路富集分析,并采用BH 方法校正P值,矫正后的P值<0.05的GO 和Pathway 定义为显著富集,将得到的富集结果使用R 包ggplot2 进行绘图。对于差异表达miRNA,则上传至DIANA-miRPath v3.0(http://www.microrna.gr/miRPathv3),物种参数选择人类,平台选择TargetsScan,然后进行靶基因预测及GO和KEGG通路富集分析[8]。
1.8 统计方法采用SPSS 26.0 统计处理软件,计量资料应用k-s单样本检验方法检验各组变量正态分布的情况,以均数±标准差(±s)表示。若符合正态分布,组间比较使用独立样本t检验,多组间两两比较采用方差分析(LSD法);非正态分布的两独立样本间比较则采用Wilcoxon 秩和检验,非正态分布数据的多样本间比较采用Kruskal-Wallis检验。以P<0.05为差异有统计学意义。
2 结果
2.1 小鼠体质量、生化指标检测结果表1 结果显示:与正常组比较,其他各组小鼠体质量均有不同程度增加(P<0.05),其中模型组体质量增加最明显;与模型组比较,益肾方低、高剂量组及洛汀新组小鼠体质量有所下降,差异有统计学意义(P<0.05);益肾方低、高剂量组小鼠体质量与洛汀新组比较,差异无统计学意义(P>0.05)。
表1 各组小鼠体质量、血糖水平比较Table 1 Comparison of body mass and blood glucose among each group of mice(±s)

表1 各组小鼠体质量、血糖水平比较Table 1 Comparison of body mass and blood glucose among each group of mice(±s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较
?
与正常组比较,模型组,益肾方低、益肾方高剂量组及洛汀新组血糖水平显著升高(P<0.05);其余各组血糖水平比较,差异无统计学意义(P>0.05)。
表2结果显示:与正常组比较,其他各组UACR 水平显著升高(P<0.05),其中,模型组升高最为显著(P<0.05);与模型组比较,益肾方低、高剂量组及洛汀新组UACR均下降,益肾方高剂量组下降幅度最大(P<0.05);益肾方低剂量组UACR 与洛汀新组比较,差异无统计学意义(P>0.05)。
表2 各组小鼠生化指标比较Table 2 Comparison of biochemical indicators among each group of mice(±s)

表2 各组小鼠生化指标比较Table 2 Comparison of biochemical indicators among each group of mice(±s)
注:①P<0.05,与正常组比较;②P<0.05,与模型组比较;③P<0.05,与洛丁新组比较;④P<0.05,与益肾方低剂量组比较
?
与正常组比较,模型组MAU值升高(P<0.05);与模型组比较,益肾方低、高剂量组及洛汀新组的MAU 值有不同程度下降,差异均有统计学意义(P<0.05);益肾方低、高剂量组与洛汀新组之间两两比较,MAU水平无统计学差异(P>0.05)。
与正常组比较,模型组、洛汀新组Cys-C水平显著升高(P<0.05),益肾方低、高剂量组Cys-C无统计学差异(P>0.05);与模型组比较,益肾方低、高剂量组Cys-C 水平显著下降(P<0.05);益肾方低、高剂量组Cys-C 水平显著低于洛丁新组(P<0.05);Cys-C 值的益肾方低、高剂量组间比较,差异无统计学意义(P>0.05)。
2.2 肾间质纤维化相关蛋白表达结果图1 ~图2结果显示:与正常组比较,模型组、益肾方低剂量组的N-cad 表达水平显著升高(P<0.05);与模型组比较,益肾方高剂量组、洛汀新组的N-cad表达水平显著下降(P<0.05);益肾方高剂量组的N-cad 表达水平低于低剂量组(P<0.05);益肾方低、高剂量组N-cad表达水平与洛汀新组比较,差异均无统计学意义(P>0.05)。
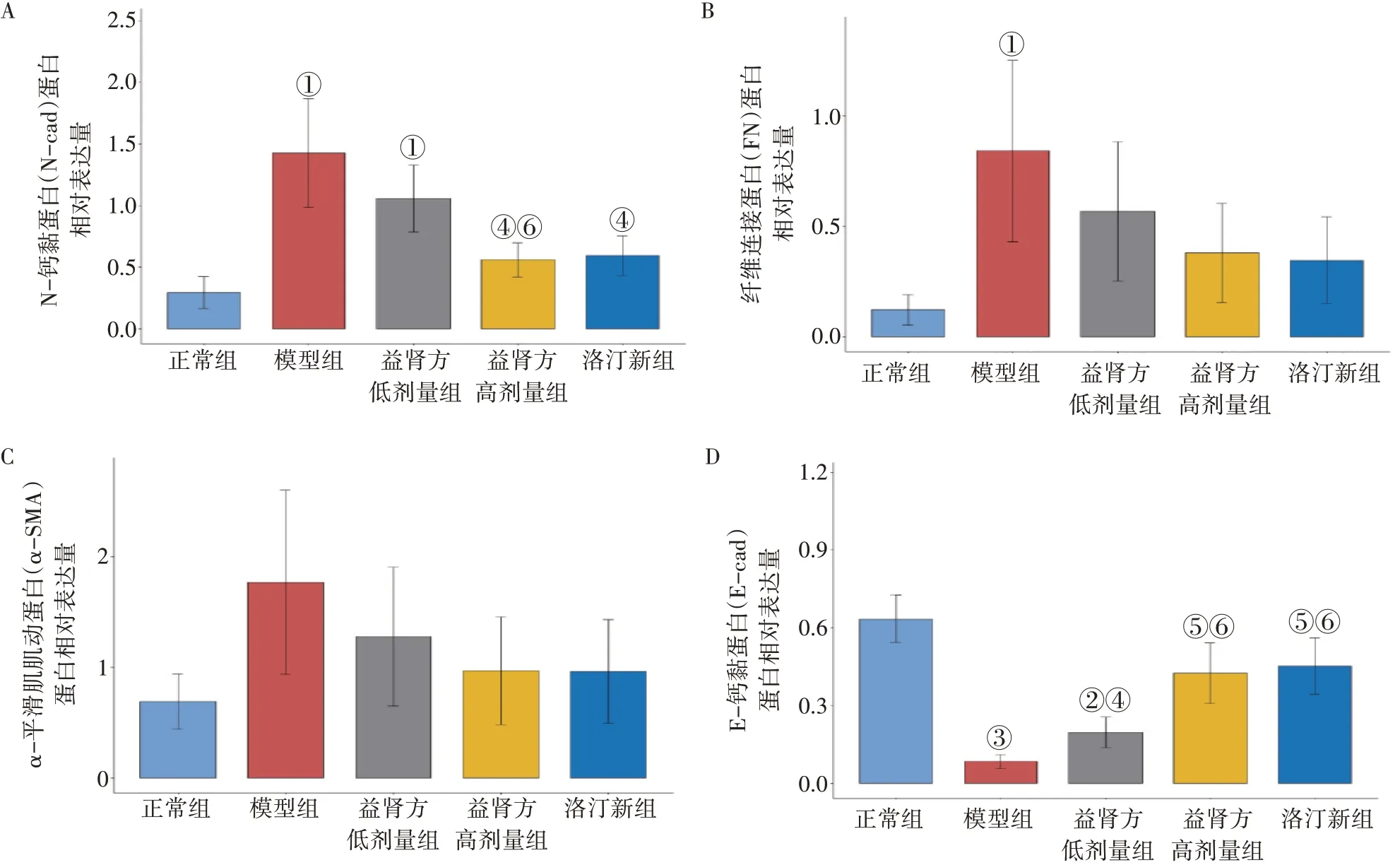
图1 各组小鼠肾脏组织肾纤维化相关蛋白表达比较(±s)Figure 1 Effect of Yishen Prescription on renal fibrosis-associated proteins among each group of mice(±s)

图2 肾纤维化相关蛋白Western Blot电泳条带图Figure 2 Western Blot banding of renal fibrosisassociated proteins
与正常组比较,模型组的FN 表达水平显著升高(P<0.05),其他各组差异均无统计学意义(P>0.05);益肾方低、高剂量组及洛汀新组FN 表达水平与模型组比较,差异亦无统计学意义(P>0.05)。
各组间α-SMA 表达水平比较,差异均无统计学意义(P>0.05)。
与正常组比较,模型组、益肾方低剂量组的E-cad 表达水平显著降低(P<0.01 或P<0.001),益肾方高剂量组、洛汀新组的E-cad 表达水平降低,但差异无统计学意义(P>0.05);与模型组比较,益肾方低、高剂量组及洛汀新组的E-cad表达水平升高(P<0.05 或P<0.01);益肾方高剂量组的E-cad 表达水平高于益肾方低剂量组(P<0.05);益肾方高剂量组E-cad 表达水平与洛汀新组比较,差异均无统计学意义(P>0.05)。
2.3 肾脏病理结果图3 结果显示:模型组小鼠肾小球基底膜增厚,系膜区无细胞结构样增生明显,可见部分球囊粘连,肾间质出现纤维化;与模型组比较,洛汀新组基底膜厚度无明显差异,可见节段性球囊粘连现象,但系膜区增宽现象减轻,肾间质纤维化减轻;与洛汀新组比较,益肾方低剂量组基底膜厚度增生情况无显著性差异,但未出现节段硬化及球囊粘连现象,未出现球袢缺血皱缩现象,系膜区增生现象稍减轻,肾间质未见纤维化;与洛汀新组比较,益肾方高剂量组基底膜厚度增生情况减轻,未出现节段硬化及球囊粘连现象,未出现球袢缺血皱缩现象,系膜区增生现象进一步减轻,肾间质未见纤维化。

图3 各组小鼠肾小球HE及PAS染色结果(×400)Figure 3 Results of HE and PAS staining of glomeruli among each group of mice(×400)
2.4 差异分析结果获得mRNA、miRNA 表达矩阵后,分别进行样品主成分分析,发现正常组有1 个离群样本(见图4-A),将其剔除后重新进行主成分分析,发现各样本基本聚集在一起(见图4-B);miRNA 表达矩阵进行主成分分析,未发现明显离群样本(见图4-C)。

图4 PCA图Figure 4 PCA diagram
剔除离群样本后进行差异性分析,如图5 所示:正常组与模型组对比共发现293个差异表达基因,上调基因217 个,下调基因76 个;正常组与益肾方治疗组之间共有101 个差异表达基因,其中,上调基因39 个,下调基因62 个;模型组与益肾方治疗组之间共有10 个差异表达基因,其中,上调基因1 个,下调基因9 个;正常组与模型组共有6个差异miRNA,其他组未发现差异miRNA。

图5 差异基因火山图Figure 5 Differential genetic volcano map
2.5 GO与KEGG分析结果
2.5.1 差异表达mRNA 的GO 与KEGG 分析 本研究选择GO、KEGG 富集分析中调整后P值最低的前10 个条目进行可视化展示。正常组与模型组的差异表达mRNA 进行GO 分析获得的条目与免疫反应、炎症反应、蛋白质活性、脂肪酸代谢、细胞外基质沉积等相关;主要条目有细胞外基质(extracellular matrix)、 免疫球蛋白复合物(immunoglobulin complex)、脂蛋白颗粒(lipoprotein particle)、 高密度脂蛋白颗粒(high- density lipoprotein particle)、 体液免疫反应(humoral immune response)、 髓系白细胞迁移(myeloid leukocyte migration) 、 细 胞 趋 化 性(cell chemotaxis)、白细胞趋化性(leukocyte chemotaxis)、炎症反应的调节(regulation of inflammatory response)、 细胞活化的正向调节(positive regulation of cell activation)、免疫球蛋白受体结合(immunoglobulin receptor binding)、积极调节防御反应(positive regulation of defense response)、糖胺聚糖结合(glycosaminoglycan binding)、抗原结合(antigen binding)、长链脂肪酸结合(long-chain fatty acid binding)等。见图6-A GO结果。

图6 mRNA的GO、KEGG富集分析图Figure 6 GO and KEGG enrichment analysis map of mRNA
正常组与益肾方治疗组的差异表达mRNA 的GO 富集条目则涉及胆固醇代谢、脂肪酸代谢、免疫反应等。包括:细胞外基质(extracellular matrix)、胶原蛋白三聚体(collagen trimer)、脂肪酸代谢过程(fatty acid metabolic process)、类固醇代谢过程(steroid metabolic process)、体液免疫反应(humoral immune response)、调节胆固醇储存(regulation of cholesterol storage)、类固醇脱氢酶活性(steroid dehydrogenase activity)、长链脂肪酸结合(long- chain fatty acid binding)、 单羧酸结合(monocarboxylic acid binding)等。见图6-B GO结果。
模型组与益肾方治疗组的差异表达mRNA 的GO富集条目有:胶原蛋白三聚体(collagen trimer)、吞噬细胞囊泡膜(phagocytic vesicle membrane)、原代溶酶体(primary lysosome)、含胶原蛋白的细胞外基质(collagen-containing extracellular matrix)、细胞外基质(extracellular matrix)、免疫球蛋白生产(immunoglobulin production)、产生免疫反应分子介质(production of molecular mediator of immune response)、清道夫受体活性(scavenger receptor activity)、细胞外基质结构成分(extracellular matrix structural constituent)、过氧化物酶活性(peroxidase activity)等。见图6-C GO结果。
将各组组间差异显著的mRNA 用R 包clusterProfiler 进行KEGG 富集分析,正常组与模型组KEGG 富集通路有细胞因子-细胞因子受体相互作用(cytokine-cytokine receptor interaction)、IL-17信号通路(IL-17 signaling pathway)、TNF 信号通路(TNF signaling pathway)、趋化因子信号通路(chemokine signaling pathway)、NF-κB 信号通路(NF-kappa B signaling pathway)、糖尿病并发症中的AGE-RAGE 信号通路(AGE-RAGE signaling pathway in diabetic complications)。见图6-A KEGG结果。
以正常组与益肾方治疗组差异基因进行KEGG富集分析所得到的通路较正常组与模型组有部分相同,如:IL-17 信号通路、TNF 信号通路;而其特有的富集通路与胆固醇代谢、脂肪酸代谢、炎症反应相关,如:类醛固酮的合成和分泌(aldosterone synthesis and secretion)、胆固醇代谢(cholesterol metabolism)、PPAR 信号通路(PPAR signaling pathway)等。见图6-B KEGG结果。
模型组与益肾方治疗组的差异基因KEGG 分析未获得有意义的生物信号通路。见图6-C KEGG结果。
2.5.2 差异表达miRNA 的GO 与KEGG 分析 将正常组与模型组共有6 个差异miRNA 上传至DIANA-miRPath 网站,设置相关参数后进行GO 和KEGG 富集分析,所获得GO 条目有离子结合(ion binding)、 解剖结构发展(anatomical structure development)、细胞内溶质(intracellular)。见图7-A GO结果。

图7 miRNA 的GO(A)、KEGG(B)富集分析图Figure 7 GO(A)and KEGG(B)enrichment analysis of miRNA
KEGG 富集得到的通路有:NF-κB、Hippo 信号通路、细胞外基质受体作用通路(ECM-receptor interaction) 、 类 固 醇 生 物 合 成(steroid biosynthesis)、 细胞黏附分子(cell adhesion molecules)、 N- 甘氨酸生物合成(N- Glycan biosynthesis)等。见图7-B KEGG结果。
3 讨论
随着生活水平的改善,全球成年人的糖尿病患病率从1980 年的4.7%上升到2014 年的8.5%[9],据预测,到2035 年全球糖尿病患病人数可能将近6 亿[10]。糖尿病肾病(DKD)是糖尿病最常见的微血管并发症之一。DKD 发病机制复杂,涉及晚期糖化终产物堆积、炎症反应、氧化应激、脂代谢紊乱、血流动力学改变、遗传因素等[11],治疗DKD的方案仍以保守治疗为主,包括控制血压血糖、应用肾素-血管紧张素系统阻滞剂降尿蛋白、优质低蛋白饮食以及降脂药物等,尚缺乏阻断DKD 进展的治疗方案。
DKD 根据其临床表现不同可归属于中医学“消渴”“水肿”等范畴。DM 基本病机为阴虚燥热[12],因病情长期调治不当逐渐累及中、下二焦,导致脾肾亏虚,脾虚固摄无力,肾虚失于封藏,导致精微物质随尿液下泄,而正气耗损,行血无力,运化不及,血脉不利,则瘀血、痰湿、浊毒内生,导致虚实夹杂之证[13]。故DKD 以脾肾两虚为基本病机,兼夹痰、湿、瘀。 益肾方基于“脾肾两虚,络脉郁滞”病机,方中:黄芪为君药,补益肺、脾、肾之阳气,脾能摄、肾能固,则精微下泄能止;山茱萸、菟丝子益阴固精为臣,配合黄芪,一阴一阳,相互促进,相互转化,发挥温肾健脾、止漏浊之功;佐以当归,可行血生血,补而不滞;僵蚕取其清扬之性,透表利于外邪之疏散,疏泄利于湿毒之蠲除,与柴胡共为使药,轻清升散,疏利三焦,使邪有出路,枢机运转,有利于脾肾同补。全方共奏益肾健脾、通利活血之功。
db/db 小鼠为Lepr 基因缺陷导致的先天肥胖2 型糖尿病(T2DM)小鼠,发病过程与人T2DM 非常相似,是目前常用的T2DM 动物模型之一。其由于瘦素缺陷导致其功能缺失,在出生后2周内就发生高胰岛素血症,3 ~4周内发展为肥胖,8 ~10周就发展为糖尿病,可发生明显的DKD,是DKD 理想的动物模型。本研究通过db/db小鼠构建DKD 模型,观察益肾方对db/db 小鼠的疗效,结果显示,低、高剂量益肾方及洛汀新干预均能有效降低DKD 小鼠体质量,改善UACR、MAU 和Cys-C 等生化指标,且并不依赖于降低血糖实现。在降低UACR 方面,益肾方高剂量组优于低剂量组及洛汀新组,益肾方低、高剂量组的Cys-C下降幅度大于洛汀新组,但未提示剂量依赖性。以上结果表明益肾方改善肾功能指标的效果不亚于洛汀新。
肾间质纤维化(RIF)是终末期肾病(ESRD)最具特征性的表现,也是各种肾脏疾病进展至ESRD的共同通路。肌成纤维细胞的活化、增殖及细胞外基质(ECM)的过度沉积是RIF的主要特征,可致瘢痕形成和肾功能的进行性丧失[14]。肌成纤维细胞有多种细胞来源,其中,肾小管上皮间充质转化(EMT)被认为是肌成纤维细胞最重要的来源之一,是RIF 发生的重要机制[15]。EMT是指上皮细胞转化为具有间质表型细胞的生物学过程,表现为细胞间紧密连接变弱、极性消失和黏附性降低,伴有N-cad、FN、α-SMA表达上调和E-cad 表达下调,通过检测肾脏组织这4 种蛋白表达可提示RIF程度。E-cad 是一种跨膜糖蛋白,在形态发生和伤口愈合中起重要作用,并以钙依赖性方式参与细胞间粘附。在上皮细胞中,E-cad 与连环蛋白形成复合物以稳定细胞间粘附并保持上皮细胞的完整性,它不仅参与细胞-细胞粘附,还与多种信号转导通路相互作用并进行调节,在发生EMT 的多种组织中E-cad 的表达受到抑制[16]。在EMT 过程中,上皮细胞粘附连接的蛋白被能提供更大连接灵活性的蛋白N-cad取代,从而导致细胞分离和细胞运动性增强[17]。FN 是主要的细胞黏附分子之一,在许多重要的生理过程中起着关键性作用,如胚胎生成、伤口愈合、止血和血栓形成等。FN表达的改变、降解以及组合与多种病理发生密切相关,包括癌症和纤维化[18]。α-SMA 作为成纤维细胞的标志物早已被证实,RIF 过程中涉及多种因子,它们诱导肾小球系膜细胞、肾小管上皮细胞或肾间质成纤维细胞等肾脏固有细胞发生表型转化,使之转化为α-SMA 阳性的肌成纤维细胞,α-SMA 在肾纤维化研究中是理想的检测指标[19]。本研究采用Western Blot 法检测肾纤维化相关蛋白的表达情况以及应用光镜观察比较各组小鼠肾脏的病理变化,结果提示:益肾方和洛汀新可以提高db/db小鼠肾脏组织E-cad的表达、降低FN的表达水平,且益肾方高剂量的作用效果不亚于洛汀新,两者的作用效果都优于低剂量益肾方;虽然在降低N-cad、α-SMA 水平方面,益肾方低、高剂量组及洛汀新组的作用效果与模型组相比无统计学差异,但是从柱状图上仍可以看出存在下降趋势。由此可见,益肾方可能通过抑制EMT 进程来减缓DKD 进展。从病理结果看,益肾方干预的小鼠肾小球基底膜增厚、系膜增宽、球囊粘连等现象较模型组明显减轻。
目前,已经发现大量具有潜在重要生物学功能的转录本(mRNA 和miRNA),可能对db/db 小鼠疾病表达起重要调控作用。本研究对各组小鼠肾脏组织进行了mRNA 转录组及miRNA 测序并进行差异基因分析,结果显示,正常组与模型组的差异基因数量显著多于正常组与益肾方治疗组,说明益肾方干预能在一定程度上减轻DKD 对肾脏的影响。对差异表达mRNA 根据分子功能、细胞组分和生物学过程筛选出显著富集的GO 条目,正常组比对模型组与正常组比对益肾方治疗组差异mRNA均主要富集与炎症反应、免疫调节、脂肪酸代谢相关。
本研究结果显示,正常组与益肾方治疗组差异mRNA 主要富集在PPAR 信号通路、IL-17 信号通路等。有研究表明,PPAR 家族是核受体超家族的配体激活转录因子,可调节细胞的代谢稳态,在脂质的储存和动员,葡萄糖代谢,形态发生和炎症反应中起关键作用[20],配体激活的PPARγ 通过与维甲酸X 受体(RXR)形成异源二聚体来调控靶基因[21]。PPARγ 基因的突变与脂糖平衡失调有关,可导致肥胖和T2DM[22]。而PPARγ 表达上调通过增加肌肉和脂肪细胞表面的葡萄糖转运蛋白的表达,促进葡萄糖转运至组织细胞内,还能改善机体的胰岛素抵抗,从而降低血糖[23-24]。PPARγ 对炎症反应也有抑制作用,它可以竞争性结合信号传导及转录激活因子1(STAT1),抑制JAK-STAT信号通路激活,减轻该通路上相关炎症因子生成[25],还可以抑制p65 的磷酸化及核易位,从而抑制NF-κB 表达[26]。本研究中,正常组与模型组差异miRNA 的KEGG 富集分析也验证了NF-κB 在DKD中扮演重要角色。既往有研究[27]表明,黄芪甲苷可以激活PPARγ,降低NF-κB 磷酸化水平,从而减少NLPRP3等炎症小体释放。肥胖和高脂血症是CKD 最普遍的独立危险因素[28],柴胡皂苷a可以激活PPARα,抑制胰岛素抵抗,从而改善大鼠内脏脂肪变程度[29]。故推测益肾方可通过PPAR 信号通路调节炎症反应、脂代谢,进而改善DKD预后。
IL-17 家族由6 种结构相关的细胞因子IL-17A(IL-17)、IL-17B、IL-17C、IL-17D、IL-17E(IL-25)和IL-17F 组成,IL-17A 和IL-17F 关系最密切,大部分由辅助性T细胞17(Th17)产生[30],而IL-17 是其中最主要的细胞因子。IL-17 信号通路激活可以促进炎症反应,与慢性炎症、自身免疫性疾病和癌症进展有关[31]。IL-17 介导的慢性炎症在肾小管间质纤维化发生和进展中起着重要的作用,炎症反应在肾脏病变早期赋予损伤后初始保护性作用,但是持续的炎症反应可导致ECM 蛋白在肾小管间隙中过度沉积[32-33]。有研究[34]表明,抑制IL-17受体信号转导能有效改善自身免疫性肾小球肾炎小鼠的肾脏病理。梁文林等[35]检测系膜增生性肾小球肾炎小鼠肾脏组织IL-17的含量,发现黄芪甲苷干预可以降低IL-17表达水平,从而减轻小鼠肾脏病理损伤;黄芪的另一种有效成分黄芪多糖也能有效降低组织中IL-17 的水平[36]。柴胡中的活性成分柴胡皂苷d 可以通过调节IL-17 的表达改善自身免疫性肝炎小鼠的炎症反应[37]。菟丝子也能抑制Th17 细胞的过表达,降低IL-17、TGF-β 和IL-23 的表达,从而降低炎症损伤的风险[38]。结合GO 注释结果,本研究发现相关差异基因富集在炎症反应、免疫调节等生物过程中。因此,推测益肾方能调节IL-17 介导的炎症和免疫反应,延缓DKD疾病进展。
综上所述,益肾方干预可显著改善DKD 小鼠肾功能,减轻小鼠体质量,改善UACR、MAU、Cys-C 水平,且疗效不依赖于血糖水平;益肾方可以上调E-cad、N-cad 的表达,有效延缓肾纤维化;益肾方的肾脏保护作用可能是通过激活PPAR信号通路,抑制IL-17、NF-κB 信号通路,从而调节炎症反应、脂代谢、免疫反应来实现的,但仍需要更有针对性的实验进行验证。
