一种高效测定动物源性食品中类固醇激素的方法
2023-09-20陈彤钟名琴邱永为何玉榆黄婷
陈彤 钟名琴 邱永为 何玉榆 黄婷

摘 要:本文基于高效液相色谱-串联质谱建立了一种高效检测动物源性食品中4种类固醇激素的方法,并对建立的方法进行了方法学的考察与验证,试验对前处理步骤和测定条件进行优化,采用高效液相色谱-串联质谱进行分析。醋酸美仑孕酮、17α-群勃龙、甲基睾丸酮、17β-群勃龙的标准曲线相关系数分别为0.996 33、0.995 42、0.996 55、0.993 64,方法检出限分别为0.051 5 μg/kg、0.097 0 μg/kg、0.093 2 μg/kg、
0.087 3 μg/kg,回收率范围为93.4%~105.0%、82.2%~102.0%、88.8%~104.0%、85.0%~102.0%,相对标准偏差为2.8%~5.2%、0.8%~6.9%、3.0%~6.1%、2.6%~5.4%,所得结果表明,该方法具有过程简单,方法检出限低、回收率较好、精准度高、重复性好的优点,可以为動物源性食品中类固醇激素检验提供方法支持。
关键词:类固醇激素;液相色谱-串联质谱;动物源性食品;性激素残留
中图分类号:TS207.3 文献标志码:A 文章编号:1001-0769(2023)04-00107-05
类固醇激素(steroid hormones),又称为甾体激素,是一类拥有环戊烷多氢菲母核的脂溶性化合物。类固醇激素分为肾上性激素和肾上腺皮质激素两大类别[1]。肾上性激素主要有醋酸美仑孕酮、17α-群勃龙、甲基睾丸酮、17β-群勃龙等,而肾上腺皮质激素又称为糖皮质激素,主要有倍他米松、丙酸倍氯米松、泼尼松龙、地塞米松等。类固醇激素有助于调节新陈代谢、炎症、免疫功能、水盐代谢平衡、性特征的发育等,在哺乳动物发育的不同阶段均发挥重要的作用,包括动物的生长、发育、繁殖、行为变化以及适应内外环境,即使是少量激素都会对动物体产生很大影响[2-5]。类固醇激素在畜牧业养殖中具有增强动物体内蛋白质积累和改善生产性能的作用,少量的喂养成本就可以得到较高的经济效益,故很多不法商贩及养殖者将其添加到饲料中或直接喂食动物以获得高额的利润,造成了目前畜牧业出现滥用类固醇激素类药物的现象[3,5]。当人类长期摄入含激素残留的食品,超过某一限定值时将会对人体产生负反馈作用,从而破坏机体的正常生理平衡,致使激素分泌失调而呈现出不良后果,严重时甚至会导致心力衰竭[6-8]。因此,对动物源性食品中的类固醇激素残留进行检测,对于保护人们的身体健康,保障畜禽产品的食品安全具有重要的意义。
如今,类固醇激素的残留分析方法主要包括免疫层析柱法、酶联免疫法、液相色谱-串联质谱法(LC-MS/MS)、液相色谱法(HPLC)、气相色谱-串联质谱法(GC-MS/MS)等。其中免疫检测法操作复杂、周期长、重复性较差、精确性较差且交叉反应率较高,容易出现假阳性,只适合少数激素类物质的分析,难以同时进行多种激素物质的同时定性和定量检测[1-3,9-10]。气相色谱-串联质谱法虽然能够高灵敏度检测类固醇激素,但衍生化步骤操作复杂,成本和人工费用高[11]。液相色谱-串联质谱法与其相比,操作更为简单快捷,抗干扰能力强,灵敏度高,且支持多种药物残留同时进行定性、定量检测。液相色谱-串联质谱是理想的检测动物源性食品中类固醇激素含量的检测方法。
本研究优化并建立了一种高效液相色谱-串联质谱法测定动物源性食品中类固醇激素残留量的方法。该方法简便快捷、准确度高、灵敏度高,有效解决了传统标准方法中的缺陷,例如GB/T 20760-2006中前处理过程繁琐,用时较长,有机试剂使用过多,从而为类固醇激素药物检测提供全新的技术支持[12]。
1 材料与方法
1.1 仪器与试剂
1.1.1仪器
安捷伦1290液相色谱仪、AB Science质谱仪、氮吹仪、漩涡混合仪、电子天平、冷冻离心机、超纯水仪、超声波清洗机、Captiva EMR-Lipid脂肪去除柱、兽药分析专用 QuEChERS 萃取盐包、陶瓷均质子。
1.1.2 试剂
乙腈(色谱纯),甲醇(色谱纯),乙酸,乙酸铵,复溶液为甲醇/2 mmol乙酸铵水/甲酸(体积比为30∶70∶0.05)。
1.2 样本制备
取适量新鲜猪肉组织,将其搅碎至均匀态,于-20 ℃避光保存。
1.3 标准工作液的配制
准确称取醋酸美仑孕酮、17α-群勃龙、甲基睾丸酮、17β-群勃龙的标准品,用甲醇分别配成1 000 μg/mL的标准储备液,-20 ℃保存备用,有效期12个月;分别移取适量4种类固醇标准储备液(1 000 μg/mL)于同一容量瓶中,用甲醇逐级稀释成1.00 μg/mL混合标准液,-20 ℃冰箱中保存备用,有效期3个月;再移取1.00 μg/mL混合标准液稀释为
10.00 ng/mL的混合标准工作液。
1.4 样本前处理
准确称取试验样本(5±0.05)g 置于50 mL离心管中,加入3 mL水和陶瓷均质子涡旋混合1 min,加入10 mL乙腈超声提取10 min,加入盐包,涡旋混匀,9 000 r/min低温离心
10 min,取全部上清液过Captiva EMR-Lipid脂肪去除柱,挤干小柱,接收全部洗脱液转移至20 mL离心管,60 ℃下氮气吹至近干,用复溶液定容至1 mL,涡旋45 s后过0.22 μm滤膜,上机测定。
1.5 HPLC-MS/MS条件
1.5.1 高效液相色谱条件
色谱柱:Poroshell 120 EC-C8,(3.0 mm
×100.0 mm,2.7 ?m);流动相:A为0.05%乙酸,2 mmol乙酸铵水溶液,B为甲醇;柱温40.0 ℃;进样体积5.00 μL。具体梯度洗脱程序见表1。
1.5.2 质谱条件
离子源:ESI;监测反应模式:多反应监测;干燥气温度:350 ℃;干燥气流量:
6 L/min;鞘气温度:325 ℃;鞘气流量:
11 L/min;毛细管电压:3 500 V;喷嘴电压:500 V。
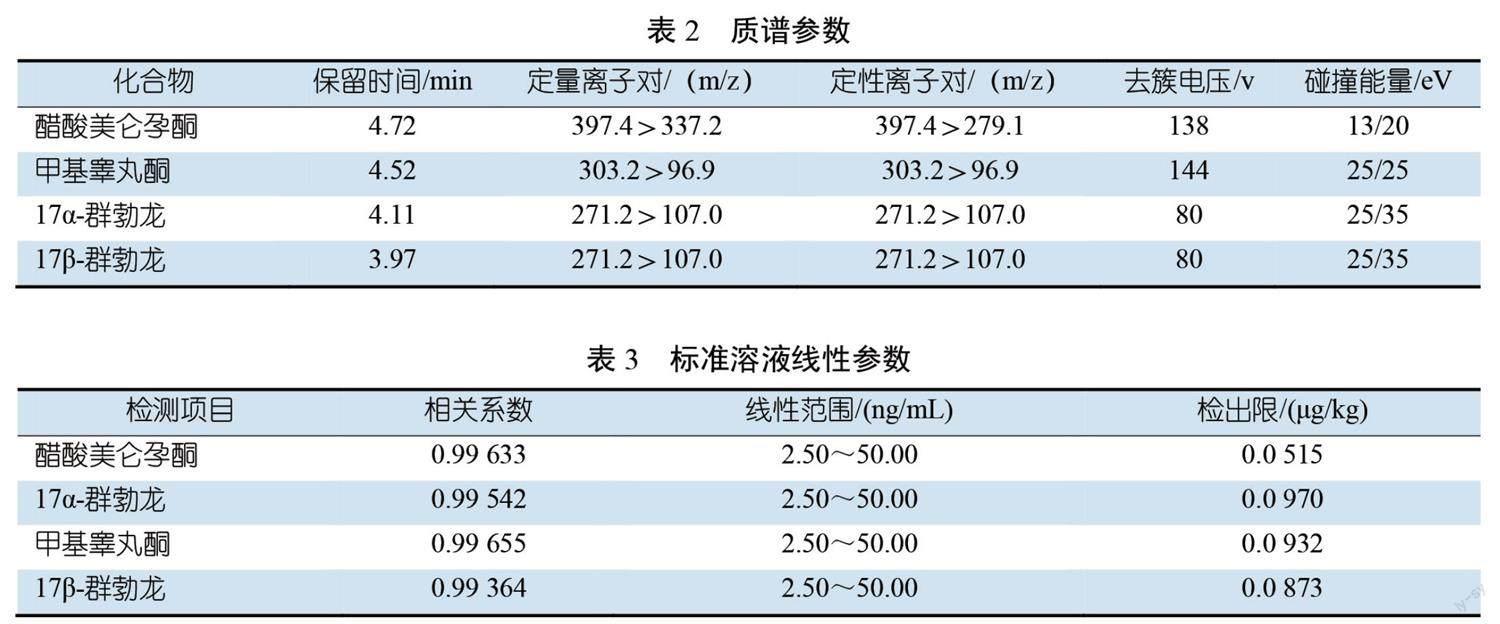
保留时间、定性离子对、定量离子对、去簇电压及碰撞能量见表2。
2 结果与讨论
2.1 标准曲线
配制一系列浓度的标准样本溶液(0.50 、
1.00、2.00、5.00、10.00 μg/kg),待仪器参数稳定后,对系列标准样品溶液进行测定,绘制标准曲线,醋酸美仑孕酮、17α-群勃龙、甲基睾丸酮、17β-群勃龙相关系数
r2分别为0.996 33、0.995 42、0.996 55、0.993 64。具体见表1。
2.2 方法检出限确定
以空白猪肉样本为基质,做7个平行添加试验,阳性添加浓度醋酸美仑孕酮、17α-群勃龙、甲基睾丸酮、17β-群勃龙均为
0.500 μg/kg,按照1.4方法进行前处理和上机测定,测得醋酸美仑孕酮、17α-群勃龙、甲基睾丸酮、17β-群勃龙的方法检出限分别为0.051 5、0.097 0、0.093 2、
0.087 3 μg/kg,具体见表3。计算公式如下:
检出限(method detection limit,MDL)(μg/kg) =K·Sb·C/
式中:K取3;Sb为平行测试样含量的标准偏差;C为加标浓度(μg/kg); 为平行试样含量的平均值。
2.3 回收率及精密度确定
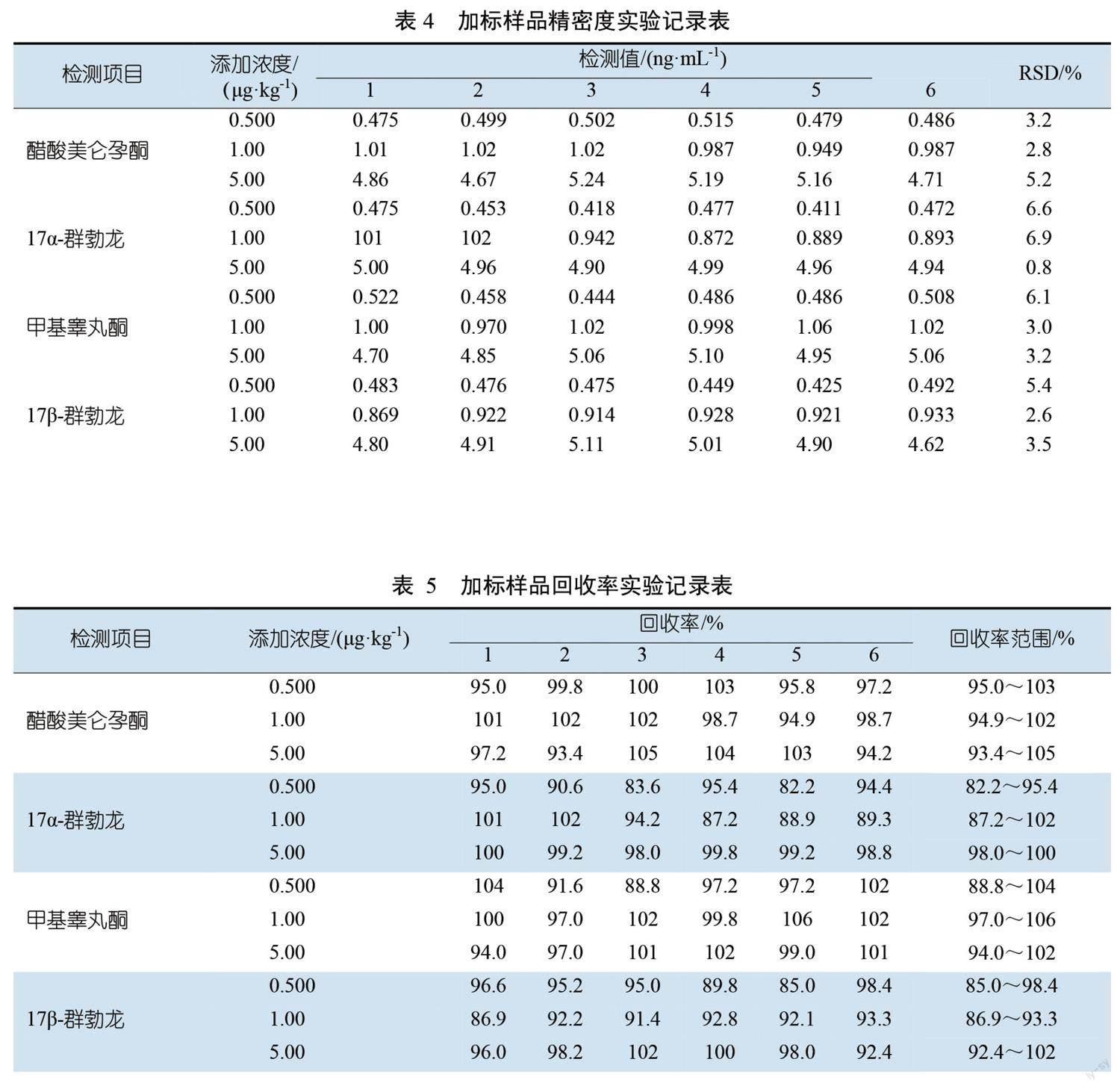
以空白猪肉样本为基质,向猪肉样本中添加类固醇药物(醋酸美仑孕酮、17α-群勃龙、甲基睾丸酮、17β-群勃龙)浓度水平分别为10.0、20.0、100.0 μg/kg进行加标回收试验。按照方法进行前处理,上机测试,结果如表2和表3所示。
根据表4与表5中相对标准偏差和回收率结果可发现,该方法的相对标准偏差较低,同时回收率范围表现较好,醋酸美仑孕酮、17α-群勃龙、甲基睾丸酮、17β-群勃龙的回收率范围分别为93.4%~105.0%、82.2%~102.0%、88.8%~104.0%、85.0%~102.0%;相对标准偏差分别为2.8%~5.2%、0.8%~6.9%、3.0%~6.1%、2.6%~5.4%。该方法的检出限较低、精准度较高,峰形受基质干扰较少,定性定量准确,是用于醋酸美仑孕酮、17α-群勃龙、甲基睾丸酮、17β-群勃龙非常理想的检测方法。
3 结论
本文旨在建立一种动物源性食品中4种类固醇激素测定的液相色谱-串联质谱的测定方法,为行政主管部门提供强有力的技术支持。试验结果表明,此方法在简单的前处理提取中能保持较高的准确度及精确度,而且分离度表现好;与传统的方法相比,该方法提取时间较短,操作过程较简单,有机溶剂使用较少,节约了成本并提高了检测效率,适用于动物源性食品中醋酸美仑孕酮、17α-群勃龙、甲基睾丸酮、17β-群勃龙残留量的定性、定量检测。
参考文献
[1] 徐锦忠,張晓燕,丁涛,等.高效液相色谱-串联质谱法同时检测鸡和鸡蛋中合成类固醇类激素和糖皮质激素[J].分析化学,2009,37(3):6-12.
[2] 孙汉文,康占省,李挥.凝胶渗透色谱-固相萃取净化-超快速液相色谱-串联质谱法检测牛肉中9种类固醇激素残留[J].分析化学,2010,38(9):1272-1276.
[3] 刘宏程,李宁,林涛,等.基质固相分散-超高效液相色谱-质谱检测器测定牛奶中9种类固醇激素残留[J].色谱,2015,33(11):76-82.
[4] 石放雄.饲料样品中类固醇激素类物质的检测[J].中国饲料,1995,2(22):11-13.
[5] 李新一.液相色谱-串联质谱法检测禽蛋类产品中26种类固醇激素的含量[J].中国饲料,2015,21(13):29-37.
[6] PARENT A S,NAVEAU E,GERARD A,et al.Early developmental actions of endocrine disruptors on the hypothalamus,hippocampus,and cerebral cortex[J].Journal of Toxicology and Environmental Health,Part B,2011,14(5-7):328-345.
[7] 孙博文,董碧蓉.糖皮质激素临床滥用现状及合理应用原则[J].现代临床医学,2014,40(2):3.
[8] CHAN J M,STAMPFER M J,MA J,et al.Dairy products,calcium,and prostate cancer risk in the Physicians' Health Study[J].The American Journal of Clinical Nutrition,2001,74(4):549-554.
[9] 田慧东,王献.浅谈类固醇激素检测技术的发展[J]. 2020,12(6):11-14.
[10] 张文君,李敏敏,张凤.液质联用技术及其应用[J].山东化工,2014,43(11):121-122.
[11] CHERLET M,DE BAERE S,CROUBELS S,et al.Quantitative determination of dexamethasone in bovine plasma and tissues by liquid chromatography–atmospheric pressure chemical ionization–tandem mass spectrometry to monitor residue depletion kinetics[J].Analytica Chimica Acta,2005,529(1-2):361-369.
[12] GB/T 20760-2006.牛肌肉、肝、肾中的α-群勃龙、β-群勃龙残留量的测定液相色谱-紫外检测法和液相色谱-串联质谱法[S].
