血液透析器生产工艺对聚乙烯吡咯烷酮洗脱的影响研究
2023-09-19刘炳荣沈美兰
戴 鹏 刘炳荣 汪 毅 沈美兰 鄢 杰 刘 峰
(1. 江西三鑫医疗科技股份有限公司,江西 南昌 330200;2. 南昌大学 化学化工学院,江西 南昌 330031)
聚乙烯吡咯烷酮(PVP)是一种具有内酰胺键的乙烯类聚合物[1,2]。口服PVP被认为是安全的,世界卫生组织规定的最大口服量为3 g·d-1[3]。进入人体血液中的大部分PVP通过肾脏排泄,其余小部分会在肝、肾、肺、胰腺和淋巴结等器官中永久性积聚,导致器官损伤或衰竭。第二次世界大战时,PVP曾经作为血浆代用品,最大使用量为50 g·人-1;第二次世界大战后,PVP被禁止作为血浆替代品使用[4]。
国内医疗器械质量检测中心将透析器PVP致孔剂的残留标准设置为<300 mg·支-1。按照可接受量标准,假设成人体重为70 kg,按每周透析2~3次计算,每次透析最高可摄入量为8.17~12.25 g。
1983年,德国费森尤斯(Fresenius)公司用聚砜(PSf)和PVP通过相转化法制备了第一束中空纤维透析膜[5]。随后,聚醚砜(PES)及聚酯-聚醚砜共聚物(PEPA)分别与PVP通过相转化法制备了商用膜。这些含有PVP的聚合物体系易于纺丝,制备得到的膜丝由于具有良好的中低分子渗透性、蛋白质等大分子高截留性、较好的生物相容性而被广泛用于血液透析治疗[6]。目前,PES膜透析器以其优良的毒素清除能力和良好的性价比在世界范围内得到广泛应用[7-10]。
透析膜的纺丝工艺过程中,PVP作为亲水剂和致孔剂加入使用[11-13]。PVP的亲水性可降低蛋白质在膜表面的吸附,PVP的交联溶胀结构亦能有效地减少血小板的黏附,从而提高PES/PVP膜的生物相容性[14-16]。透析膜使用时,PVP同时受到血液流动引起的溶解效应和剪切应力的作用,有可能从PES透析膜上洗脱出来,进入血液中。在血液透析期间,血压突然下降(包括过敏性休克)、血小板减少和补体激活等不良反应[17-19]常见于临床,这些不良反应的作用机制尚未完全阐明,但PVP的洗脱被认为是一个可能的原因[20,21]。
众所周知,存在于透析膜表面的氧化降解反应会导致PVP洗脱量增加。目前,国内外多项研究阐述了生物降解、高能射线辐照、热负荷等对PVP交联和降解的影响。PVP在固态和水溶液中的光氧化和降解可能会导致长时间储存的透析器中PVP洗脱量的增加。PES/PVP透析膜的交联和降解机制十分复杂,大部分研究结果只限于表观阐述,并未进行更加深入的探索。
在我国,血液透析治疗一般一次需要4.0 h,每周进行3~4次,患者的血液在透析治疗期间长时间接触透析膜[22]。由于终末期肾病(ESRD)透析患者排泄功能差,洗脱后PVP经血液循环进入人体后,更容易在体内器官积聚,引起一些并发症。此外,PVP的洗脱还可能改变膜的表面性质和生物相容性。
基于上述背景,本研究旨在探讨电子束灭菌、储存时间等工艺过程参数对PES血液透析膜中PVP洗脱的影响,为优化血液透析器生产工艺——既保证透析器具有合理的毒素清除率,又预防透析器材料本身对病患者血液产生异体侵入效应——提供理论依据。
1 材料与方法
1.1 测试样品
我们按照有/无灭菌、存储时间的不同,将实验样品分为7组,分别进行透析模拟实验,并且测量其PVP溶出度。为了确保实验设计的准确性,除了变量因子的变化,其他条件均保持一致,具体样品型号及测试条件见表1。

表1 实验透析器样品和测试条件具体数据Tab. 1 Specific data of dialyzer samples and test condition
1.2 PVP洗脱实验
室温下,每支血液透析器用1.0 L无菌注射用水,以100 mL·min-1进行预冲,预冲过程大约10 min,确保液体全部排除(如图1A)。
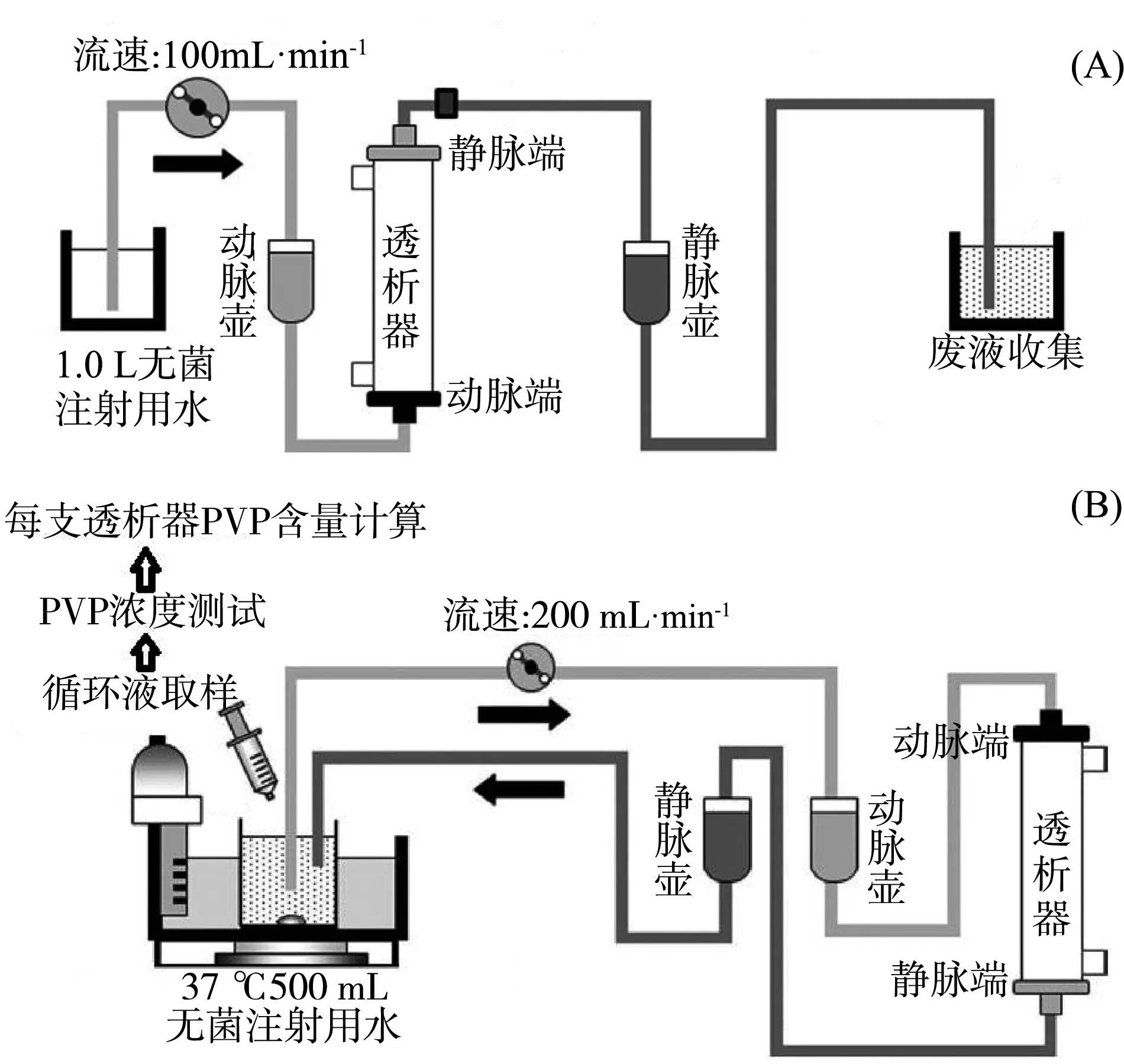
图1 实验示意图:透析器预冲(A)、透析器模拟循环测试(B)Fig. 1 Schematic diagram of the experimental processes pre-flushing of the dialyzer(A), simulated clinical test of the dialyzer(B)
透析器预冲结束后,立即用500 mL无菌注射用水,以200 mL·min-1流速,37 ℃循环5.5 h。使用高效液相色谱法测定循环液体中PVP的含量(如图1B)。每支透析器中PVP的洗脱量计算公式为:PVP的洗脱量(mg·支-1)=循环液中PVP的含量(μg·mL-1)× 循环液体积(500 mL)÷1 000。
1.3 PVP浓度测试
本研究采用了高效液相色谱法进行循环液中PVP含量的测试,此方法不仅可以将目标物质PVP与其他聚合物分离,且具有优良的精密度及准确度。该分析方法使用日本SHIMADZU公司LC-20AT型高效液相色谱仪(配有紫外检测器),Inertsil ODS-SP C18柱(4.6 mm×250 mm,5 μm),乙腈与水的混合液为流动相(10∶90,体积比),流速为1.0 mL·min-1,检测波长为205 nm。运用所建立的方法对液体样品进行测定,将PVP解析为单峰,出峰时间tR=5.705±0.005 min,整个研究过程中,色谱柱性能保持不变,峰形保持良好。在5.0~100.0 μg·mL-1浓度范围内呈良好的线性关系(R2=0.998 8,n=5),线性方程为Y=75.786 5X+377.790。
1.4 统计学方法
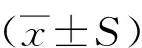
2 结果与讨论
2.1 电子束灭菌对PVP洗脱的影响
取表1中的A组、B组透析器样品各5支,按照血液净化标准操作规程(SOP 2020版)[23]进行规范操作,分别进行预冲、循环、取样等过程,采用高效液相色谱法测定循环液中PVP的浓度,并计算得到每支血液透析器中PVP的被洗脱量。其具体结果如表2所示。

表2 电子束灭菌对PVP洗脱的影响Tab. 2 Influence of electron beam sterilization on the elution of PVP
2.2 储存时间对PVP洗脱的影响
电子束灭菌会增加透析器PVP使用时的洗脱量,同样,储存时间也会影响。实验选取表1中B组(电子束灭菌、储存2 d)、C组(电子束灭菌、储存60 d)、D组(电子束灭菌、储存120 d)、E组(电子束灭菌、储存180 d)、F组(电子束灭菌、储存360 d)、G组(电子束灭菌、储存720 d)各5支,按照标准操作进行预冲、循环、取样等过程,最后测定循环液中PVP的含量,并计算得到每组透析器中PVP的洗脱量平均值。具体数据见图2。

图2 储存时间对PVP洗脱的影响Fig. 2 The effect of storage time on the elution of PVP
由图2可知,透析器在灭菌后不久(2 d)进行PVP洗脱实验时,PVP洗脱量还是停留在较低水平。然而,经过1年储存时间的透析器,PVP洗脱量增长约76.31%;储存时间为2年的透析器,PVP洗脱量增长约99.14%。数据显示,随着储存时间的延长,PVP洗脱量也呈现相应的增长趋势,但年增长速率变缓。
3 结论
本实验研究了电子束灭菌和储存时间对PES膜透析器中PVP洗脱的影响。实验采用的5组透析器都是同一批次原材料组装生产的,尤其是PES膜的生产工艺完全相同,即每支透析器所含的原始PVP添加量相同,这在以往的研究实验中很难达到。本研究证明电子束灭菌会增加透析器使用中PVP的洗脱量,同样,随着储存时间的延长,透析器中PVP的洗脱量也会相应增加。灭菌过程是医疗器械生产的关键生产工序,是透析器生产、销售的必备工序。在达到医疗器械无菌的情况下,适当调整灭菌剂量对产品质量十分关键。运输储存过程对于医疗器械质量控制也是十分关键,长时间储存会增加透析器PVP溶出,合理地设定透析器产品有效期,将提升产品质量,规避医疗器械上市后的一些非必要风险。
