甲烷等离子体裂解制氢制碳的影响因素研究
2023-09-19吴祖良成雨莲高尔豪朱佳丽姚水良王建新
吴祖良,成雨莲,高尔豪,李 晶,朱佳丽,姚水良,王建新,江 捷
(1.常州大学 环境科学与工程学院,石化行业先进等离子体催化技术工程实验室,江苏 常州 213164;2.浙江工商大学 环保设计研究院,浙江 杭州 310012)
氢气(H2)不仅是重要的化工原料,也是绿色高效的二次能源载体[1]。随着中国“双碳”战略的不断深化,氢能正受到越来越多的关注。主流的制氢技术包括天然气(甲烷)制氢、煤制氢、工业副产氢和电解水制氢等。其中,甲烷(CH4)制氢技术因其具备流程简单、装置可靠、投资成本低等优势被广泛应用,目前该技术制备的H2在全球H2产量中占比高达50%[2]。
常规的CH4制氢工艺主要包括CH4蒸汽重整(SRM)、CH4部分氧化(POM)和CH4自热重整(MATR)等[3],但这些CH4转化方法存在能耗较高、催化剂易失活、且伴随CO2排放等问题,近年来CH4直接裂解制氢受到持续关注,如等离子体裂解、催化裂解和金属熔融裂解等。CH4直接裂解不仅能够制得高纯H2,还副产纳米碳材料,且不会直接排放CO2。其中,等离子体裂解技术可以在相对较低的温度下直接激发、解离和电离CH4分子[4-6],产生一系列活性反应物种,包括振动和电子激发物种以及自由基等[7-10],从而实现CH4的高效活化转化,具有化学活性高、能耗低、即开即有、即关即停等优点[11],是CH4制氢领域具有良好应用前景的技术之一。
近年来,各种等离子放电系统如火花放电[12-13]、介质阻挡放电(DBD)[14]、滑动弧放电(GAD)[15]、射频(RF)放电[16]、微波(MW)放电[17]和电晕放电(CD)[18]等已用于CH4的转化。诸多研究表明,相较于介质阻挡放电和大气压射流等离子体放电过程来说,火花放电平衡度和气体分子温度都相对较高,等离子体放电中更多能量用于气体分子加热,热效应更显著,因而取得更高的CH4转化率和能量利用率。Kado等[12]在室温和大气压条件下比较了介质阻挡放电、电晕放电和火花放电转化CH4制备乙炔(C2H2)的性能,发现火花放电CH4转化率比介质阻挡放电和电晕放电高出60%左右。而孙昊等[19]发现在纳秒火花放电(0~2000 ns)输入能量为170 kJ/mol的条件下,CH4转化率可达60%,H2选择性为44.4%。此外,火花放电相比于其他放电形式还具有反应设备简单、转化率和能量利用效率高等优点,具有较好的工业化潜力。但是在CH4火花放电裂解中产生的纳米碳很容易沉积在电极表面,抑制放电。为此,有研究者试图通过改变电极结构来解决积碳和放电稳定性问题[20],此研究采用的针-针式电极结构减小了碳沉积面,放电区域的结碳问题大大缓解。另外,脉冲等离子体放电不仅具有优异的可调性,还能够产生均匀性好、电子能量高的低温非平衡等离子体,在CH4裂解和重整方面具有显著的优势[21]。
因此笔者采用针-针式纳秒脉冲火花放电裂解CH4,优化放电反应参数,重点研究放电功率、CH4浓度、CH4流量、反应温度以及背景气氛对CH4转化和产物分布的影响,并分析产物碳的形貌和石墨化程度,为火花放电CH4裂解的产物调控提供理论依据。
1 实验部分
1.1 原料与设备
实验中使用的气体如表1所示,主要仪器设备如表2所示。
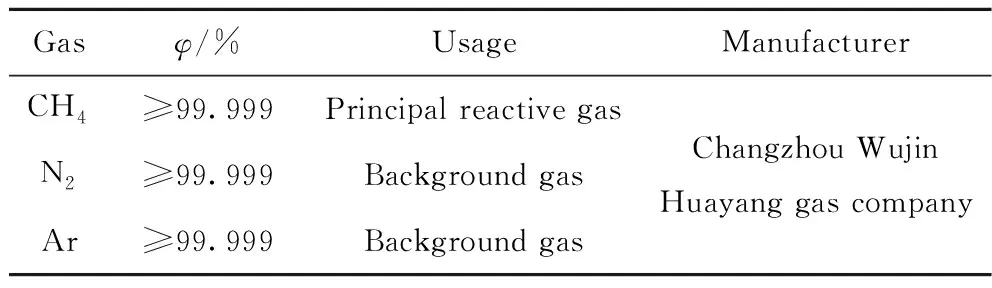
表1 实验用主要气体Table 1 Main gases used in the experiment

表2 实验用主要仪器设备Table 2 Main instruments and equipment used in the experiment
1.2 实验装置
火花放电CH4裂解实验系统和火花放电照片分别如图1所示。实验系统主要包括模拟气体发生系统(Ⅰ)、火花放电反应系统(Ⅱ)以及产物收集分析系统(Ⅲ)。模拟气体发生系统中2个质量流量计用于控制CH4和背景气体的流量,背景气体为N2或Ar。模拟气体总体积流量Q为20~50 mL/min,通过分别调节CH4和背景气体的流量形成一定初始体积分数(φ0)的CH4气体。火花放电反应系统包括高压脉冲电源、电压探头、电流探头、示波器以及放电反应器。高压脉冲电源输出的电压峰值范围是0~10 kV,频率范围是0~2000 Hz,使用电压探头和电流探头分别检测放电电压和电流波形,并用示波器记录,用于放电功率的计算。放电反应器两端设有聚四氟乙烯材质的进出气口,中间为石英玻璃管和置于管内的放电电极。石英玻璃管外径12 mm,内径10 mm,长400 mm。火花放电电极由2根不锈钢针组成,针电极直径为1 mm,两根针电极之间的间隙为3 mm。甲烷裂解产生的气相产物采用气相色谱仪(GC9790Ⅱ,TCD(TDX-01)+FID(Porapak N),福立分析仪器股份有限公司),柱前压0.1 MPa,检测器温度180 ℃,柱温50 ℃,进样口温度25 ℃)进行分析。在放电反应器后端用过滤装置捕集反应生成的纳米碳。纳米碳利用TEM(JEOL JEM 2100F,铜网制样,200 kV高压)和Raman(LabRam HR Evolution,激光器波长514 nm,测试范围1000~3000 cm-1)等表征手段分析其形貌和结构特征。
1.3 参数计算
反应器出口处检测到的气体物质有CH4、C2H2、C2H4、C2H6、H2等。由于CH4裂解反应导致进出口气体流量发生变化,所以CH4转化率X(CH4)(%)通过式(1)计算得到。
(1)
其中,φ(C2H2)、φ(C2H4)和φ(C2H6)分别为反应器出口气体中的C2H2、C2H4和C2H6的体积分数,%;φ(CH4)out为出口气体中CH4的体积分数,%;φ(C-CH4)为推算的转化为固相碳的CH4的体积分数,%,通过式(2)计算得到。
(2)
其中:φ(H2)out为反应器出口气体中的H2体积分数,%;φ(H2)CxHy为CH4转化为各碳氢类副产物(CxHy)时所产生的H2体积分数,%。通过式(3)计算得到。
φ(H2)CxHy=3φ(C2H2)+2φ(C2H4)+φ(C2H6)
(3)
H2的选择性S(H2)(%)的定义如式(4)所示。固相碳(C)、二碳(C2H2、C2H4或C2H6)的选择性SC(%)、SC2(%)定义如式(5)和式(6)所示。
(4)
(5)
(6)
其中:φ(CH4)in为反应器进口CH4的体积分数,%;φ(CH4)react为根据产物推算反应掉的CH4体积分数总和,%;φ(C2)代表C2H2、C2H4或C2H6的体积分数,%;φ(CH4)react用式(7)计算。
φ(CH4)react=2φ(C2H2+C2H4+C2H6)+φ(C-CH4)
(7)
放电功率P(W)的计算式为:
(8)
式中:f为脉冲频率,Hz;ti、ti+1分别为示波器采样点i、i+1的时刻,s;Ui、Ui+1分别为i、i+1时刻脉冲电源输出的电压,V;Ii、Ii+1分别为i、i+1时刻脉冲电源输出的电流,A。
2 结果和讨论
2.1 放电特性
实验中典型的火花放电电压-电流波形如图2所示。从图2中可知,放电电压和电流都呈现有规律的脉冲形式。实验中脉冲电压的峰值为5.5 kV,脉宽为85 μs,电流峰值达到200 A。在火花通道形成后,放电通道维持需要足够大的峰值电流(>2 A),同时放电须是短时间的脉冲放电,放电持续时间一般为10-7~10-3s。而实验中峰值电流为200 A,脉宽为85 μs,火花放电能量密度大且脉冲时间短,从而保证CH4的高效裂解。

图2 典型放电电压电流波形图(f=1000 Hz)Fig.2 Typical waveforms of discharge current and voltage (f=1000 Hz)
2.2 放电功率对CH4裂解的影响
等离子体化学的初始步骤主要是高能电子与气体分子的碰撞,这一过程有助于CH4直接分解生成·CH3和·H自由基,·CH3自由基再脱氢和·H的相互结合生成最终产物固相碳和氢气[22]。放电功率的高低直接影响自由基的生成,因此笔者首先研究了放电功率对CH4裂解的影响。在实验中发现,CH4裂解的产物主要为H2、纳米碳C、C2H2、C2H4和C2H6等。
气体流量30 mL/min、CH4初始体积分数15%时不同放电功率下CH4裂解转化和产物选择性如图3所示。从图3(a)可知:CH4的转化率随着放电功率的增大而升高;当放电功率从25 W增大到60 W时,CH4转化率从59.86%提高至76.60%;同时H2选择性从66.17%增加至70.19%。另外,从图3(b)产物选择性结果可知:C2H2的选择性最高,C选择性次之,而C2H4和C2H6的选择性均远低于C2H2和C;当功率为25 W时,C2H2、C、C2H4和C2H6的选择性分别为61.57%、35.37%、0.48%和2.56%。随着放电功率增大到65 W,C2H2、C2H4和C2H6的选择性分别下降了2.51%、0.21%和0.34%,而C的选择性则提高了3.06%。当放电功率增大,放电间隙内放电强度、电子密度和电子碰撞频率均提升,这有助于CH4的裂解,减少副产物的生成,提高H2和纳米碳的选择性[23-24]。
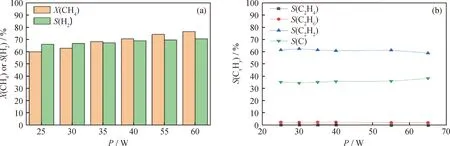
图3 不同放电功率(P)对CH4裂解的影响Fig.3 Effect of different discharge powers (P)on CH4 dissociation(a)Methane conversion and hydrogen selectivity;(b)Product selectivityConditions:Q=30 mL/min;φ0(CH4)=15%
2.3 CH4初始体积分数对CH4裂解的影响
图4反映了气体流量30 mL/min、放电功率40 W时不同CH4初始体积分数下CH4的转化和产物选择性。从图4(a)中可知:随着CH4初始体积分数从5%增大到100%,CH4转化率由63.11%下降至31.51%;H2选择性也从69.51%下降至60.34%;而在图4(b)中,C2H2选择性从57.19%上升至66.34%;C选择性由38.69%下降至26.68%;C2H4和C2H6的选择性保持在较低水平。电子碰撞反应是CH4裂解的最重要途径,在相同的放电功率下,放电产生的电子密度是一定的。随着CH4初始体积分数的增大,CH4分子与电子的碰撞、激发、解离的概率增加,但中间产物·CH3、·CH2、·CH和·H之间的反应增多,最终导致CH4裂解成H2和纳米碳的选择性下降,而中间产物C2H2的选择性反而升高。
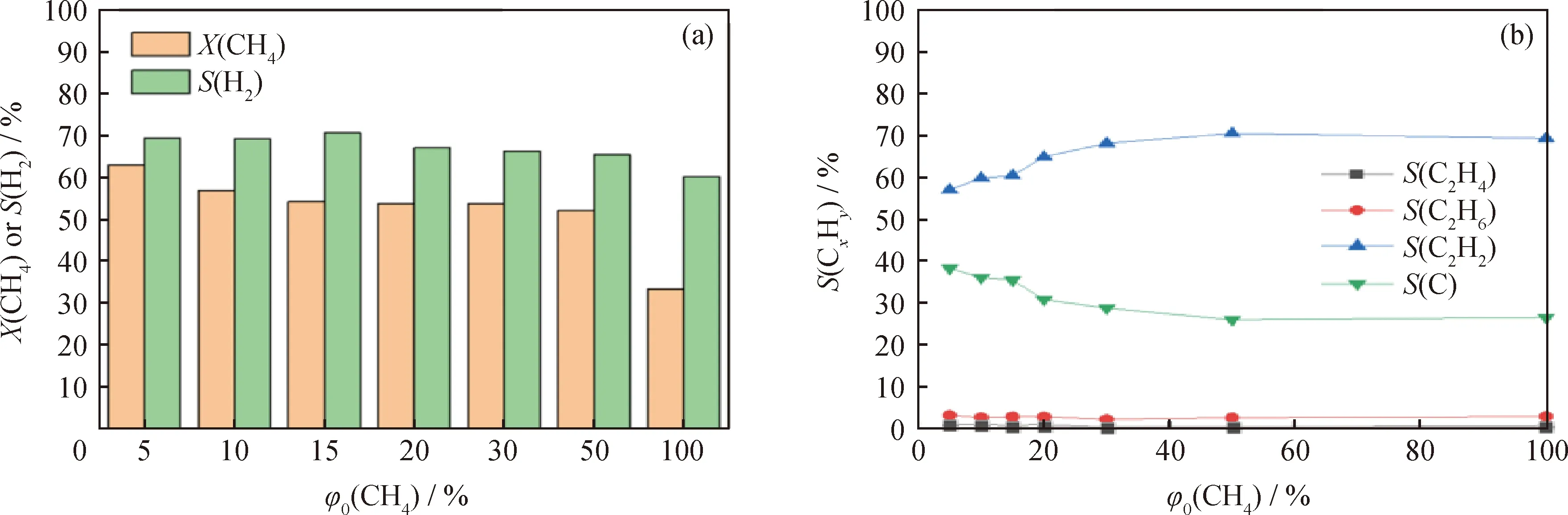
图4 不同CH4初始体积分数(φ0(CH4))对CH4裂解的影响Fig.4 Effect of different initial CH4 volume fraction (φ0(CH4))on CH4 dissociation(a)Methane conversion and hydrogen selectivity;(b)Product selectivityConditions:Q=30 mL/min;P=40 W
2.4 气体流量对CH4裂解的影响
图5反映了放电功率40 W、CH4初始体积分数15%时不同CH4流量下CH4转化率和产物选择性。由图5(a)可知:当CH4流量从20 mL/min增加至60 mL/min时,CH4转化率逐步降低,由76.85%降至50.71%;H2选择性也随之降低,从76.85% 降至66.32%。而在图5(b)中,当CH4流量从20 mL/min增至60 mL/min时,C2H2的选择性增加了6.11百分点,C的选择性下降了5.85百分点。由于气体流量的增大,气体流动的线速率增大,停留时间相对减少,导致单位时间内,单位质量的反应物受高能电子碰撞、激发解离的量降低[25],从而使CH4转化率降低,H2选择性下降[26]。因此,低CH4流量更利于实现CH4的高转化率与H2的高选择性。

图5 不同气体流量(Q)对CH4裂解的影响Fig.5 Effect of different gas flow rates (Q)on CH4 dissociation(a)Methane conversion and hydrogen selectivity;(b)Product selectivityConditions:P=40 W;φ0(CH4)=15%
2.5 反应温度对CH4裂解的影响
图6显示了气体流量30 mL/min、放电功率40 W、CH4初始体积分数15%时,不同反应温度下CH4转化率与各产物选择性的变化趋势。当小于500 ℃时,反应温度对CH4转化的影响较小。由图6(a)可知,随着反应温度升高至800 ℃,CH4转化率仍然维持在70%左右,而H2选择性则下降了4.09%。从图6(b)中可知,当反应温度从500 ℃升高至800 ℃时,C2H2、C2H4、C2H6和C的选择性有显著的变化。C2H2选择性由59.56%下降至 22.73%,C、C2H4、C2H6选择性分别由36.25%、0.40%、2.23%增大至62.35%、1.31%、13.59%。这是因为,在500 ℃以上的高温下,C2H2容易发生热裂解,生成纳米碳和H2,导致C2H2的选择性下降,C的选择性提高[27]。同时高温下CH4裂解生成的自由基可能发生重组反应形成更多的C2H4与C2H6[28]。综上所述,高温有助于实现更高的C选择性,但其对CH4转化率和H2的选择性影响不大。
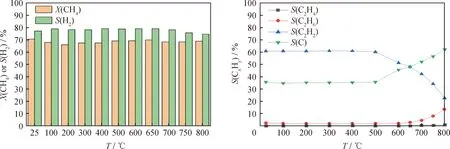
图6 不同反应温度(T)对甲烷裂解的影响Fig.6 Effect of different reaction temperatures (T)on CH4 dissociation(a)Methane conversion and hydrogen selectivity;(b)Product distribution Q=30 mL/min;P=40 W;φ0(CH4)=15%
2.6 背景气体种类对CH4裂解的影响
不同的背景气体在等离子体碰撞过程中会产生不同的激发态物质,其对CH4转化程度以及产物分布均产生影响。有研究[29]表明,由电子激发N2得到的自由基更有助于CH4裂解形成CH3与H,与Ar激发态下的CH4裂解相比,CH2与CH形成更少。图7为气体流量30 mL/min、CH4初始体积分数10%时N2与Ar背景气氛下CH4转化率与各产物选择性对比图。由图7(a)可知,CH4在Ar气氛下实现了更高的转化率。在60 W功率下,Ar气氛的CH4转化率(83.56%)相比N2(63.05%)提高20.51百分点,H2选择性为70.28%。这是由于电子与Ar碰撞后产生亚稳态Ar激发态,激发态的Ar原子的能量远高于CH4的解离所需的能量,这促进了CH4转化;而N2气氛下N2分子自身具有复杂的振动能级结构,可能会消耗部分高能电子用于振动激发过程,导致CH4转化的能量注入减少。但Ar气氛下H2的选择性反而有所下降。图7(b)中50 W功率下Ar气氛的C2H2的选择性(79.45%)比N2(55.08%)的高24.37 百分点,而Ar气氛的C选择性(53.12%)比N2(77.00%)的低23.88 百分点。图7(c)中,C2H4与C2H6均在Ar气氛下表现出更低的选择性。这是由于在Ar激发态下的有效二次碰撞相对更少,C2H2的进一步脱氢受到抑制,导致Ar背景气氛下H2的选择性更低,而C2H2的选择性更高。另外,Ar加入能够抑制C2H4和C2H6生成[30]。
2.7 碳的形态和结构
在影响成核和生长过程的众多因素中,背景气体在没有催化剂的情况下对产品的形成和性能起着决定性的作用,气体原子或离子直接参与碳纳米材料的成核和生长[31]。图8为气体流量30 mL/min、放电功率40 W、CH4初始体积分数15%时Ar与N2背景气氛下生成的纳米碳的TEM和Raman表征结果。从图8(a)中可知:CH4在N2气氛下裂解生成的纳米碳为直径20~30 nm的无定形碳;而在Ar气氛下出现了大量纳米碳的团聚,并形成了间距恒定的石墨层结构,且出现向纳米碳颗粒中心生长的趋势,纳米碳的结晶度更高。同时笔者对2组实验获得的纳米碳样品进行了拉曼表征,结果如图8(b)所示。从图8(b)中可知,D波段(≈1340 cm-1)和G波段(≈1580 cm-1)在谱图中清晰可见。D波段对应非晶态的sp3碳,G波段对应晶体有序的sp2碳。ID/IG表示生成纳米碳中的非晶态碳与晶体有序石墨型碳的程度比,ID/IG越小,结晶度越高,石墨化程度越高。根据图8(b)可计算得到,Ar气氛和N2气氛下ID/IG分别为0.70和0.82。所以在Ar气氛下所生成的纳米碳石墨化程度更高。
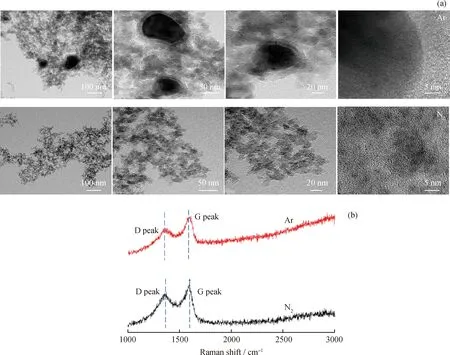
图8 Ar与N2背景气氛下纳米碳的表征结果Fig.8 Nano-carbon characterization results in Ar and N2 background gases(a)TEM;(b)Raman
3 结 论
(1)甲烷火花放电裂解的主要产物为H2、纳米碳C和C2H2,同时也有少量的C2H4和C2H6生成。放电功率的增加有助于CH4的裂解,提高了H2和C的生成,而其他产物C2H2、C2H4和C2H6的生成均有所减少。CH4初始体积分数和气体流速的提高不利于CH4的裂解转化。
(2)500 ℃以下的反应温度对甲烷转化影响不大,但当反应温度从500 ℃升高至800 ℃时,C2H2高温分解及加氢反应加快,C、C2H4、C2H6的选择性明显提高。
(3)与N2相比,放电中Ar激发态引发的碰撞反应更能促进CH4的初步分解和C2H2的形成,并且生成的纳米碳的石墨化程度更高。
