Au/Cu2O@Au可见光催化CO2还原性能
2023-09-19史军军
张 瑞,齐 仲,史军军,贺 婕
(1.天津理工大学 集成电路科学与工程学院,天津 300384;2.中石化石油化工科学研究院有限公司,北京 100083)
随着工业的迅速发展和人口的快速增长,人类对化石能源的过度消耗引发了两大关键难题,即不可再生的化石能源的逐渐枯竭问题,以及化石能源燃烧造成的空气污染和气候变化问题[1-3]。因此,如何实现大气中的CO2水平的显著降低并以有效的方式加以利用已成为一个全球性的研究课题[4-6]。
至今,人们提出了许多策略用来缓解CO2排放过量带来的能源问题和环境问题,如,提高化石能源的转换效率以减少化石燃料的使用、CO2捕获和储存、以及CO2捕获和利用[7-8]。光催化技术,能够像植物一样利用太阳光将CO2转化为有用化学品,是一种有前景的可持续能源技术。能够将CO2转化为高价值的化学燃料或化工原料,进而减少煤化工、石油化工过程的碳排放,是实现绿色经济和循环经济的有效技术路径[9-10]。然而,CO2是一种具有超高稳定性的分子(在298 K时,断开CO2中的C=O键所需能量为804.4 kJ/mol),因而将CO2转化为可用化工原料在热力学上反应难度较大;另外,光催化分解水析氢(HER)是光催化CO2还原(CO2RR)的竞争反应,且HER在动力学上比CO2RR更容易[11],这也会降低光催化CO2还原反应碳产物选择性。
氧化亚铜(Cu2O)是典型的p型窄带隙半导体,具有合适的带边位置,且已被证明具有抑制HER和增强CO2还原反应的能力[12]。然而,Cu2O很容易被光生载流子氧化或还原而导致失活。因此,开发高活性、高选择性和稳定的光催化剂是光催化CO2还原的关键[13-14]。现有研究表明,空腔Cu2O具有在光催化反应中保持稳定的潜力[15-16]。为提高光催化CO2还原反应生成一氧化碳(CO)选择性和活性,一方面,需要提高催化剂的光吸收、促进光生载流子的分离,进而提高其还原CO2的活性;另一方面,需增强O质子在催化剂表面的吸附和CO在催化剂表面的脱附,进而提高CO的选择性。
基于已有研究结果,笔者通过一步法在空腔Cu2O的表面和空腔内部引入金属Au,构建Au/Cu2O异质结,基于该结构在金属与半导体之间形成肖特基势垒,加速光生载流子的分离、金属Au的局域表面等离子体共振(LSPR)效应,促进催化剂的光吸收、金属Au对O原子的强吸附和对*CO(CO2生成CO的中间体)的弱吸附等3方面特点,从而提高CO的选择性和催化剂的催化活性。
1 实验部分
1.1 原料和试剂
三水硝酸铜(Cu(NO3)2·3H2O)、N,N-二甲基甲酰胺(DMF)、五水硫酸铜(CuSO4·5H2O)、氢氧化钠(NaOH)、一水合葡萄糖(C6H12O6·H2O)、碳酸氢钾(KHCO3),均为分析纯,阿拉丁试剂(上海)有限公司产品;氯金酸(HAuCl4),99.99%,麦克林试剂(上海)有限公司产品;Nafion,成膜剂,质量分数为5%,Alfa Aesar公司产品;异丙醇,分析纯,天津康科德科技有限公司产品;去离子水,实验室自制。
1.2 光催化剂的制备
1.2.1 空腔Cu2O光催化剂的合成
将84 mg的Cu(NO3)2·3H2O溶解在35 mL的DMF中,超声处理10 min后,转移到容量高压反应釜中,在150 ℃下加热30 h。该反应中,DMF作为还原剂,实现Cu2+的还原[17]。待高压釜冷却至室温后,采用6000 r/min转速离心收集样品,并用乙醇洗涤3次。将样品在60 ℃下真空干燥6 h,得到空腔Cu2O光催化剂。
1.2.2 Au/Cu2O@Au光催化剂的合成
在合成空腔Cu2O光催化剂的前驱体溶液中,加入0.3 mL(Au3+/Cu2+的摩尔比为1/20)的HAuCl4溶液(质量浓度10 g/L),合成条件以及样品收集和干燥过程同1.2.1节,得到Au/Cu2O@Au光催化剂。
1.2.3 26面体Cu2O光催化剂的合成
将3.7452 g的CuSO4·5H2O溶解在50 mL的去离子水中,70 ℃水浴加热2 min后,缓慢滴入30 mL的 NaOH溶液(浓度3 mol/L)。搅拌5 min后,加入5 mL葡萄糖溶液(质量浓度0.12 g/mL),老化1 h,生成紫黑色沉淀。老化结束后,待溶液冷却至室温后,样品收集和干燥过程同1.2.1节,得到26面体Cu2O光催化剂,记作26-Cu2O。
1.2.4 Au/26-Cu2O和S-Au/Cu2O光催化剂的合成
采用浸渍法在26面体Cu2O和空腔Cu2O催化剂上负载金属Au:将上述过程制备的26-Cu2O催化剂(72 mg)在室温下搅拌分散到50 mL去离子水中,加入0.4 mL(Au/Cu2O的摩尔比为1/10)的HAuCl4溶液(质量浓度10 g/L),遮光下搅拌5 h。样品收集和干燥过程同1.2.1节,将收集到的样品标记为Au/26-Cu2O。将26-Cu2O催化剂替换为空腔Cu2O催化剂,即可得到负载Au的Cu2O光催化剂,记作S-Au/Cu2O。
1.3 光催化剂的表征
1.3.1 X射线衍射(XRD)
光催化剂的物相分析使用日本理学Rigaku mini FlexII型X射线衍射仪,阳极靶为铜靶,X射线放射源为CuKα射线,波长λ为0.15406 nm,测试时工作电压为40 kV,工作电流为100 mA,设置扫描速率为8 °/min,扫描步长为0.02°,扫描范围为20°~80°。
1.3.2 扫描电子显微镜(SEM)
采用装配有能量色散X射线光谱仪(EDS)的JEOL JSM-7800F场发射扫描电子显微镜对光催化剂进行形貌和元素分布分析。
1.3.3 透射电子显微镜(TEM)
采用Tecnai G2F20型透射电子显微镜观察光催化剂的微结构,工作电压为200 kV,该TEM装配有EDS,可用来进行样品的成分和元素分布分析。
1.3.4 紫外-可见(UV-Vis)分光光度计
采用岛津UV-2600型紫外-可见(UV-Vis)分光光度计测量样品的紫外可见UV-Vis吸收光谱和UV-Vis漫反射光谱。
1.3.5 X射线光电子能谱(XPS)
采用PHI5000 Versa Probe仪器对样品进行XPS表征。XPS的激发源为一定能量的电子束轰击铝(Al)阳极靶产生的X射线,再经石英晶体单色化后留下的AlKα1射线(hv=1486.6 eV)。
1.4 光催化剂的性能评价
1.4.1 光电化学性能测试
测试采用三电极体系,工作电极采用环氧树脂密封以防止漏电,并预留出电极夹夹持位置。铂片作为对电极,Ag/AgCl(3.5 mol/L KCl)电极作为参比电极,电解液为CO2饱和的0.1 mol/L KHCO3水溶液。通过式(1)将所有电位E(V)转换为可逆氢电极(RHE)标度:
E(vs. RHE)=E(vs. Ag/AgCl)+0.197+0.0591×pH
(1)
光电流测试采用计时电流法(i-t),电化学阻抗谱(EIS)测试的频率范围为0.1 Hz~100 kHz。莫特-肖特基曲线(MS)测试的电解液为0.5 mol/L的Na2SO4水溶液,测试的频率固定在5、10 kHz。
通过MS测试可以得到半导体的平带电位,进一步通过公式计算得出半导体的带边位置。具体计算过程如下:首先利用测到的MS曲线,根据式(2)确定催化剂的平带电位和载流子密度NA(cm-3)[18]。
1/C2=2/(eεrε0NA)×(V-VFB-kBT/e)
(2)
式中:C为半导体的空间电荷电容,cm2/F;e是电子电荷量,C;ε0为真空中的介电常数,F/m;εr为相对介电常数(Cu2O的εr为7.6)[18];V是外加偏压,V vs. RHE;kB是玻尔兹曼常数,J/K;T是温度,K。平带电位VFB(V)的大小是1/C2与V的关系曲线的线性部分外推到x轴上的得到的。
半导体的价带边EV(V vs. RHE)位置:
EV=EFB-kBTln(NV/NA)
(3)
(4)

1.4.2 光催化CO2还原性能测试
光催化CO2还原产物的定量测试采用离线方式。将0.5 mg光催化剂放于400 μL异丙醇中超声分散30 min,然后加入10 μL Nafion溶液超声30 min,制成电极墨水。取所有的墨水滴涂在导电玻璃FTO上,自然晾干后作为光催化CO2RR的测试样品。电解液为CO2饱和的0.1 mol/L KHCO3水溶液。光源为带有420 nm截止滤光片的300 W氙灯,光照强度为20 mW/cm2。测试前电解液中通入高纯CO2持续搅拌30 min以去除空气并达到CO2饱和。之后将整个反应池进行密封。整个过程处于搅拌中,每隔1 h用取样针进行取样,将得到的产物用气相色谱(福立9790 Plus型)进行定量分析。反应产物产率(Yi,μmol/(g·h))的计算式如式(5)所示。
(5)
式中:QCO为每克(g)光催化剂在t时间内的反应产物i的产量,μmol/g;t为测试时间,h。
产物的选择性定义为转移到目标产物的电荷与反应转移的总电荷的比。假设光催化CO2还原产物只有CH4和CO,则CO选择性(S,%)为[19]:
(6)
式中:YCO为CO产率,YCH4为CH4产率,单位均为μmol/(g·h)。
2 结果与讨论
2.1 X射线衍射分析
图1为空腔Cu2O和Au/Cu2O@Au样品的XRD图谱。由图1可知,该方法合成的Cu2O结晶性良好,在2θ为36.42°、42.30°、61.34°以及73.53°处均可以清楚观察到Cu2O的衍射峰,分别与Cu2O(PDF#05-0667)的(111)、(200)、(220)和(311)面相匹配。在Au/Cu2O@Au样品的XRD图谱中可明显观察到位于2θ为38.19°、44.39°、64.58°和77.57°的衍射峰,分别对应于Au(PDF#65-2870)的(111)、(200)、(220)和(311)面,证明了金属Au的成功引入。
2.2 扫描电镜分析
图2给出了空腔Cu2O样品的SEM照片。从图2可以看出,Cu2O样品为大小均匀的球形,直径约为200 nm。

图2 Cu2O光催化剂的SEM照片Fig.2 SEM images of Cu2O photocatalyst
图3给出了Au/Cu2O@Au样品的SEM照片和EDS图谱。由图3(a)和(b)可知,该样品呈现出大小均匀的类球形,直径约为500 nm,这说明金属Au的引入,使颗粒的尺寸变大。由图3(c)和(d)可知,在空腔Cu2O表面存在Au纳米颗粒的均匀分布,且Au的负载量(质量分数,下同)为6.8%。

α—Error value of mass fraction图3 Au/Cu2O@Au光催化剂的SEM照片Fig.3 SEM images of Au/Cu2O@Au photocatalyst(a),(b)SEM images;(c)EDS;(d)EDS mapping
2.3 透射电镜分析
图4为Cu2O催化剂的TEM照片。由图4可以看出,每个Cu2O颗粒都形成了空腔结构,说明样品为空腔的Cu2O催化剂。空腔Cu2O催化剂的形成过程如下[17]:首先,CuO纳米晶团聚为实心的球形CuO;随着反应的进行,CuO实心球逐渐被还原为Cu2O实心球;随后的Ostwald熟化过程,使位于Cu2O实心球中心的小颗粒向外部迁移,随着老化时间的增加,空腔越来越大。空腔结构具备的限域效应会增强反应物在催化剂空腔内的浓度,进而有利于提高催化剂的光催化性能[15]。

图4 Cu2O光催化剂的TEM照片Fig.4 TEM images of Cu2O photocatalyst
图5(a)和(b)为Au/Cu2O@Au催化剂的TEM照片,可以看出,样品整体呈类球形,表面存在絮状小颗粒。图5(c)为催化剂表面区域的高分辨TEM(HRTEM)照片,显示出清晰的晶格条纹,说明样品的结晶度较好。晶格间距d=0.213 nm对应于Cu2O的(111)面,晶格间距d=0.204 nm对应于Au的(111)面[20],说明了Au和Cu2O的存在,这与XRD的结果相一致,并且证明了表面絮状小颗粒为金属Au。图5(d)为Au/Cu2O@Au催化剂的EDS照片,说明了该催化剂具有Au与Cu2O的核壳结构,金属Au集中分布在Cu2O内部;而在Cu2O的其他位置Au元素均匀分布。在形成空腔Cu2O催化剂的前驱液中加入HAuCl4溶液后,由于HAuCl4的受热易分解特性,金属Au最先生成且成为CuO的成核位点被包裹在最终形成的Cu2O腔内,多余的金属Au则分布在Cu2O表面。结合SEM和TEM的结果,进一步证明一步法实现了在空腔Cu2O的腔中和表面引入金属Au。

图5 Au/Cu2O@Au光催化剂的TEM照片Fig.5 TEM images of Au/Cu2O@Au photocatalyst(a),(b)TEM images;(c)HRTEM;(d)EDS mapping
2.4 光催化性能分析
为了探究光催化剂中金属Au的引入对光催化还原CO2活性和选择性的影响,测试了空腔Cu2O催化剂和Au/Cu2O@Au催化剂在5 h连续可见光照射下光催化还原CO2的性能,结果如图6所示。由图6可以看出,在光照强度为20 mW/cm2的可见光照射1 h下,空腔Cu2O催化剂的产物(CH4和CO)产率和选择性分别为2.09 μmol/(g·h)(选择性64.46%)和4.61 μmol/(g·h)(选择性为35.54%);Au/Cu2O@Au催化剂的产物(CH4和CO)产率和选择性分别为4.86 μmol/(g·h)(选择性为31.62%)和42.04 μmol/(g·h)(选择性为68.38%)。相比空腔Cu2O催化剂,Au/Cu2O@Au催化剂呈现出CO产率和选择性的显著提高,CO产率提高了8.12倍,选择性提高了32.84百分点。通过式(6)可知,Au/Cu2O@Au催化剂具有较高的电荷转移数,说明该催化剂有较高的太阳光利用率。
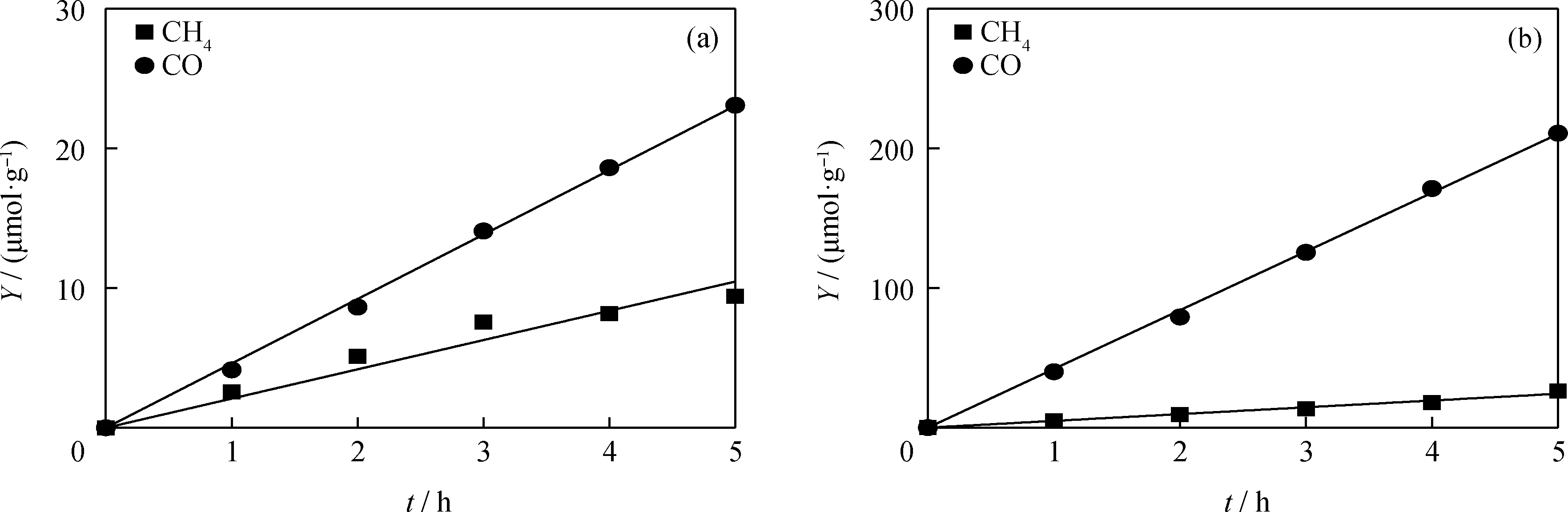
图6 Cu2O和Au/Cu2O@Au光催化剂的光催化还原CO2的产物产率随反应时间的变化Fig.6 Variation of product yields of photocatalytic CO2 reduction of Cu2O and Au/Cu2O@Au photocatalysts with reaction time(a)Cu2O;(b)Au/Cu2O@Au Reaction conditions:Visible light with a light intensity of 20 mW/cm2
为了探究Au对Cu2O催化性能的促进作用,制备了26-Cu2O、Au/26-Cu2O以及S-Au/Cu2O 3个催化剂,并测试了其光催化还原CO2的性能。图7和图8为26-Cu2O、Au/26-Cu2O和S-Au/Cu2O催化剂的SEM照片,证明了催化剂的成功制备,且S-Au/Cu2O催化剂的Au只分布在催化剂表面。由8(c)可知,S-Au/Cu2O催化剂中Au负载量为7.7%,略高于Au/Cu2O@Au中Au的负载量(6.8%)。

图7 26-Cu2O和Au/26-Cu2O光催化剂的SEM照片Fig.7 SEM images of 26-Cu2O and Au/26-Cu2O photocatalysts(a),(b)SEM images of 26-Cu2O;(c)SEM image and (d)EDS mapping of Au/26-Cu2O
表1中展示了26-Cu2O、Au/26-Cu2O和S-Au/Cu2O催化剂在2 h连续可见光照射下光催化还原CO2的性能。为了更清楚地展示Au及其分布对催化剂光催化还原CO2性能的作用,将本研究所制备的催化剂的性能汇总于表1。由表1可知:Au具有提高Cu2O光催化还原CO2的产物产率和CO选择性的作用;且本工作中的Au/Cu2O@Au催化剂的光催化性能相比于已报道的光催化剂具有明显优势[21-25]。由图6(b)可知,在Au含量相当的情况下,Au的分布是提高光-化学转换效率的关键因素。Au/Cu2O@Au光催化剂中的Cu2O的表面和空腔内部分布Au颗粒,与空腔限域效应协同作用,实现了CO产率和选择性的提高。

表1 不同光催化剂光催化还原CO2的产率及选择性Table 1 Yield and selectivity of photocatalytic CO2 reduction of different photocatalysts
2.5 光电化学和光吸收性能分析
通过催化剂的光响应曲线,研究了催化剂的光生载流子分离和转移。图9给出了分别在暗态和可见光照射下的空腔Cu2O和Au/Cu2O@Au光催化剂的电流密度与时间的关系曲线。图9中光催化剂在暗态和光照下的电流变化即为两者的光电流密度,依次为-13.88、-36.26 μA/cm2,这表明Au/Cu2O@Au光催化剂的光生电子-空穴对的重组受到了抑制[26-27]。测试20 min后,2种催化剂的光电流密度保持较好,这与催化剂的结构和金属Au的引入有关。
利用图10中EIS的Nyquist图,分析了不同电极的电荷转移电阻。半圆的直径表示电荷转移电阻(Rct)。通过拟合等效电路图,得到Cu2O和Au/Cu2O@Au催化剂的Rct分别为1029.0 Ω和954.5 Ω,表明Au/Cu2O@Au催化剂的电荷转移电阻较小,反映了Cu2O与Au异质结原位形成后催化剂的电导率增强,电荷转移更快[27]。上述光电化学测量结果表明,Au/Cu2O@Au催化剂具有较高的电导率、较快的电荷转移速率以及较高的光生载流子分离效率。
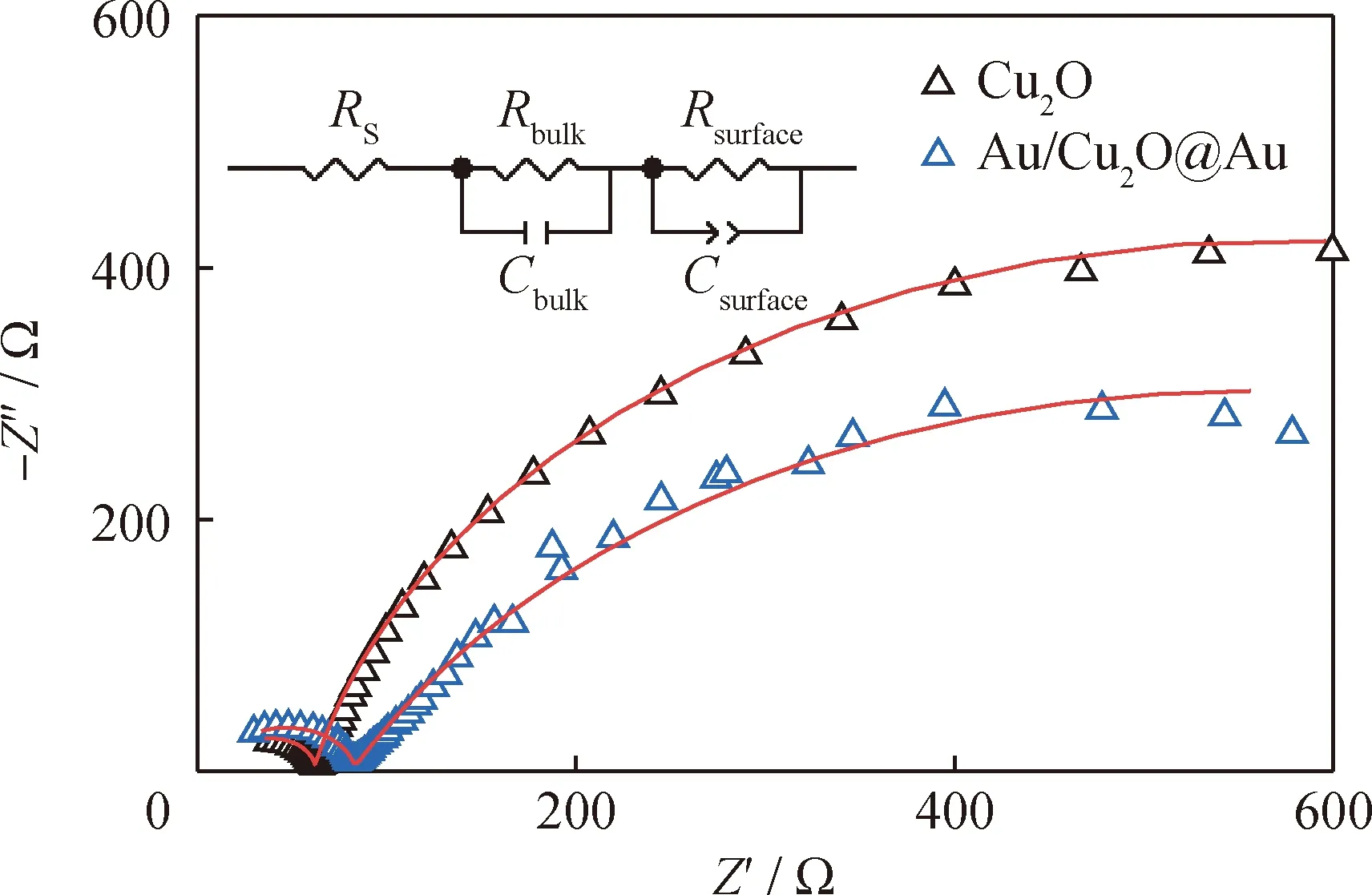
图10 Cu2O和Au/Cu2O@Au光催化剂的EIS曲线Fig.10 EIS plots of Cu2O and Au/Cu2O@Au photocatalysts
为了研究光催化剂的可见光吸收特性,采用UV-vis分光光度计获得了空腔Cu2O和Au/Cu2O@Au催化剂的UV-vis光吸收谱,如图11所示。由图11可以看出,Au/Cu2O@Au催化剂在整个可见光范围内都有很强的光吸收,且在550 nm处呈现出很强的Au的LSPR效应[28],该效应增强了Au/Cu2O@Au催化剂对可见光的吸收能力,增强了体系的光吸收。

图11 Cu2O和Au/Cu2O@Au光催化剂的光吸收曲线Fig.11 Light absorption plots of Cu2O and Au/Cu2O@Au photocatalysts
为了得到Cu2O的带隙,研究了Au/Cu2O@Au催化剂的光生电子转移路径,进行了Cu2O的带隙表征。图12为Cu2O催化剂的带隙图,得到Cu2O催化剂的带隙为2.47 eV。
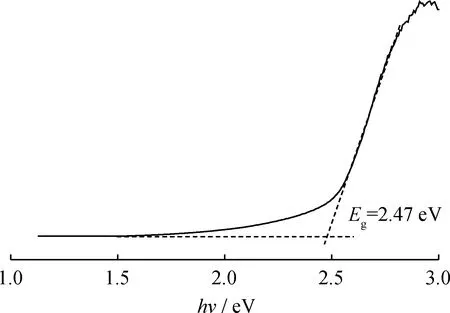
图12 空腔Cu2O的带隙图Fig.12 Bandgap plot of cavity Cu2O
通过测试MS曲线得到了Cu2O样品的平带电位,如图13(a)所示。负的斜率表明Cu2O是p型半导体。由图13(a)的MS曲线与x轴的交点可知,Cu2O的平带电位为+0.51 V vs. RHE。根据式(2)~(4)计算出纯Cu2O催化剂的价带顶和导带底的位置分别为1.23和-1.24 V vs. RHE。金属Au引入后,催化剂的平带电位负移(图13(b)),说明金属Au与Cu2O形成的是利于光生电子向金属Au转移的肖特基接触。

图13 Cu2O和Au/Cu2O@Au光催化剂的MS曲线Fig.13 MS curve of Cu2O and Au/Cu2O@Au photocatalysts(a)Cu2O;(b)Au/Cu2O@Au
为了进一步验证Au与Cu2O之间的接触形式,对Cu2O和Au/Cu2O@Au催化剂进行了XPS表征,Cu的LMM谱和Au的4f谱如图14所示。图14(a)中Cu2O催化剂在569.9 eV附近的峰对应于Cu+、Au的引入,使该峰向低结合能方向偏移,说明Cu得到了来自于Au的电子[20];图14(b)中Au/Cu2O@Au催化剂的Au 4f峰为Au 4f5/2(92.7 eV)和Au 4f7/2(84.8 eV),比金属态的Au 4f峰(Au 4f5/2(87.1 eV);Au 4f7/2(83.4 eV))[29]有更高的结合能,这进一步证明了Au的电子向Cu的转移,说明金属Au与Cu2O形成了肖特基接触。该肖特基接触的形成,有利于Cu2O在光照下产生的光生电子从Cu2O向金属Au转移,并与吸附在金属Au的CO2反应物发生还原反应。
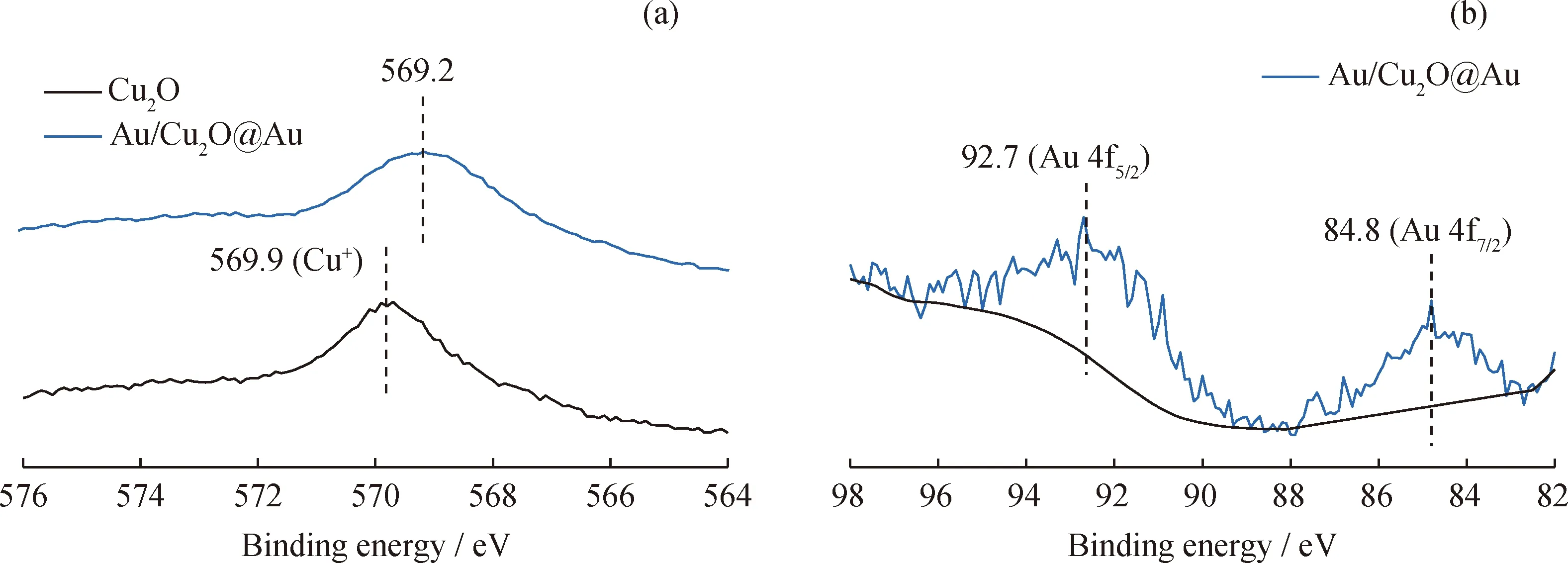
图14 Cu2O和Au/Cu2O@Au光催化剂的XPS谱图Fig.14 XPS spectra of Cu2O and Au/Cu2O@Au photocatalysts(a)Cu LMM spectra;(b)Au 4f spectrum

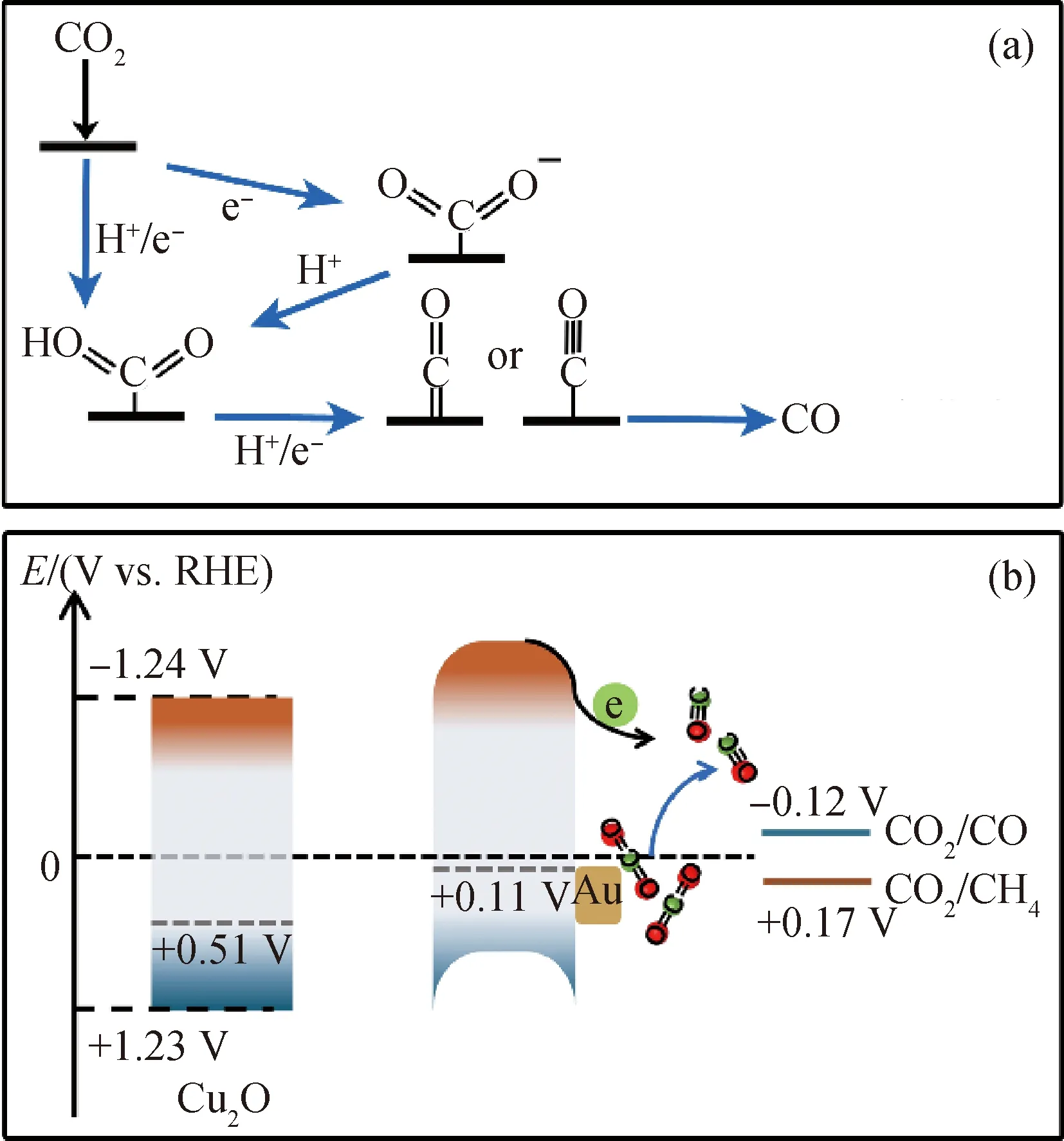
图15 Au/Cu2O@Au光催化剂催化CO2还原反应的机理示意图Fig.15 Schematic diagram of mechanism for the photocatalytic CO2 reduction of Au/Cu2O@Au photocatalyst(a)CO2 reduction reaction path;(b)Photocatalytic mechanism
图15(b)给出了Au/Cu2O@Au催化剂的能带结构示意图,可以看出,Cu2O的导带底位置比CO2还原为CH4(+0.17 V vs. RHE)和CO(-0.12 V vs. RHE)所需的还原电位更负,为可见光光催化CO2还原热力学提供了强大的驱动力。Cu2O与Au形成的肖特基接触易于光生电子与空穴的分离;Au纳米颗粒产生的LSPR效应增强了Au/Cu2O@Au催化剂对可见光的吸收,从而提高了光催化剂的催化效率。由于金属Au在Cu2O表面的均匀分布,使光催化剂表面存在多个电子转移通道和高电子密度的中心[9];金属Au在空腔中的存在使空腔内部具有高的中间产物浓度;结合金属Au对O的强吸附和对*CO的弱吸附的吸附特性,从而提高了光催化剂生成CO的选择性[31-32]。
3 结 论
通过在空腔Cu2O的表面和空腔内部引入Au纳米颗粒,合成了Au/Cu2O@Au光催化剂,该催化剂具有优异的光催化还原CO2性能。研究表明,金属Au的引入提高了光催化剂对可见光的吸收能力、光生载流子分离和转移能力,有效抑制了光生载流子的复合,实现了光催化还原CO2性能的显著提升。在光照强度为20 mW/cm2的可见光照射下,该光催化剂将CO2光催化还原为CH4和CO的产率分别为4.86和42.04 μmol/(g·h)。与空腔Cu2O光催化剂相比,CO产率提高了8.12倍,选择性提高了32.84百分点。以上结果,为设计高效的CO2还原光催化剂提供了新思路,有利于后续CO2还原反应的产物选择性的调控研究。
