冷等离子体耦合MoxC-Ni/Al2O3催化剂用于甲烷水汽重整制氢反应
2023-09-19刁亚南方健聪
刁亚南,所 聪,张 晓,方健聪,石 川
(大连理工大学 化工学院 精细化工国家重点实验室,辽宁 大连 116024)
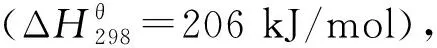
碳化钼(MoxC)材料具有类贵金属性质,同时可作为载体和助剂起到分散和稳定金属的作用,作为一种新型催化材料在甲烷重整制氢反应过程中展现出独特优势。本课题组前期研究工作表明[12-15]:碳化钼基催化剂材料由于独特的能带结构和电子性质,展现出优异的低温活化H2O分子的催化性质,将其与传统Ni基催化剂进行复合,能够有效缓解甲烷活化速率过快带来的表面积炭问题;同时,活性金属与碳化钼间的强相互作用有利于活性界面的有效构建以及活性金属的铆定,为高稳定、抗烧结型Ni基催化剂的设计构建提供了有效的解决方案。
另一方面,除了对催化剂的创新设计,高效的工艺过程强化开发同样至关重要。如将新型催化体系与外场能量进行耦合,以有效地将热、电和光能等转化为活化CH4分子和H2O分子的驱动力,可实现温和条件下CH4、H2O等分子的高效活化转化[16]。冷等离子体具有高能电子,提供了一种低温活化反应物分子的独特技术,作为一种化学反应的促进手段,可以完成许多常规条件下难以进行的化学反应[17-18]。其中,介质阻挡等离子体中的电子温度为1~10 eV(1 eV相当于11605 K),可有效地将CH4、CO2、H2O等能源小分子活化成反应自由基、激发态物种(分子、离子、原子),显著降低反应能垒,促进低温条件下吸热反应的发生[19-20]。但是单纯应用冷等离子体面临产物选择性差的问题[21-22]。因此,如何在温和条件下将冷等离子体的高活性和催化剂的高选择性有效地耦合变得至关重要。
本研究中将MoxC与Ni/Al2O3催化剂机械混合制备了MoxC-Ni/Al2O3双功能催化剂,考察了MoxC助剂对催化剂结构、等离子体放电性质(放电功率、有效电容)、催化性能的影响。同时,在无额外热源加热条件下,通过对输入电压的调控可实现CH4解离速率和H2O活化速率的匹配,并对催化剂的稳定性及失活机制进行了探究。
1 实验部分
1.1 原料和试剂
氧化铝,40~60目,购于中国石油兰州化工研究院;硝酸镍、七钼酸铵(焙烧后得MoO3),均为分析纯,购于国药基团化学试剂有限公司;甲烷(纯度99.999%)、氢气(纯度99.999%)、二氧化碳(纯度99.999%)、O2/Ar混合气(O2体积分数1%),购于大连化物所气体站。
1.2 催化剂制备
Ni/γ-Al2O3制备:将一定量的硝酸镍溶于去离子水中,采用等体积浸渍法将所得溶液浸渍于γ-Al2O3粉末,40 ℃下静置24 h。将前驱体放在80 ℃烘箱中干燥12 h,然后在600 ℃焙烧2 h。所得的催化剂记作NiAl,其中Ni的理论质量分数为10%。
α-MoC制备:将一定量的MoO3颗粒装入内径为6 mm的石英管中,在NH3气氛下从40 ℃升至700 ℃(5 ℃/min),保温2 h。温度降至40 ℃后,将NH3切换成20%CH4/H2,再次从40 ℃升至700 ℃(5 ℃/min),保温2 h,待温度降至40 ℃后通1%O2/Ar钝化12 h。
β-Mo2C制备:将一定量的MoO3颗粒装入内径为6 mm的石英管中,在20%CH4/H2气氛下先从40 ℃升至300 ℃(5 ℃/min),再升至700 ℃(1 ℃/min),保温2 h。冷却至40 ℃后通1%O2/Ar钝化12 h。
MoC-NiAl催化剂制备:将一定量的Ni/γ-Al2O3与α-MoC在研钵中机械混合60 min,所得的催化剂记作MoC-NiAl,其中Ni与Mo摩尔比为2/1。
Mo2C-NiAl催化剂制备:将一定量的Ni/γ-Al2O3与β-Mo2C在研钵中机械混合60 min,所得的催化剂记作Mo2C-NiAl,其中Ni与Mo摩尔比为2/1。
1.3 催化剂表征
粉末X射线衍射(XRD)分析采用日本岛津公司XRD-6000仪器,射线源为CuKα(λ=0.15404 nm),管电压为240 kV,管电流为50 mA。
透射电子显微镜(TEM)分析在日本JEOL公司JEM-2100仪器上进行,工作电压为200 kV。
拉曼光谱(Raman)分析采用美国Thermo Fisher公司的DXR Microscope仪器,激发波长为532 nm。
N2吸附-脱附测试在Micromeritics公司的ASAP 2460仪器上完成,比表面积采用BET (Brunauer-Emmett-Teller)方法测定。
电感耦合等离子体-原子发射光谱(ICP-OES)测定在Optima 2000DV仪器上完成。
1.4 催化剂性能评价
催化剂性能评价在固定床反应装置上进行,装置示意图如图1所示。

图1 介质阻挡放电等离子体催化反应器示意图Fig.1 Schematic diagram of dielectric barrier diseharge plasma-catalytic reactor
将10 mg催化剂与300 mg石英砂混合均匀后置于刚玉管反应器中,500 ℃下H2还原1 h。冷却至室温,将电压调至70 V,放电30 min,稳定后开始采样。反应条件为:V(CH4)/V(H2O)/V(Ar)=1/1/3、质量空速(MHSV)为300000 mL/(g·h)、无额外热源加热。以CH4转化率(XCH4,%)、H2O转化率(XH2O,%)评价催化剂性能,计算式如式(1)和(2)所示。
(1)
(2)
式中:FCH4,in和FCH4,out分别为进气口和尾气口的CH4流量,mL/min;FH2,out为尾气口的H2流量,mL/min;FH2O,in和FH2O,out分别为进气口和尾气口的H2O流量,mL/min。
2 结果与讨论
2.1 Mo2C-Ni/γ-Al2O3和γ-Ni/Al2O3催化剂结构表征
图2为还原后NiAl和Mo2C-NiAl催化剂的XRD谱图。从图2可以看出,NiAl催化剂上观察到金属Ni(JCPDS No.04-0850)和γ-Al2O3相(JCPDS No.75-0921)的特征衍射峰,表明该催化剂上NiO被还原为金属Ni。而Mo2C-NiAl催化剂上除了观察到金属Ni和γ-Al2O3的衍射峰外,在2θ为36.4°和42.3°处观察到β-Mo2C相的特征衍射峰(JCPDS No.65-8766),说明该催化剂在制备过程中β-MoC相没有被破坏。

图2 还原后NiAl、Mo2C-NiAl催化剂的XRD谱图Fig.2 XRD patterns of the reduced NiAl and Mo2C-NiAl catalysts
表1为γ-Al2O3、NiAl和Mo2C-NiAl的物化性质。从表1可以看出:与γ-Al2O3载体相比,NiAl催剂的比表面积明显降低化,表明浸渍法加入的Ni物种堵塞一部分Al2O3载体上的孔结构;Mo2C-NiAl催化剂的比表面积略高于NiAl催化剂。

表1 γ-Al2O3、NiAl和Mo2C-NiAl的物化性质Table 1 Textural properties of γ-Al2O3,NiAl and Mo2C-NiAl
2.2 不同输入电压下碳化钼对Ni基催化剂活化H2O能力的提升作用
对于甲烷水汽重整反应,高温反应条件下积炭和活性金属烧结是传统催化剂失活的主要原因。从反应动力学角度进行分析,由于反应过程中CH4的解离速率高于H2O的活化速率,导致CH4解离生成的碳物种来不及被H2O解离的O物种消耗而沉积在催化剂表面,进而形成积炭导致催化剂失活[23]。因此,如何实现实际工况下CH4解离速率和H2O活化速率的匹配至关重要。
基于碳化钼基材料具有优异活化H2O分子特性的研究基础,在无额外热源加热条件下,进一步考察了引入碳化钼物种后不同输入电压对催化剂CH4和H2O解离速率的影响,如图3所示。从图3可以看出,对于Mo2C-NiAl催化剂,当输入电压为30 V时,CH4转化率高于H2O,这是由于CH4分子的C—H键能低于H2O分子的O—H键能,冷等离子体更有利于活化甲烷,表明冷等离子体起到主要作用。当输入电压升高至40 V,H2O的转化率高于CH4,并且随着输入电压的进一步提高,两者转化率同步增大且差距逐渐减小,尤其是输入电压为70 V时CH4和H2O的转化率分别为80%和82%,表明催化剂的催化作用逐渐增强,即高输入电压下冷等离子体与Mo2C-NiAl间的协同作用也逐渐增强。通过以上结果分析,70 V是最优的输入电压值,此时CH4解离速率和H2O活化速率相匹配,有助于抑制积炭的生成。

图3 不同输入电压条件下Mo2C-NiAl催化剂的CH4和H2O转化率Fig.3 Conversions of CH4 and CO2 over Mo2C-NiAl catalyst at different input voltagesReaction conditions:V(CH4)/V(H2O)/V(Ar)=1/1/3;MHSV=300000 mL/(g·h);Without any external heating
2.3 碳化钼助剂对催化剂放电性质的影响作用
等离子体-催化耦合模式下,不同填充材料上放电性质(如有效电容、放电功率)对催化活性有显著的影响。通过测不同填充材料时的李萨如图形确定其在放电区域内的放电功率、有效电容及放电形式[24],如图4所示。由图4可以看出:当填充石英砂时,测得的李萨如图形为平行四边形,表明放电形式以丝状放电为主;而填充NiAl和Mo2C-NiAl催化剂后,测得的李萨如图形为椭圆形,表明填充催化剂之后放电形式转变为以表面放电为主。放电形式的改变进一步说明等离子体与催化剂间具有显著的协同作用[24]。对有效电容和放电功率进一步分析结果表明,与填充石英砂相比,填充催化剂后放电功率和有效电容明显提高,这主要来自于不同填充材料上放电形式的改变[25]。与NiAl催化剂相比,Mo2C-NiAl催化剂上的放电功率和有效电容进一步提高,表现出最大的放电功率和有效放电电容(分别为48 W和178 pF),主要是由于碳化钼具有良好的导电性[26],有助于放电过程中电荷积累。

图4 等离子体催化耦合模式下填充石英砂、NiAl、Mo2C-NiAl的李萨如图及其放电功率和有效电容Fig.4 Lissajous figures of being filled with quartz sand,NiAl and Mo2C-NiAl under plasma catalytic coupling mode and discharge power and effective capacitance Lissajous figures:(a)Quartz sand;(b)NiAl;(c)Mo2C-NiAl;(d)Corresponding discharge power and effective capacitance Reactionconditions:V(CH4)/V(H2O)/V(Ar)=1/1/3;MHSV=300000 mL/(g·h);Input voltage 70 V;Without any external heating;The temperature generated by plasma discharge in catalyst bed is 630 ℃.
2.4 不同晶相碳化钼助剂对催化活性的影响
为比较不同晶相的碳化钼助剂(α-MoC、β-Mo2C)对催化活性的影响,在CH4/H2O/Ar体积比为1/1/3、MHSV为300000 mL/(g·h)、输入电压为70 V、无额外热源加热、催化剂床层温度约为630 ℃的条件下,考察了等离子体催化耦合模式下MoC-NiAl和Mo2C-NiAl催化剂的活性,如图4所示。Mo2C-NiAl的CH4转化率(81%)高于MoC-NiAl(76%),表明β-Mo2C的加入更有助于催化剂催化活性的提高。
2.5 等离子体催化耦合模式下催化剂稳定性能评价
图5为等离子体催化耦合模式下NiAl和Mo2C-NiAl催化剂的稳定性评价结果。从图5可以看出,在CH4/H2O/Ar体积比为1/1/3、MHSV为300000 mL/(g·h)、输入电压为70 V、等立体放电产生的温度约为630 ℃、无额外热源加热条件下,Mo2C-NiAl催化剂具有最高的初始CH4转化率。对于NiAl催化剂,在反应时间29 h内,CH4转化率由80%降至48%,催化剂出现明显失活。相较于NiAl催化剂,Mo2C-NiAl催化剂则展现出最优异的催化稳定性,经过反应时间29 h,CH4转化率始终保持在80%左右,催化剂性能基本不变,这主要得益于β-Mo2C较好的活化H2O能力及其和金属Ni间较强的相互作用,有利于金属的分散和稳定,抑制了反应过程中积炭的生成和Ni的团聚烧结。

图5 等离子体催化耦合模式下NiAl和Mo2C-NiAl催化剂的稳定性评价Fig.5 Stability performance of NiAl and Mo2C-NiAl catalysts under plasma catalytic coupling mode ReactionV(CH4)/V(H2O)/V(Ar)=1/1/3;MHSV=300000 mL/(g·h),Input voltage 70 V;Without any external heating;The temperature generated by plasma discharge in catalyst bed is 630 ℃.
结合上述结果,推测等离子体催化耦合模式下甲烷水汽重整的反应机理可能是:气相中等离子体放电产生的高能电子与反应物分子(CH4、H2O)发生非弹性碰撞,使其转化为激发态物种(如CH3*、CH2*、CH*、H*、OH*等)[27-28]。同时,生成的激发物种快速扩散吸附于Mo2C-NiAl和NiAl催化剂表面发生表面反应,有效地提高了放电区域内催化剂的催化性能[29]。
2.6 碳化钼物种对Ni基催化剂抗积炭性能的影响
为了探究不同催化剂在甲烷水汽重整反应中的失活原因,进一步对稳定性测试后的催化剂进行了XRD表征,结果如图6所示。由图6可以看出:对于反应后NiAl催化剂,除了Ni、Al2O3相的衍射峰外,在2θ为26.6°处出现1个明显的衍射峰,归因于石墨碳(JCPDS No.26-1080),表明反应过程中NiAl催化剂上有明显积炭生成;此外,金属Ni的衍射峰相较于反应前样品明显增强,说明发生一定程度的团聚现象,催化剂的积炭和金属Ni的团聚可能是其失活的主要原因。而对于反应后Mo2C-NiAl催化剂,除了观察到Ni、γ-Al2O3、β-Mo2C相的衍射峰外,没有出现石墨碳或MoO2的衍射峰,表明该催化剂在反应过程中被氧化且积炭被有效抑制,说明该催化剂上H2O活化速率和CH4解离速率相匹配;同时金属Ni的衍射峰强度最弱,表明β-Mo2C的引入能够有效地抑制金属的团聚烧结,因此Mo2C-NiAl催化剂表现出最好的反应稳定性。
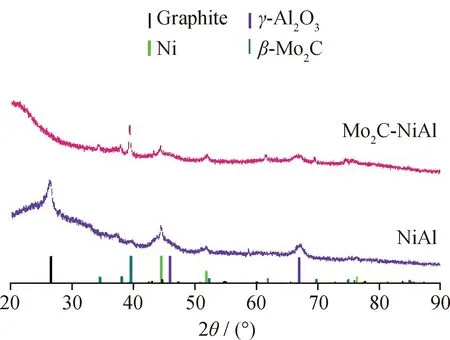
图6 反应后NiAl、Mo2C-NiAl催化剂的XRD图谱Fig.6 XRD patterns of spent NiAl and Mo2C-NiAl catalysts
为了进一步确定不同催化剂上的积炭程度,对其进行了Raman表征,如图7所示。D带(1341 cm-1)表示积炭的无定型程度,G带(1596 cm-1)表明积炭的石墨化。D带和G带的峰强度比值(ID/IG)则可以表示反应后催化剂上积炭的石墨化程度,即ID/IG越小,积炭石墨化程度越高[30-31]。由图7可以看出,Mo2C-NiAl的ID/IG大于NiAl,表明NiAl催化剂上积炭石墨化程度更高,不利于氧物种氧化消除,这与XRD结果相一致。

图7 反应后NiAl和Mo2C-NiAl催化剂的Raman图谱Fig.7 Raman spectra of spent NiAl and Mo2C-NiAl catalysts
为了比较反应前后不同催化剂上Ni粒径变化,对反应前后的催化剂进行TEM表征,如图8所示。

图8 反应前后不同催化剂的TEM照片和相应的粒径分布Fig.8 TEM images and corresponding particle size distribution of different catalysts before and after reduction(a),(b)Reduced NiAl;(c),(d)Reduced Mo2C-NiAl;(e),(f)Spent NiAl;(g),(h)Spent Mo2C-NiAl
从图8看出,γ-Al2O3载体具有一定的棒状结构。与反应前Mo2C-NiAl催化剂相比(图8(c)和(d)),反应前NiAl催化剂上的Ni颗粒(黑点)较为明显(图8(a)和(b)),表明催化剂在还原过程中Ni发生一定程度的团聚。还原后NiAl催化剂上的金属Ni平均粒径为7.3 nm,而加入Mo2C后Ni的平均粒径减小至4.0 nm,表明Mo2C的引入能够使金属Ni在还原过程中再分散,归因于Ni与Mo2C间具有强相互作用[29]。反应后NiAl催化剂上金属Ni发生明显团聚(图8(e)和(f)),Ni的平均粒径为10.5 nm;而反应后Mo2C-NiAl催化剂上未观察到明显的Ni颗粒(图8(g)和(h)),且Ni的平均粒径为5.5 nm,表明β-Mo2C的加入有效抑制了金属Ni烧结,有助于催化稳定性的提高。
3 结 论
(1)利用机械混合法制备了MoxC-Ni/γ-Al2O3复合型催化剂,系统考察了碳化钼助剂对催化剂结构的影响。研究表明,由于Ni与β-Mo2C间具有较强相互作用,Mo2C的加入促进了金属Ni的再分散,有效提升了催化剂的抗烧结能力。
(2)与NiAl催化剂相比,Mo2C的加入(Mo2C-NiAl催化剂)显著提高了放电过程中的放电功率和有效电容,这主要归因于Mo2C具有良好的导电性,有助于电荷累积和表面局域电场的提高。同时,当输入电压为70 V时,CH4解离速率和H2O活化速率相匹配,有效地抑制长周期反应过程中积炭的生成。
(3)无额外热源加热条件下,Mo2C-NiAl催化剂展现出最优的甲烷水汽重整反应稳定性,在反应时间29 h内CH4转化率始终保持在80%,归因于Ni粒径小和β-Mo2C具有较好的活化H2O能力。
(4)基于实验结果,提出了催化剂在等离子体催化甲烷水汽重整反应中可能的反应过程:反应物分子与等离子体放电产生的高能电子发生非弹性碰撞后生成活性激发态物种,然后扩散并吸附在催化剂上发生表面反应,有效地提高了等离子体与催化剂间的协同作用。
