长江刀鲚FABP1基因遗传多态性及其与生长性状的相关性分析
2023-09-19于爱清施永海徐嘉波严银龙邓平平
于爱清 施永海 徐嘉波 严银龙 邓平平
(上海市水产研究所,上海市水产技术推广站,上海 200433)
脂肪酸结合蛋白(fatty acid binding proteins,FABPs)隶属于蛋白分子量在14~16 kD的胞内脂质结合蛋白超家族成员,与脂肪酸和胆固醇等亲脂性物质结合而参与疏水性长链脂肪酸在细胞内、外的转导,并影响脂类代谢酶的活性、胞内信号的转导及基因的转录,也能够作为分泌型蛋白调控细胞的生长和增殖[1-2]。FABP1与其他FABPs家族成员一样,均具有类似的结构:一个螺旋-转角-螺旋域和由10个反平行β链组成的β桶,配体长链脂肪酸结合在β折叠内空洞中心,空洞中心的水分子能够置换脂肪酸,维持空洞内的静电网络和蛋白稳定性[1-2]。目前,哺乳动物FABPs按照首次分离或鉴定的时间和表达的组织特异性,主要分为FABP1(肝脏型)、FABP2(小肠型)、FABP3(心脏型)、FABP4(脂肪型)、FABP5(表皮型)、FABP6(回肠型)、FABP7(脑型)、FABP8(髓鞘型)和FABP9(睾丸型)等9种类型[3]。不同类型的FABPs基因序列之间具有高度同源性,分别高度表达于不同的组织,而伴随着研究的深入,该蛋白家族的生物学功能不断被挖掘和扩展到生长、发育、营养及免疫等诸多方面。
哺乳动物和禽类的FABP1基因往往与动物的肌内脂肪酸沉积[4]、肌内脂肪酸含量[5]和肉质紧密相关,被应用于生产性状的遗传改良和品种/系的选育研究。在鱼类中,FABPs基因家族的研究主要集中于基因克隆、组织表达和表达模式、基因多态性与肌内脂肪酸沉积及生长性状的相关性分析等方面[6-7]。Liu等[8]开展了斑马鱼(Daniorerio)FABP3基因的结构和功能研究,发现斑马鱼FABP3在各组织均有表达,在心脏中表达量最高,并且与斑马鱼的卵黄发育和肝脏脂肪酸代谢功能密切相关。廖玉英等[9]对暗纹东方鲀(Takifuguobscurus)FABP3基因进行了克隆和表达研究,探明暗纹东方鲀的FABP3基因主要参与脂肪酸分解过程,并探讨了在暗纹东方鲀饲料中用豆油替代鱼油的可行性。林亚秋等[10]开展了齐口裂腹鱼(Schizothoraxprenanti)和鲤(Cyprinuscarpio)FABP3基因的克隆、表达模式及其与肌内脂肪(intramuscular fat,IMF)含量的相关性研究,发现齐口裂腹鱼FABP3基因的表达量与IMF含量呈显著正相关,而鲤的FABP3基因则与IMF含量呈显著负相关。俞菊华等[2]开展了建鲤(C.carpiovarJian)FABP3基因多态性与增重性状的相关性研究,获得了1个与建鲤雌、雄鱼鱼种阶段和雌鱼成鱼阶段增重显著相关(P<0.05)的单核苷酸多态性(SNP)位点(C30G),发现CC基因型个体增重显著快于CG型个体,有望应用于建鲤的分子辅助良种研究。杨晓等[7]开展了红鳍东方鲀(T.rubripes)FABP7基因多态性与生长性状的关联性研究,获得了两个与红鳍东方鲀生长性状显著相关的位点(G676A和A731C),有望应用于后期红鳍东方鲀的分子育种研究。截至目前,长江刀鲚FABPs基因家族的相关研究鲜见报道。
刀鲚(Coiliaectenes)又名长颌鲚,俗称刀鱼、毛刀鱼,隶属于鲱形目(Clupeiformes)、鳀科(Engraulidae)、鲚属(Coilia),主要分布于我国黄渤海、东海海域及以长江为代表的通海江河[11-12]。长江下游刀鲚的产量最高,因其鱼体丰腴肥满、肉质细嫩鲜美而享有“长江三鲜”之首的美誉[13-15]。近年来,由于受到栖息地水域环境的污染、人类工程建设及酷渔滥捕等因素的影响,长江刀鲚自然种质资源急剧衰退[16]。但随着人工繁育和养殖技术的日趋成熟,以及长江流域十年禁捕政策的实施,自然种质资源衰退的现状得到了极大缓解。与此同时,养殖需求日益扩大,而良种却极为匮乏,亟需选育出一个具有优良性状的长江刀鲚新品系进行推广养殖。
本研究以上海市水产研究所的长江刀鲚核心选育群体F3为研究对象,基于长江刀鲚的转录组数据获得长江刀鲚FABP1基因(CeFABP1基因)的部分cDNA序列,利用基因克隆和直接测序技术获得CeFABP1基因的cDNA全长序列和基因组DNA序列,通过对该基因DNA上的多态性SNP位点进行筛选,开展基因多态性与生长性状的相关性研究,以期能够为长江刀鲚种质资源评估和分子标记辅助育种提供科学依据。
1 材料和方法
1.1 试验材料
试验所用长江刀鲚均取自于上海市水产研究所奉贤科研基地于2017年获得的长江刀鲚核心选育群体(F3)。
随机选取3尾2龄刀鲚置于冰上,放置1~2 min待其轻微麻醉后,进行活体解剖。将肝组织迅速解剖分离出来,用无菌DEPC水冲洗后,置于液氮中迅速冷却,然后置于-80 ℃超低温冰箱保存,用于长江刀鲚FABP1基因的cDNA全长克隆研究。
随机选取100尾同批次同池塘饲养的2龄长江刀鲚,用游标卡尺和电子天平测得其平均体长为(21.89±4.51) cm,平均体高为(3.40±0.74) cm,平均体质量为(39.83±22.73) g。剪取部分鱼的尾鳍置于盛有95%乙醇的1.5 mL离心管中,分别编号后,置于-20 ℃冰柜中保存,用于长江刀鲚FABP1基因的基因组DNA扩增、SNP位点筛选及其基因多态性与生长性状的关联分析。
随机选取大规格雌性刀鲚(99.18±12.81)g、小规格雌性刀鲚(16.10±0.26)g、大规格雄性刀鲚(59.75±3.19)g和小规格雄性刀鲚(18.90±0.44)g各3尾,置于冰上,放置1~2 min,至其轻微麻醉后进行活体解剖。将肝脏剖离出来,用无菌DEPC水冲洗后,置于液氮中迅速冷却,然后置于-80 ℃超低温冰箱保存,用于开展长江刀鲚FABP1基因在大/小规格长江刀鲚的相对表达量研究。
1.2 总RNA和基因组DNA的提取
长江刀鲚肝脏组织总RNA的提取均参照Trizol Reagent Kit(RNA Extraction Kit,Invitrogen)试剂盒说明书进行。总RNA溶解于DEPC水后,利用NanoVue Plus紫外可见分光光度计测定其浓度和纯度,并利用1.5%琼脂糖凝胶电泳检测质量,EB(溴化乙锭)染色凝胶成像系统拍照记录。将质量较好的RNA(28S和18S条带清晰,且28S与18S的灰度比约为2∶1、无拖尾现象出现、点样孔附近无残留,表明RNA无降解,质量可靠)置于-80 ℃超低温冰箱保存,备用。
长江刀鲚鳍条组织基因组DNA的提取参照天根生化科技(北京)有限公司的海洋动物组织基因组DNA提取试剂盒(DP324-03)说明书进行。DNA样本提取完成后,利用琼脂糖凝胶电泳和NanoVue Plus紫外可见分光光度计检测样本DNA的质量和浓度;经1.5 %琼脂糖凝胶电泳检测,显示无拖尾降解现象、条带清晰,且OD260 nm/OD280 nm的值在1.8~2.0的DNA样品,稀释至50 ng/μL后,保存于-20 ℃冰柜中,备用。
1.3 长江刀鲚FABP1基因cDNA全长克隆
(1)cDNA第一链的合成:长江刀鲚肝脏所提取的总RNA经测定质量和浓度后,按照PrimeScriptTMReal-time PCR Kit试剂盒(Takara公司,北京)的说明书进行反转录反应,获得用于长江刀鲚cDNA序列拼接所需的cDNA模板,利用NanoVue Plus紫外可见分光光度计检测反转录好的cDNA模板浓度,用RNase free水将终浓度统一调整为200 ng/μL后,置于-20 ℃冰箱保存备用。
(2)5’-RACE和3’-RACE cDNA模板的合成:参照SMARTerTMRACE cDNA Amplification Kit(Takara公司,北京)说明书的方法,获得长江刀鲚肝脏组织的3’-末端和5’-末端的cDNA模板,然后利用NanoVue Plus紫外可见分光光度计检测反转录好的cDNA模板浓度,最后用Tricine-EDTA 缓冲液将该模板的浓度稀释至500 ng/μL,置于-20 ℃冰箱保存备用。
(3)长江刀鲚FABP1基因cDNA全长的克隆。基于本课题组刀鲚转录组数据,获得CeFABP1的部分cDNA序列,并利用Primer Premier 5.0软件分别设计基因特异性引物(CeFABP1-QC)(见表1),对CeFABP1的部分cDNA序列拼接质量进行验证。基于测序验证后的序列,设计特异性RACE引物(5’GSP-1~2和3’GSP-1~2),以反转录合成的长江刀鲚肝脏5’-cDNA或3’-cDNA为模板,利用SAMRT-RACE技术获得CeFABP1的cDNA序列全长。反应体系为25 μL,包括12.5 μL 2×TaqPCR Mix,2 μL 5’ RACE-Ready或3’ RACE-Ready cDNA,2.5 μL UPM(通用引物),0.5 μL 5’或3’基因特异性引物(5’GSP-1~2和3’GSP-1~2),用ddH2O补充总体积至25 μL。PCR反应条件为:94 ℃预变性5 min,94 ℃变性30 s,72 ℃延伸3 min,5个循环;94 ℃变性30 s,70 ℃延伸30 s,72 ℃再延伸3 min,5个循环;94 ℃变性30 s,在引物最适的退火温度退火30 s,72 ℃延伸3 min,30个循环后,72 ℃再延伸10 min,4 ℃+∞。PCR产物经1.5%琼脂糖凝胶电泳检测后,将目的条带割胶纯化,并进行T-A克隆测序,测序菌液经菌落PCR和琼脂糖凝胶电泳检测验证后,交由生工生物工程(上海)股份有限公司测序(测序所用引物为23-Mer和24-Mer)。

表1 用于长江刀鲚FABP1基因扩增所用引物序列
(4)以大规格/小规格雌、雄长江刀鲚肝脏组织cDNA模板,利用实时荧光定量PCR(qRT-PCR)技术检测长江刀鲚FABP1基因的表达差异情况。基于长江刀鲚FABP1基因的cDNA序列设计qRT-PCR引物(见表1),利用天根生化科技(北京)有限公司生产的Talent荧光定量检测试剂盒(SYBR Green)在StepOne Plus实时荧光定量PCR仪(ABI,美国)上进行qRT-PCR反应。反应体系和反应条件参照该试剂盒说明书进行,每个样品做3次技术重复,以长江刀鲚β-actin为内参基因,利用2-ΔΔCt法计算长江刀鲚FABP1基因mRNA的相对表达量。
1.4 CeFABP1的生物信息学分析
利用VecScreen在线软件筛除CeFABP1基因克隆测序序列中的载体序列,并经SMART-RACE技术克隆并拼接CeFABP1基因的cDNA全长。利用NCBI ORF-Finder、SMART、Predict-protein、SWISS-MODEL和ExPasy-ProtParam等在线软件预测该基因的开放式阅读框,预测信号肽和结构域,分析该基因蛋白组成、结构和理化性质;用MEGA 6.0软件构建系统发育树。
1.5 CeFABP1基因组DNA扩增和多态SNP位点筛选
基于CeFABP1基因的cDNA序列,利用Primer Premier 5.0软件设计基因特异性PCR扩增引物(见表1)。其中,CeFABP1-FL是参照大西洋鲱FABP1基因内含子和外显子的相对位置设计而成,用于扩增CeFABP1基因的第1内含子、第2内含子和第3内含子序列;CeFABP1-SC则以CeFABP1基因组DNA序列为基础设计而成,然后以具有极端生长表型的不同刀鲚,即体质量最大的10尾鱼[(89.53±14.51) g]和体质量最小的10尾鱼[(18.75±1.62) g]的DNA样本为模板,利用直接测序法筛选CeFABP1基因组DNA上的多态性位点。
1.6 CeFABP1基因多态性与生长性状的相关性
基于初步的多态性SNP位点筛选结果,鉴于长江刀鲚FABP1基因组DNA上的SNP位点间隔均较小,不易用其他方法进行分型,因此采用直接测序法(引物CeFABP1-SC)对100尾长江刀鲚进行基因分型。基于基因分型结果,利用GenAIEx 6.5软件[17]计算长江刀鲚养殖群体的有效等位基因数(effective number of alleles,Ne)、观测杂合度(observed heterozygosity,Ho)和期望杂合度(expected heterozygosity,Ne)等遗传参数,并对14个SNP位点进行哈迪-温伯格平衡(Hardy-Weinberg equilibrium,HWE)检验;利用PIC-CALC软件计算实验群体中每个SNP位点的多态信息含量(polymorphic information content,PIC);利用SPSS 20.0软件中的一般线性模型(general linear model,GLM)分析不同SNP位点的不同基因型及其与刀鲚生长性状(体质量、体高和体长)的关联程度。

2 结果
2.1 CeFABP1基因序列特征和生物信息学分析
CeFABP1 cDNA全长525 bp,开放式阅读框由384个核苷酸所编码的127个氨基酸组成,以ATG作为起始密码子,TGA作为终止密码子;5’-非编码区和3’-非编码区长度分别为99 bp和42 bp,在3’-非编码区域具有明显的多聚腺苷酸加尾信号(AATAAA)(见图1)。长江刀鲚FABP1基因组DNA由1 285个核苷酸组成(见图2),包括4个外显子和3个内含子。
CeFABP1蛋白的原子组成为C617H1011N161O195S5,蛋白分子量为13.965 kD,理论等电点为6.12。CeFABP1蛋白的氨基酸组成见表2。结果显示,氨基酸残基中负电荷残基总数(Asp+Glu)为16个,正电荷残基总数(Arg+Lys)为15个,其中色氨酸(Trp)缺失,数量为0;赖氨酸(Lys)数量最多(13个),占氨基酸总数的10.24%。基于蛋白质稳定性划分标准,若不稳定系数≤40即为稳定性蛋白。CeFABP1氨基酸不稳定指数为32.10,表明该蛋白为稳定蛋白。


表2 长江刀鲚FABP1基因编码蛋白的氨基酸组成
CeFABP1蛋白二级结构预测为混合型,由19个氨基酸(占氨基酸总数的14.96%)构成α-螺旋(alpha-helices),58个氨基酸(占氨基酸总数的45.67%)构成无规则卷曲(random coil),50个氨基酸(占氨基酸总数的39.37%)构成伸展链(extend stand)(见图3)。利用SWISS-MODEL软件对CeFABP1蛋白三级结构进行预测,结果显示,CeFABP1蛋白三维结构主要由10个β折叠和2个α-螺旋组成(见图4)。

注:蓝色代表α-螺旋,红色e代表伸展链,橘黄色c代表无规则卷曲。

图4 长江刀鲚FABP1蛋白的三级结构预测
基于CeFABP1氨基酸序列构建进化树,结果显示,CeFABP1首先与大西洋鲱聚为一支,再与美洲西鲱聚为一支,最后与其他鱼类聚为一支。这一结果与传统的分类关系相一致(见图5)。
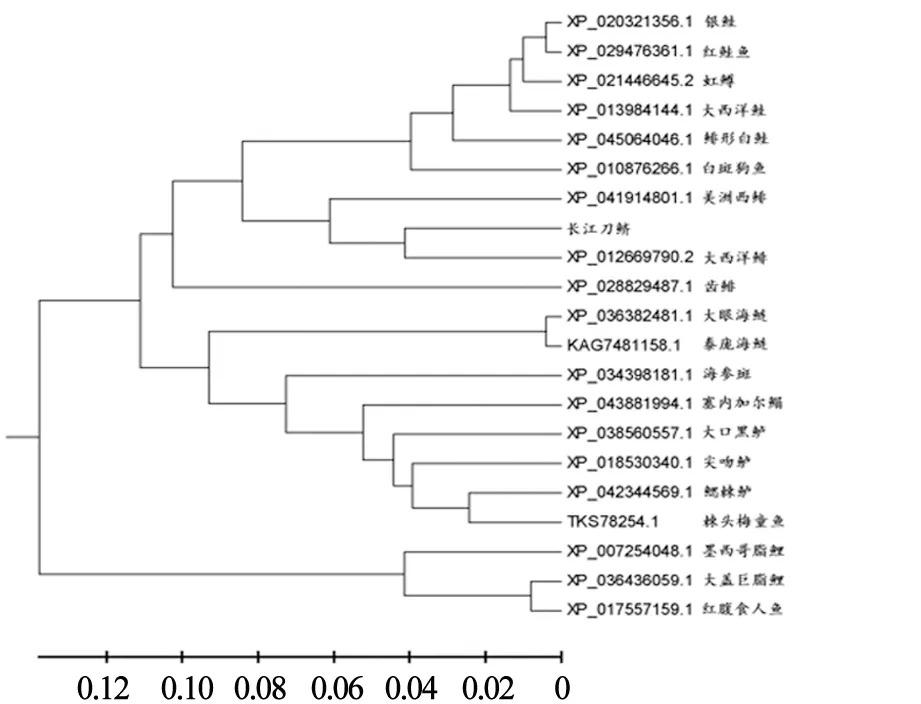
图5 长江刀鲚FABP1基因编码区序列系统发育树
2.2 长江刀鲚FABP1基因在肝脏组织的表达量分析
鉴于长江刀鲚雌、雄个体的表型差异相对较大,本研究大/小规格的雌、雄长江刀鲚为实验材料,以小规格长江刀鲚为对照组,大规格长江刀鲚为试验组,基于肝脏组织,开展长江刀鲚FABP1基因的相对表达量研究。结果显示,在雌性长江刀鲚中,大规格长江刀鲚的FABP1基因mRNA的表达量是小规格长江刀鲚的0.55倍;在雄性长江刀鲚中,大规格长江刀鲚的FABP1基因mRNA的表达量是小规格长江刀鲚的0.80倍(见图6),表明长江刀鲚FABP1基因对于长江刀鲚雌、雄群体的生长表型均具有负向调控作用。

图6 长江刀鲚FABP1基因在大/小规格雌、雄个体肝脏的表达量变化
2.3 长江刀鲚FABP1基因多态性与生长性状的相关性及遗传分析
基因多态性检测结果显示,CeFABP1基因组DNA上总共检测到14个SNP位点(见图2中有下划线且加粗的字体),其中在第1内含子上检测到1个SNP突变位点(g.250A>G);在第2内含子上检测到11个SNP位点(g.544A>T、g.564C>T、g.577A>T>C、g.595A>C、g.637G>T、g.654A>G、g.659G>T、g.670C>G、g.840A>G、g.908C>T和g.108 6A>G);在第3外显子和内含子上分别检测到1个SNP位点(g.110 4A>G和g.111 8C>G)。
CeFABP1基因上14个突变位点共组成43种基因型,分别将基因型与刀鲚的生长性状(体质量、体长和体高)关联分析,结果见表3。从表3中可以看出,14个位点不同基因型个体间的体质量、体高和体长性状均没有显著差异(P>0.05)。14个突变位点的基因型频率和基因频率(见表4)的分析结果显示,不同SNP位点具有不同的基因型频率和等位基因频率,其中还有1个具有较高多态性的三等位基因突变位点(g.577A>T>C)。

表3 长江刀鲚FABP1基因的14个突变位点及其与生长性状的相关性分析

表4 14个突变位点在刀鲚养殖群体中的基因型和等位基因频率
CeFABP1基因上的14个突变位点在刀鲚养殖群体中的遗传多样性参数见表5。有效等位基因数(Ne)为1.523~2.767,观测杂合度(Ho)和期望杂合度(He)分别为0.410~0.760和0.343~0.639,多态信息含量(PIC)为0.284~0.565,其中13个SNP位点均属于中度多态(0.25

表5 长江刀鲚FABP1基因上14个突变位点的遗传参数分析
3 讨论
脂肪酸结合蛋白通过结合细胞内游离的脂肪酸和其他疏水性配体,将其输送到过氧化物酶体、线粒体和细胞核等细胞器,调控动物机体内脂肪酸的氧化和甘油三酯及磷脂合成等脂质代谢过程[6],在能量贮存、信号转导、生物膜的合成、过氧化物酶体的氧化、酶活力的调节、机体免疫反应及细胞的增殖和分化等生理生化过程中发挥重要的生物学功能[6]。研究表明,淡水硬骨鱼类具有丰富的Δ12及Δ15等脂肪酸去饱和酶,能够将亚油酸和亚麻酸转化为二十碳五烯酸(EPA)和二十二碳六烯酸(DHA)等多不饱和脂肪酸,并储存在肌肉等组织中[6,18],使鱼类成为人类多不饱和酸脂肪酸摄入的重要食物来源[6]。因此,对鱼类脂肪酸代谢相关基因的研究尤为重要。人类的FABP1基因主要表达在肝脏,且与脂肪肝、肝硬化及肝癌的发生密切相关,因而被作为肝损伤早期的高敏感检测指标[19]。禽畜类的FABP1基因与生产性能密切相关,往往被作为生产性能遗传改良的重要候选基因[4-5,19-20]。目前对鱼类FABP1基因的研究较少,仅对FABPs基因家族部分成员开展了基因克隆、基因表达和表达模式及其基因多态性与肌内脂肪沉积和生长性状相关性研究[7,10,21-23],对长江刀鲚相关方面的研究更是鲜见。因此,对长江刀鲚脂肪酸结合蛋白及其基因开展进一步的研究,对于阐明长江刀鲚脂肪酸结合蛋白的生物学功能及其在良种选育中的应用具有重要意义。
本研究首次对长江刀鲚FABP1基因开展了SNP位点的筛选及其基因遗传多态性与生长性状的相关性研究,结果显示,在长江刀鲚的FABP1基因上成功鉴定到14个SNP突变位点,其中13个位点发生在内含子上,表明该基因较为保守;而仅在第3外显子检测到1个突变位点(g.1 104A>G)。该位点的突变属于非同义突变,已经造成了氨基酸序列的改变,将原来的苏氨酸(Thr)替换为丙氨酸(Ala),这对于该基因的mRNA稳定性、翻译效率及蛋白质结构可能会产生一定程度的影响,但是对于生长表型暂未产生显著的影响(3种基因型个体的生长性状没有显著差异)。与之相同的是,人类FABP1基因第3外显子的1个突变位点(T94A,rs2241883)亦由原来的苏氨酸(Thr)被替换为丙氨酸(Ala),后续的研究发现,这个突变位点与人类临床血脂异常、动脉硬化性脑梗死和非酒精性脂肪肝均显著相关[24-25]。正常情况下,苏氨酸(Thr)在哺乳动物中高度保守,不易发生突变,但在长江刀鲚中,该位点的突变对于长江刀鲚的其他生理功能是否有影响有待进一步研究。
在动物的人工养殖繁育过程中,人工选择的压力会导致SNP在动物单个基因或者整个基因组的分布出现差异,特别是位于编码区的SNP变异往往能够引起氨基酸结构的改变,进而改变所编码蛋白质的结构或活性,而内含子SNP发生突变的概率经常是外显子的4.3倍[26],部分基因的内含子序列含有增强元件或其他顺式作用元件,能够调控基因的转录或者剪切,增加mRNA在细胞核内的稳定性,从而影响基因的表达效应,因此,发生于内含子的SNP亦不容忽视;而使用频率不同的密码子亦能够导致mRNA翻译效率和速度的差异,引起动物细胞内蛋白质水平的差异,最终导致动物的生长性能差异。近期有研究表明,发生在内含子内的突变能够导致水产动物的生产性状发生显著差异[7],如斑点叉尾鱼回(Ictaluruspunctatus)MSTN基因第2内含子上的1个突变位点与其体质量、体长性状显著相关(P<0.05)[27];长江刀鲚(C.ectenes)MSTN基因第1内含子上的1个突变位点与其体长、体高和体质量性状显著相关(P<0.05)[28];在红鳍东方鲀FABP7基因第3内含子上检测到1个与其体质量、体长、体全长、尾柄长和体高等多数性状均显著相关的SNP位点[7]。本研究中,在长江刀鲚FABP1基因内含子上检测到的13个突变位点,与长江刀鲚的体长、体高和体质量均没有显著的相关性,是否与长江刀鲚的脂肪酸含量有关有待后续进一步的深入研究。此外,在本研究中,突变位点g.1 104A>G仅检测到AA和AG基因型,并未检测到GG基因型个体。一方面可能由于样本量较少,有待今后扩大样本量进行检测验证;另一方面,该位点纯合GG基因型可能是致死基因型,会导致该基因型个体缺失。正常情况下,SNP突变以二等位基因为主,三等位和四等位基因非常少,几乎可以忽略不计,而在本研究中,位点g.577A>T>C则是发生概率极小的三等位基因SNP(tri-allelic SNP),频率最低的C等位基因频率为22.5%,该位点的基因遗传多态性显著高于其他突变位点。
观测杂合度(Ho)、期望杂合度(He)和多态信息含量(PIC)是群体遗传变异程度的重要参考指标,对于长江刀鲚养殖群体的种质资源评估具有重要作用。在本研究中,14个SNP位点对于长江刀鲚养殖群体的遗传多样性评估的结果显示,观测杂合度(Ho)、期望杂合度(He)和多态信息含量(PIC)分别为0.410~0.760、0.343~0.639和0.284~0.565,表明长江刀鲚养殖群体仍然具有丰富的遗传变异和较好的种质开发潜力。基于Botstein等[29]提出的多态信息含量(PIC)的判断标准,当PIC<0.25、0.25
本研究利用基因克隆和PCR扩增技术获得了长江刀鲚FABP1基因的cDNA全长序列和DNA序列,并利用直接测序法对长江刀鲚FABP1基因开展了多态性SNP位点的筛选、分型及其与生长性状相关性的研究,成功鉴定到了14个多态性SNP位点,这些位点虽然与生长性状的相关性不显著,但是却能够有效应用于长江刀鲚养殖群体的种质资源评估。
