雪松醇调节miR-503-5p/TCF3 轴对乳腺癌细胞增殖、迁移和侵袭的影响*
2023-09-19冯燕枝牛冰叶贝贝
冯燕枝,牛冰,叶贝贝
(郑州人民医院乳腺外科,郑州 450099)
乳腺癌(BC)是最常见的恶性肿瘤之一,也是全球女性癌症死亡的主要原因[1]。尽管通过手术、化疗和放疗、内分泌治疗等对BC 进行系统治疗有一定的效果,但因存在着不良反应、高成本和耐药性等局限性,因此仍需要开发更有效、毒性更低的新型药物,优化现有的治疗方法,以改善BC 的预后,提高BC 患者的生活质量[2-4]。雪松醇是一种天然倍半萜烯醇,已被证明具有广泛的生物活性,如抗菌、抗炎、镇痛、抗焦虑和抗癌作用[5]。研究发现,雪松醇可抑制胶质母细胞瘤[6]、肺癌[7]、结直肠癌[8]的发生发展。微小RNA(miRNA)表达失调与BC 增殖、迁移和侵袭密切相关,多项报道显示,多种miRNA 已成为BC 药物干预的新靶点[9-10]。miR-503-5p 作为重要的miRNA 之一,在胃癌、结肠癌中下调表达,促进其表达可抑制肿瘤细胞增殖、迁移、侵袭和上皮间质转化[11-12]。miR-503-5p 在BC 中的作用尚不清楚。T 细胞因子3(TCF3/TCF7L1)在BC 中高表达,并能促进三阴性BC 细胞的增殖、迁移和侵袭[13]。经生物信息学分析显示,miR-503-5p 与TCF3 之间存在结合位点,推测miR-503-5p 可能通过调节TCF3影响BC 的增殖、迁移和侵袭。但雪松醇通过调节miR-503-5p/TCF3 轴对BC 细胞增殖、迁移和侵袭的影响还不甚清楚,因此本实验旨在探讨雪松醇对BC 细胞增殖、迁移和侵袭的影响及其作用机制,以期为临床治疗BC 提供一定的参考价值。
1 材料与方法
1.1 材料
1.1.1 标本收集、细胞来源和实验动物 2021 年3 月—2022 年12 月期间收集在本院首次确诊为BC 患者的癌组织以及距离癌组织3 cm 处的癌旁组织,共36 对。所有患者均未接受化疗或放疗等形式的治疗,且签署了知情同意书,本研究获得本院伦理委员会的批准(批件号20210018)。人正常乳腺上皮细胞系MCF-10A 及人BC 细胞MCF7、MDAMB-231、SKBR3 购于美国ATCC。4 周龄SPF 级BALB/c 裸鼠购自郑州大学(河南省实验动物中心),许可证号:SCXK(豫)2022-0001,体质量15~20 g。
1.1.2 主要试剂与仪器 雪松醇(货号J14535),上海金穗生物科技有限公司;噻唑蓝比色法(MTT)试剂盒(货号:MH1001),江苏麦格生物科技有限公司;细胞转染试剂盒(货号:SY0944),北京伊塔生物科技有限公司;DMEM 培养基(货号:M0108B),上海盈湾生物科技有限公司;细胞蛋白提取试剂盒(货号:SH-2473),北京凯诗源生物科技有限公司;RNA 提取试剂盒(货号:R1200-100)、反转录试剂盒(货号:RP1105)、胸腺嘧啶核苷类似物(Edu)apollo 488 in vitro 试剂盒(货号:CA1172),北京索莱宝科技有限公司;实时荧光定量PCR 试剂盒(货号:IBIO-C583),江西艾博因生物科技有限公司;双荧光素酶报告基因检测试剂盒(货号:RG029S),上海碧云天生物技术有限公司;兔源一抗增殖细胞核抗原(PCNA,货号:ab15498-PCNA)、基质金属蛋白酶-2 (MMP-2,货号:ab37150)、TCF3 (货号:ab229605)、3-磷酸甘油醛脱氢酶(GAPDH,货号:ab9485)一抗抗体,美国Abcam 公司;辣根酶标记羊抗兔二抗(货号:XY0650),上海信裕生物科技有限公司;miR-503-5p 引物购自广州RiboBio;miR-503-5p 抑制剂(miR-503-5p inhibitor) 及对照(inhibitor-NC)、miR-503-5p 模拟物(miR-503-5p mimic)及其对照(mimic-NC)购自上海吉玛生物公司;多功能酶标仪(型号:LD-96A),山东莱恩德智能科技有限公司;离心机(型号:5424),艾本德中国有限公司;实时荧光定量PCR 仪(型号:CFX96 Touch),上海艾研生物科技有限公司;光学显微镜(型号:CX31),日本奥林巴斯公司。
1.2 实验方法
1.2.1 细胞培养 将人正常乳腺上皮细胞MCF-10A 及人BC 细胞MCF7、MDA-MB-231、SKBR3 置入DMEM 的培养基中,在恒温培养箱中常规培养。定期观察,及时更换新的培养基。用0.25%胰蛋白酶消化传代,收集对数生长期的细胞进行实验。
1.2.2 实时荧光定量聚合酶链式反应(qRT-PCR)法检测miR-503-5p 表达 组织和细胞的总RNA用TRIzol 试剂提取。以RNA 为模板合成cDNA 后,再以cDNA 为模板配置qRT-PCR 反应体系。miR-503-5p 上游引物:5′-CCTATTTCCCATGATTCCTTC ATA-3′和下游引物:5′-GTAATACGGTTATCCACGC G-3′;U6 上游引物:5′-CTCGCTTCGGCAGCACA-3′和下游引物:5′-AACGCTTCACGAATTTGCGT-3′;以2-ΔΔCT法计算组织和细胞中miR-503-5p 的相对表达量。
1.2.3 MTT 实验检测细胞增殖 将对数生长期细胞以1×104/孔,接种到96 孔板中常规培养,设6 个复孔,培养24 h 后吸去原培养液,加入含0、14、28、56、112、225 μmol/L 雪松醇[5]的培养液48 h 后加入MTT 溶液20 μL/孔,再培养4 h 后,加入二甲基亚砜150 μL/孔,充分震荡后,在酶标仪上于490 nm 波长处检测各孔的吸光度(A490)值,细胞增殖抑制率(%)=[(A对照-A实验)/(A对照-A空白)]×100%。
1.2.4 细胞转染及干预 将细胞分为control 组(正常培养)、雪松醇组(112 μmol/L 干预)、inhibitor-NC(转染inhibitor-NC)、miR-503-5p inhibitor 组(转染miR-503-5p inhibitor),对各组转染组细胞进行转染24 h,除control 组外,再用雪松醇进行干预48 h,随后按照1.2.2 中qRT-PCR 法方法检测各组miR-503-5p 的表达。
1.2.5 细胞增殖实验 各组MCF7 细胞在96 孔板上接种,浓度为1×104/孔,设6 个复孔。随后进行常规培养24、48、72 h 后每孔加入20 μL MTT 溶液。继续培养4 h 每孔再加入150 μL 的二甲基亚砜,在酶标仪上于490 nm 波长处检测各孔的OD 值。另取MCF7 细胞接种至96 孔板中,培养24 h 后,每孔加入50 μM Edu 孵育2 h,弃去培养液,加入50 μL 的4%多聚甲醛固定30 min,洗去固定液,每个孔加入100 μL 的1×Apollo 染色反应液,避光孵育30 min后,细胞核用DAPI 溶液复染,荧光显微镜下观察,计算Edu 阳性细胞比例。
1.2.6 Transwell 小室检测细胞迁移与侵袭 将各组MCF7 细胞使用无血清培养基稀释,接种至不含有Matrigel 基质胶(迁移实验)或含有Matrigel 基质胶(侵袭实验)的Transwell 上室,下室加入完全培养基,24 h 后,用4%多聚甲醛固定30 min,并用0.5%结晶紫染色20 min,显微镜下随机选择6 个视野细胞计算迁移与侵袭细胞数。
1.2.7 蛋白免疫印迹法(Western blot)检测PCNA、MMP-2、TCF3 蛋白表达 采用试剂盒提取组织和细胞总蛋白,对蛋白进行定量、电泳分离。转PVDF膜后室温封闭2 h,最后再分别加入PCNA(1∶1 000)、MMP-2(1∶2 000)、TCF3(1∶2 000)、GAPDH(1∶1 000)一抗在4℃条件下孵育过夜,加入二抗(1∶2 000)在37 ℃条件下孵育90 min。Image J 软件分析蛋白条带的灰度值,计算蛋白的相对表达水平。
1.2.8 双荧光素酶报告基因实验 构建TCF3 野生型质粒和突变型质粒(TCF3-WT,TCF3-MUT),将TCF3-WT 和TCF3-MUT 分别与mimic-NC 或miR-503-5p mimic 共转染于MCF7 细胞,48 h 后用荧光酶标仪检测荧光素酶活性,并计算萤火虫荧光素酶和海肾荧光素酶活性比值。
1.2.9 体内肿瘤形成实验 4 周龄BALB/c 裸鼠适应性饲养1 周后,皮下注射200 μL(5×106)MCF7 细胞悬液,每天观察肿瘤生长情况,待肿瘤体积达到50 mm3后,将裸鼠分成两组(10 只/组):对照组、雪松醇组,雪松醇组皮下注射150 mg/kg 雪松醇,2 d/1 次,共给药10 次。给药结束后测量小鼠质量,颈椎脱臼处死小鼠并分离肿瘤,测量肿瘤质量与体积,qRT-PCR 检测移植瘤组织中miR-503-5p 表达,免疫组化法检测TCF3、MMP-2 蛋白表达。
1.3 统计学方法 Graphpad Prism 7.0 软件用于分析数据。数据采用均数±标准差(±s)表示。两组间比较采用独立样本t 检验。多组间比较采用单因素方差分析,组间两两比较采用SNK-q 检验。P<0.05表示差异具有统计学意义。
2 结果
2.1 miR-503-5p 与TCF3 在组织和细胞中的表达 与癌旁组织比较,BC 组织中miR-503-5p 表达水平降低(1.00±0.02 vs. 0.25±0.02),TCF3 蛋白表达水平(0.31±0.04 vs. 1.57±0.11)升高(P<0.05),见图1。与MCF-10A 细胞比较,MCF7、MDA-MB-231、SKBR3 细胞中miR-503-5p 表达水平降低,TCF3 蛋白表达水平升高,且MCF7 细胞中miR-503-5p 表达水平最低,TCF3 蛋白表达水平最高,因此,选择MCF7 细胞进行转染实验,见图2 和表1。

图1 Western blot 检测组织中TCF3 蛋白表达Fig.1 Western blot detection of TCF3 protein expression in tissues

图2 Western blot 检测细胞中TCF3 蛋白表达Fig.2 Western blot analysis of TCF3 protein expression in cells
表1 miR-503-5p 与TCF3 在细胞中的表达(±s)Tab.1 Expression of miR-503-5p and TCF3 in cells(±s)
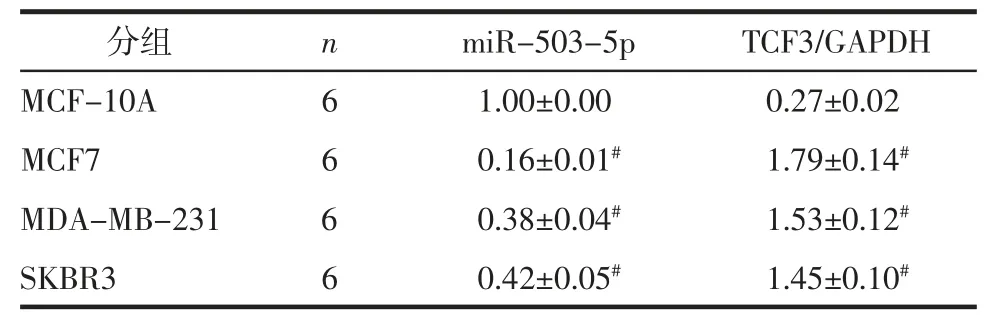
表1 miR-503-5p 与TCF3 在细胞中的表达(±s)Tab.1 Expression of miR-503-5p and TCF3 in cells(±s)
注:与MCF-10A 细胞比较,#P<0.05。
分组nmiR-503-5pTCF3/GAPDH MCF-10A61.00±0.000.27±0.02 MCF760.16±0.01#1.79±0.14#MDA-MB-23160.38±0.04#1.53±0.12#SKBR360.42±0.05#1.45±0.10#
2.2 雪松醇对MCF7 细胞的增殖抑制情况 与0 μmol/L 比较,MCF7 细胞增殖抑制率在14、28、56、112、225 μmol/L 雪松醇处理下以剂量依赖性的方式(6.14±1.15)%、(12.78±2.10)%、(25.58±2.47)%、(43.64±3.12)%、(56.84±3.28)%显著增加(P<0.05),本研究选取112 μmol/L 雪松醇进行后续实验。
2.3 雪松醇对MCF7 细胞中miR-503-5p 表达的影响 与control 组(1.00±0.01)比较,雪松醇组MCF7 细胞中miR-503-5p 表达水平(1.87±0.15)显著升高(P<0.05);与雪松醇组、inhibitor-NC(1.85±0.12)比较,miR-503-5p inhibitor 组MCF7 细胞中miR-503-5p 表达水平(0.15±0.01)显著降低(n=6,P<0.05)。
2.4 雪松醇对各组MCF7 细胞增殖的影响 与control 组比较,雪松醇组MCF7 细胞在24、48、72 h的OD490值和Edu 阳性细胞率显著降低(P<0.05);与雪松醇组、inhibitor-NC 比较,miR-503-5p inhibitor组MCF7 细胞在24、48、72 h 的OD490值和Edu 阳性细胞率显著升高(P<0.05),见图3 和表2。

图3 Edu 染色观察各组细胞增殖(比例尺=50 μm)Fig.3 Observation of cell proliferation by Edu staining in each group(bar=50 μm)
表2 各组MCF7 细胞OD490 值及Edu 阳性率比较(±s)Tab.2 Comparison of OD490 value and Edu positive rate of MCF7 cells in each group(±s)
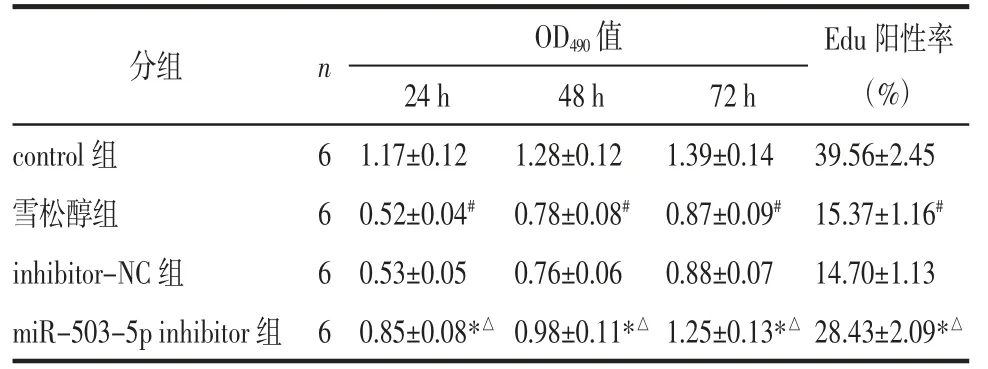
表2 各组MCF7 细胞OD490 值及Edu 阳性率比较(±s)Tab.2 Comparison of OD490 value and Edu positive rate of MCF7 cells in each group(±s)
注:与control 组比较,#P<0.05;与雪松醇组比较,*P<0.05;与inhibitor-NC 比较,△P<0.05。
OD490 值Edu 阳性率(%)24 h48 h72 h control 组6 1.17±0.121.28±0.12 1.39±0.14 39.56±2.45雪松醇组6 0.52±0.04# 0.78±0.08# 0.87±0.09# 15.37±1.16#inhibitor-NC 组6 0.53±0.050.76±0.06 0.88±0.07 14.70±1.13 miR-503-5p inhibitor 组 6 0.85±0.08*△ 0.98±0.11*△1.25±0.13*△28.43±2.09*△分组n
2.5 雪松醇对各组MCF7 细胞迁移与侵袭的影响 与control 组比较,雪松醇组MCF7 细胞迁移与侵袭数显著降低(P<0.05);与雪松醇组、inhibitor-NC比较,miR-503-5p inhibitor 组MCF7 细胞迁移与侵袭数显著升高(P<0.05),见图4 和表3。

图4 Transwell 检测各组MCF7 细胞迁移与侵袭(比例尺=100 μm)Fig.4 Migration and invasion of MCF7 cells detected by Transwell in each group(bar=100 μm)
表3 各组MCF7 细胞迁移与侵袭细胞数比较(±s)Tab.3 Comparison of the migration and invasion of MCF7 cells in each group(±s)个

表3 各组MCF7 细胞迁移与侵袭细胞数比较(±s)Tab.3 Comparison of the migration and invasion of MCF7 cells in each group(±s)个
注:与control 组比较,#P<0.05;与雪松醇组比较,*P<0.05;与inhibitor-NC 比较,△P<0.05。
分组n迁移细胞数侵袭细胞数control 组6157.26±6.42128.39±5.76雪松醇组663.28±4.21#52.63±3.28#inhibitor-NC 组665.80±4.6354.70±3.61 miR-503-5p inhibitor 组6125.92±5.37*△106.38±4.93*△
2.6 雪松醇对各组MCF7 细胞PCNA、MMP-2、TCF3 蛋白表达的影响 与control 组比较,雪松醇组MCF7 细胞中PCNA、MMP-2、TCF3 蛋白表达水平显著降低(P<0.05);与雪松醇组、inhibitor-NC 比较,miR-503-5p inhibitor 组MCF7 细胞中PCNA、MMP-2、TCF3 蛋白表达水平显著升高(P<0.05),见图5 和表4。

图5 Western blot 检测MCF7 细胞中PCNA、MMP-2、TCF3 蛋白表达Fig.5 Expression of the PCNA,MMP-2 and TCF3 in MCF7 cells detected by Western blot
表4 各组MCF7 细胞中PCNA、MMP-2、TCF3 蛋白表达比较(±s)Tab.4 Comparison of the PCNA,MMP-2 and TCF3 protein expression in MCF7 cells in each group(±s)

表4 各组MCF7 细胞中PCNA、MMP-2、TCF3 蛋白表达比较(±s)Tab.4 Comparison of the PCNA,MMP-2 and TCF3 protein expression in MCF7 cells in each group(±s)
注:与control 组比较,#P<0.05;与雪松醇组比较,*P<0.05;与inhibitor-NC 比较,△P<0.05。
TCF3/GAPDH control 组6 1.74±0.131.56±0.151.58±0.13雪松醇组6 0.48±0.04# 0.36±0.03# 0.53±0.05#inhibitor-NC 组6 0.51±0.050.39±0.040.51±0.04 miR-503-5p inhibitor 组6 0.96±0.10*△ 0.84±0.07*△ 0.97±0.09*△分组nPCNA/GAPDH MMP-2/GAPDH
2.7 双荧光素酶报告实验检测miR-503-5p 和TCF3 的靶向关系 经starbase 在线预测显示,miR-503-5p 与TCF3 基因有靶向结合位点,见图6。与mimic-NC 和TCF3-WT 共转染组比较,miR-503-5p mimic 和TCF3-WT 共转染组的荧光素酶活性降低(P<0.05);与mimic-NC 和TCF3-MUT 共转染组比较,miR-503-5p mimic 和TCF3-MUT 共转染组荧光素酶活性变化无统计学意义(P>0.05),见表5。

图6 miR-503-5p 与TCF3 的结合位点与突变位点Fig.6 Binding sites and mutation sites of miR-503-5p and TCF3
表5 各组荧光素酶活性比较(±s)Tab.5 Comparison of luciferase activity in each group(±s)

表5 各组荧光素酶活性比较(±s)Tab.5 Comparison of luciferase activity in each group(±s)
注:与mimic-NC+TCF3-WT 组比较,#P<0.05。
分组n荧光素酶活性mimic-NC+TCF3-WT 组61.02±0.07 miR-503-5p mimic+TCF3-WT 组60.48±0.04#mimic-NC+TCF3-MUT 组61.04±0.11 miR-503-5p mimic+TCF3-MUT 组61.03±0.08
2.8 雪松醇对裸鼠移植瘤生长的影响 小鼠荷瘤实验结果表明,与对照组比较,雪松醇组小鼠移植瘤质量与体积明显下降(P<0.05);qRT-PCR 结果显示,雪松醇组移植瘤中miR-503-5p 水平升高(P<0.05);免疫组化检测结果显示,雪松醇组移植瘤中,TCF3、MMP-2 蛋白表达水平显著降低(P<0.05),见图7、8 和表6。

图7 各组小鼠剥离的移植瘤Fig.7 Transplanted tumors of mice in each group
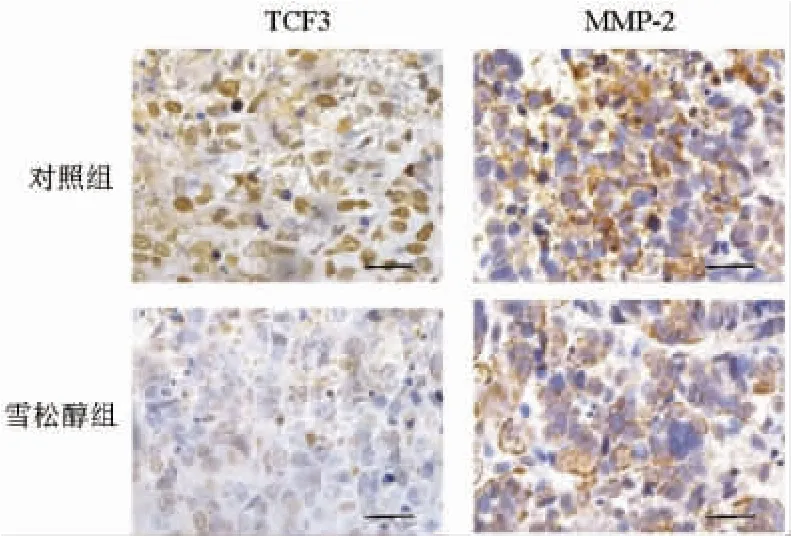
图8 免疫组化检测移植瘤组织中TCF3、MMP-2 蛋白表达(比例尺=100 μm)Fig.8 Immunohistochemical detection of TCF3 and MMP-2 protein expression in transplanted tumor tissues(bar=100 μm)
表6 各组裸鼠移植瘤生长、miR-503-5p 和TCF3、MMP-2 蛋白表达比较(±s)Tab.6 Comparison of xenograft tumor growth,miR-503-5p and TCF3,MMP-2 protein expression in nude mice in each group(±s)

表6 各组裸鼠移植瘤生长、miR-503-5p 和TCF3、MMP-2 蛋白表达比较(±s)Tab.6 Comparison of xenograft tumor growth,miR-503-5p and TCF3,MMP-2 protein expression in nude mice in each group(±s)
注:与对照组比较,#P<0.05。
分组动物数 小鼠体质量(g) 移植瘤体积(mm3) 移植瘤质量(g) miR-503-5pTCF3 阳性率(%)MMP-2 阳性率(%)对照组1026.14±1.751 438.46±195.721.16±0.131.03±0.1036.76±2.4143.65±3.12雪松醇组1025.83±1.48562.79± 96.14#0.47±0.05#1.92±0.15#15.92±1.72#17.38±1.58#
3 讨论
BC 因其高病死率和发病率而成为女性的主要健康问题,即使使用辅助化疗,转移性BC 的30 年生存率也低于1%[14]。因此,揭示BC 发生的关键分子机制,对于提高BC 患者的诊断和治疗水平具有重要意义。
雪松醇因具有良好的抗肿瘤活性而备受关注。雪松醇通过诱导细胞周期停滞和细胞凋亡抑制体内体外结直肠癌、肺癌的生长,被认为是治疗结直肠癌、肺癌的有效药物[5,7]。Chang 等[6]研究发现,雪松醇通过诱导细胞内活性氧(ROS)生成、触发DNA 损伤和阻断雄激素受体的核易位,有效抑制胶质母细胞瘤细胞生长。此外研究发现,雪松醇通过阻断丝苏氨酸蛋白激酶B(AKT)/哺乳动物雷帕霉素靶蛋白(mTOR)途径降低胶质母细胞瘤对替莫唑胺的耐药性,通过质膜脂质筏的失稳增强癌细胞化疗的敏感性[6,15]。本研究发现,雪松醇降低MCF-7 细胞OD490值、Edu 阳性细胞率、迁移与侵袭数、PCNA、MMP-2蛋白表达水平和移植瘤质量。提示,雪松醇可抑制MCF7 细胞增殖、迁移和侵袭,具有抗BC 的作用。
越来越多的证据表明miRNAs 可作为癌症的诊断标志物和治疗靶点[16]。miR-503-5p 在多数肿瘤中呈低表达,发挥抗癌基因的作用,如在胃癌、结肠癌、卵巢癌、胰腺癌中低表达,过表达miR-503-5p后可抑制肿瘤细胞的生长、迁移和侵袭等恶性行为。本研究发现,miR-503-5p 在BC 组织和细胞中低表达,雪松醇可促进miR-503-5p 在MCF7 细胞和移植瘤中的表达,并且抑制miR-503-5p 表达后,可逆转抑制雪松醇对MCF7 细胞增殖、迁移和侵袭的抑制作用。推测雪松醇可能通过上调miR-503-5p 表达,从而抑制BC 细胞增殖、迁移和侵袭。
miRNA 通过与靶mRNA 内的互补序列进行碱基配对,在基因表达的转录后调控中发挥作用。经生物信息学分析显示,miR-503-5p 与TCF3 之间存在结合位点,双荧光素酶报告基因实验证实了miR-503-5p 与TCF3 之间存在靶向关系。TCF3 是Wnt 通路相关T 细胞特异性转录因子/淋巴增强因子(TCF/LEF)转录因子家族的成员。研究表明,TCF3在包括BC 在内的多种肿瘤中发挥促癌作用[13]。然而,致癌驱动因素TCF3 如何影响BC 进展的分子机制尚未完全阐明。本研究发现,TCF3 蛋白在BC 组织中和细胞中高表达,雪松醇可下调TCF3 在MCF7细胞和移植瘤中的表达,而抑制miR-503-5p 表达后,TCF3 蛋白表达水平升高,减弱了雪松醇对TCF3蛋白表达的抑制作用,证实了雪松醇可能通过上调miR-503-5p 表达来下调TCF3 蛋白表达,进而抑制BC 细胞增殖、迁移和侵袭。
综上所述,雪松醇能抑制BC 细胞增殖、迁移和侵袭,其机制可能与调控miR-503-5p/TCF3 轴有关,miR-503-5p/TCF3 轴可能成为治疗BC 的新靶点,然而本研究尚存在不足之处,仅验证了雪松醇调控miR-503-5p/TCF3 轴对BC 细胞增殖、迁移和侵袭的作用,而未对其他靶点和通路进行验证,后续需要进一步开展研究。
