慢性肾脏病患者合并新型冠状病毒感染的临床特征及预后
2023-09-19王晶晶周厚安李世军王金泉刘正钊谢红浪胡伟新
李 喆 左 科 王晶晶 周厚安 金 英 陈 光 李世军 程 震 王金泉 刘正钊 谢红浪 胡伟新
新型冠状病毒肺炎(NCP)是由新型冠状病毒感染(COVID-19)所导致的肺部炎症。2022-12-07国务院联防联控机制发布了《关于进一步优化落实新冠肺炎疫情防控措施的通知》,心脑血管疾病、慢性阻塞性肺疾病、糖尿病、慢性肾脏病(CKD)、肿瘤等患者是需要重点推进健康情况摸底及分级分类管理的人群[1]。荟萃研究发现男性、老年人和多种慢性病共病患者病毒易感性强,预后差[2]。开源数据分析平台(OpenSAFELY)显示,透析、移植、CKD和血液系统恶性肿瘤是与NCP最高死亡风险相关的四种共病[3]。西班牙的单中心研究发现,553例CKD合并NCP中糖尿病肾病(DN)占20.5%,狼疮性肾炎(LN)占10.3%[4]。本研究回顾性分析疫情防控常态化以来,本中心收治的CKD合并NCP患者的临床特征及预后,以期为此类患者分级诊疗和预后评估提供参考。
对象和方法
研究对象在国家肾脏疾病临床医学研究中心电子病历系统中,通过国际疾病分类ICD-10诊断编码检索出2022年12月至2023年6月确诊的CKD合并NCP住院患者。所有患者均符合改善全球肾脏病预后组织(KDIGO)的CKD诊断标准。NCP诊断依据《新型冠状病毒感染诊疗方案(试行第十版)》[5]。排除标准:(1)确诊NCP前已进展至终末期肾病(ESKD),或已接受肾移植、维持性血液透析或腹膜透析;(2)临床及影像学资料不完整。本研究最终纳入符合上述标准的患者72例,根据是否死亡,分为存活组和死亡组,随访终点定为死亡或存活至2023年7月,中位随访时间6(1,7)月。
临床资料及实验室指标记录患者的年龄,性别,慢性病共病情况,CKD病史及免疫抑制剂使用情况,感染后实验室指标和CT影像学特征,NCP治疗情况及预后。
统计学方法使用《SPSS 20.0》软件进行数据分析,正态分布计量资料以均数±标准差表示,偏态分布计量资料以中位数(四分位间距)表示。组间比较正态分布采用t检验,非正态分布采用Mann-Whitney U检验。计数资料以百分比表示,组间比较采用χ2检验或Fisher’s精确检验。采用单因素COX回归模型计算各个因素的风险比值(HR),并将单因素P<0.1的变量纳入多因素COX回归模型,以进一步明确独立预后因素。生存率采用Kaplan-Meier法分析、采用Log-rank检验比较生存曲线之间的差异。P<0.05为差异有统计学意义。
结 果
一般资料72例患者中男性39例(54.17%),CKD起病中位年龄为58.50(32.75,69.00)岁,中位CKD病程36(7,120)月。CKD病因中DN 16例(22.22%),LN 9例(12.50%),膜性肾病和抗中性粒细胞胞质抗体(ANCA)相关性肾炎各7例(9.72%),IgA肾病3例(4.17%),微小病变型肾病(MCD)和高血压肾损害各2例(2.78%),抗肾小球基膜(GBM)肾炎、多发性骨髓瘤肾损害、膜增生性肾小球肾炎、痛风性肾病、过敏性紫癜性肾炎、Alport综合征、肥胖相关性肾病各1例(1.39%),余19例CKD病因未明。26例(36.11%)长期服用泼尼松。13例(18.06%)患者感染前接种了新冠疫苗,COVID-19时中位年龄为64(39,76)岁,NCP临床分型:中型37例(51.39%)、重型15例(20.83%)、危重型20例(27.78%)(表1)。
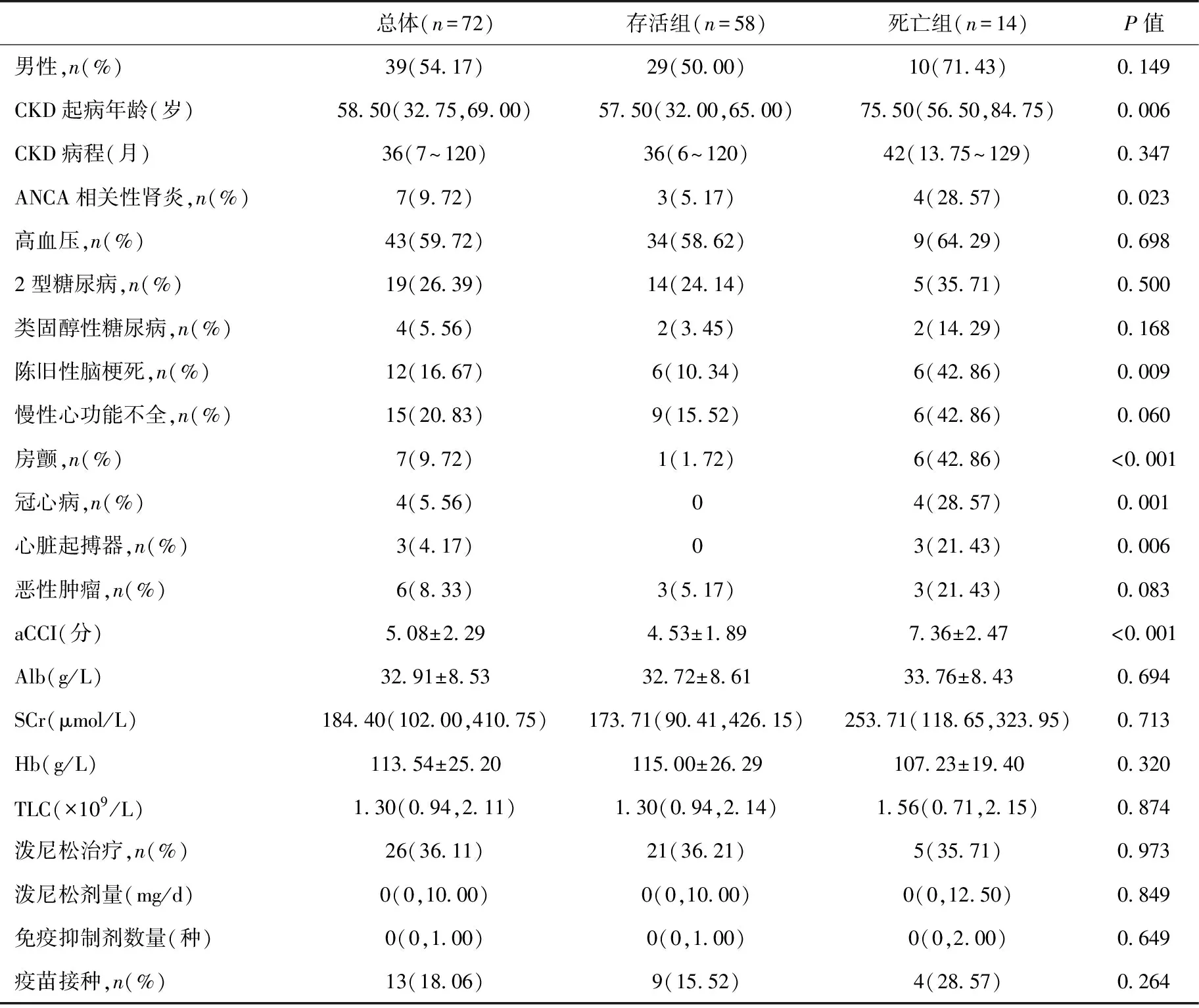
表1 72例CKD合并NCP患者的基线特征
临床表现14例(19.44%)患者死亡。死亡组年龄较大,ANCA相关性肾炎、合并陈旧性脑梗死、房颤、冠心病、植入心脏起搏器更多,年龄校正Charlson合并症指数(aCCI)高于存活组(P<0.05)。COVID-19前1.00(1.00,4.75)月时,两组血清白蛋白(Alb)、血清肌酐(SCr)、血红蛋白(Hb)、总淋巴细胞计数(TLC)、疫苗接种及免疫抑制剂无明显差异。COVID-19后死亡组最高体温较高,胸闷比例高,NCP症状出现至入院时间短(P<0.05)。死亡组入院时乳酸脱氢酶(LDH)、N末端脑利尿钠肽前体(NT-proBNP)、C反应蛋白(CRP)、降钙素原(PCT)、白细胞介素6(IL-6)、肌钙蛋白T(TnT)、肌钙蛋白I(TnI)、D-二聚体更高;而氧合指数、总胆固醇、淋巴细胞亚群均更低(P<0.05)。在院期间死亡组CRP、PCT、IL-6的最高值、机械通气、连续性肾脏替代治疗(CRRT)和心力衰竭、肝功能受损、气胸比例更高,TLC的最低值更低(P<0.05)(表2)。
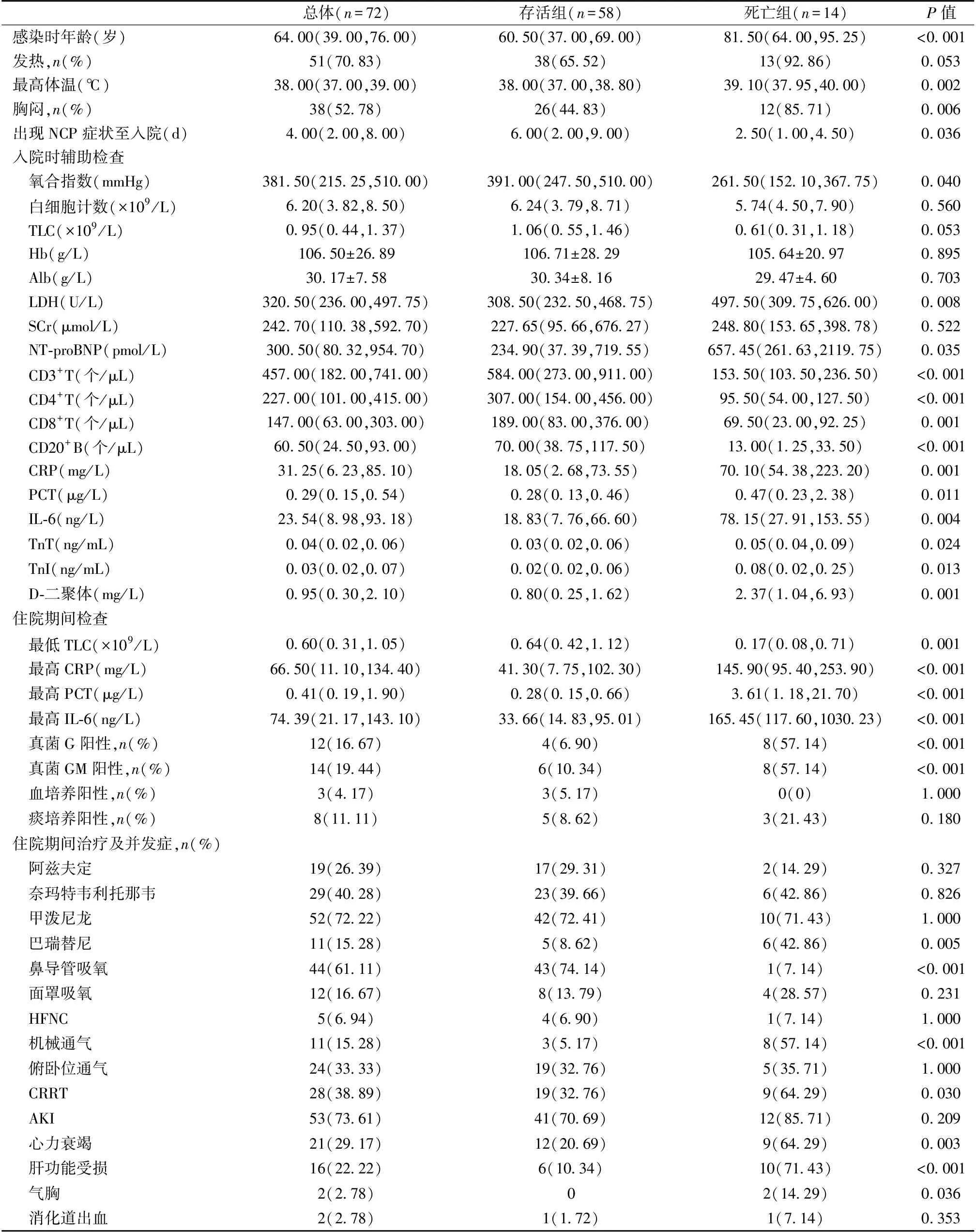
表2 CKD合并NCP患者的临床特征
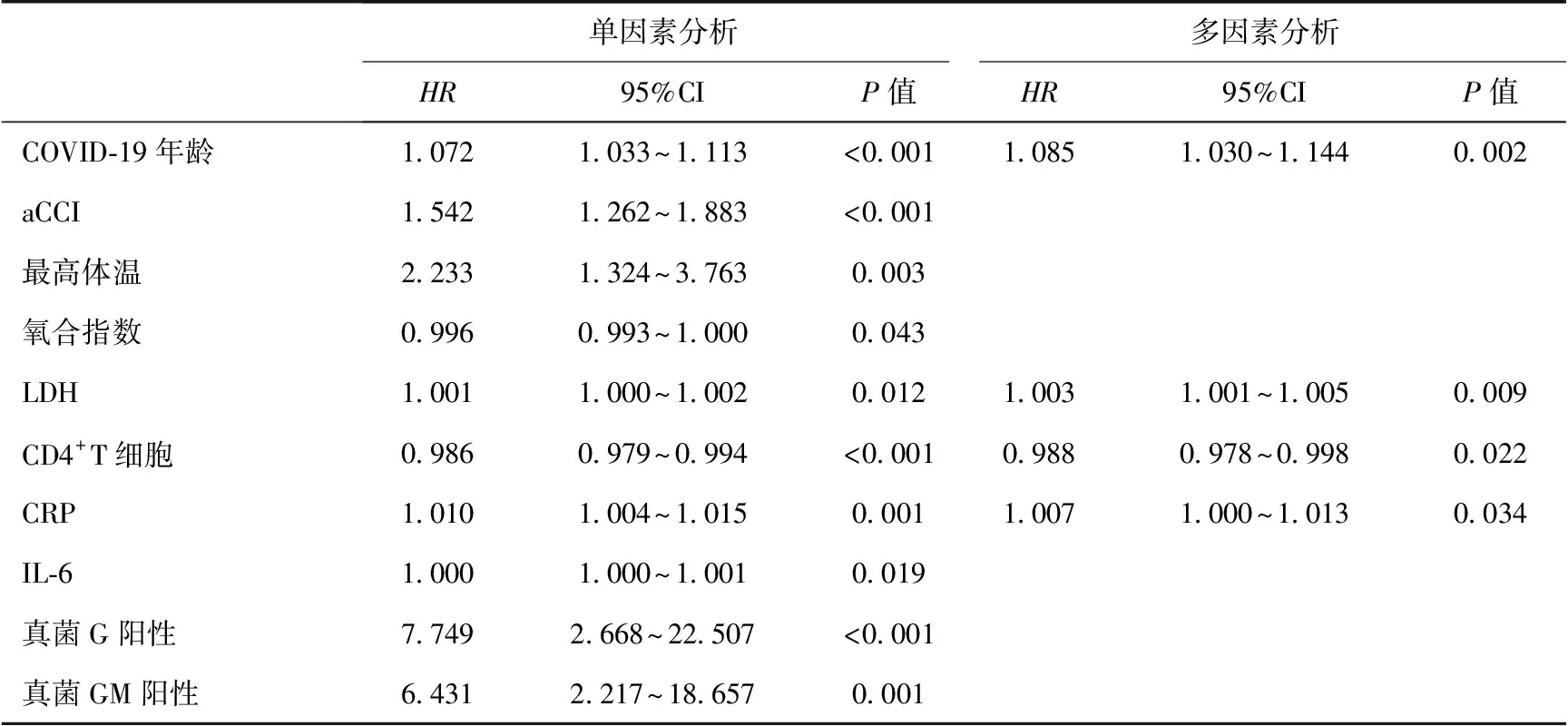
表3 患者死亡的危险因素
混合感染情况本组患者血培养见鲍曼不动杆菌3例;痰培养见阴沟肠杆菌、鲍曼不动杆菌、白色念珠菌各2例,肺炎克雷伯菌、粘质沙雷菌、嗜麦芽假单胞菌、烟曲霉各1例;支气管肺泡灌洗液(BALF)培养见鲍曼不动杆菌3例,烟曲霉1例;通过宏基因组二代测序(mNGS),1例在BALF中检测出烟曲霉和耶氏肺孢子菌(PJ),1例在胸腔积液中检测出鲍曼不动杆菌和烟曲霉,1例在血液中检测出PJ。死亡组血液真菌1,3-β-D葡聚糖检测(真菌G)、真菌半乳甘露聚糖检测(真菌GM)阳性率高于存活组(P<0.05),但血培养、痰培养阳性率无明显差异(表2)。
肾功能变化本组患者NCP入院时SCr与基线无明显差异[242.70(110.38,592.70) μmol/Lvs184.40(102.00,410.75) μmol/L,P=0.345],存活组58例患者中41例(70.69%)治疗期间出现急性肾损伤,其中18例(31.03%)NCP治愈后进展至ESKD,余23例(39.66%)出院前与入院时SCr无明显差异[151.16 (115.80,210.39) μmol/Lvs218.40 (130.10,295.00) μmol/L,P=0.199]。
死亡风险分析多因素COX模型发现,COVID-19年龄、LDH、CD4+T细胞、CRP是CKD合并NCP患者死亡的独立危险因素(表3)。
讨 论
CKD患者是COVID-19的易感和高危人群。意大利预防肾功能不全进展(PIRP)队列发现,CKD患者的NCP发病率(4.09%vs0.46%)和死亡率(44.6%vs4.7%)是普通人群的10倍[6]。美国重症监护室(ICU)多中心数据表明,NCP中CKD患者28 d院内死亡率为50%,而非CKD患者为35%[7]。虽然我国CKD的首要病因是慢性肾小球肾炎[8],但本次COVID-19的CKD疾病谱中,本研究与国外报道一致DN占比最多[3]。本世纪以来的突发公共卫生事件中已发现糖尿病患者更易罹患严重急性呼吸系统综合症和中东呼吸系统综合征[9],我们既往也发现DN是CKD曲霉感染第二大类人群[10],结核病多继发于合并糖尿病的CKD患者[11]。但控制血糖能否降低DN患者COVID-19的易感性和改善NCP预后,目前尚无定论。
荟萃研究发现TLC及血小板减少、CRP、PCT、LDH、D-二聚体升高与NCP严重程度存在显著相关性,与本研究结论一致[12]。与整体人群的NCP相比,在高龄、慢性病共病多、缺氧、免疫功能低下、炎症反应强等影响预后的共性因素外,CKD严重程度、免疫抑制剂强度、混合感染种类、器官功能衰竭是CKD合并NCP患者的个性因素。本研究发现死亡组ANCA相关肾炎较多,在现有的个案报道[13]和队列研究[14]中,有学者认为COVID-19不仅会导致原有ANCA相关肾炎病情加重,还可能诱发新的ANCA相关肾炎。
我们既往研究发现感染曲霉[10]、PJ[15]、结核分枝杆菌[11]的CKD患者,以及LN合并持续炎症-免疫抑制-分解代谢综合征(PICS)的患者免疫抑制剂强度与预后尤为相关[16]。COVID-19全球风湿病联盟(C19-GRA)注册研究发现风湿病活动程度、免疫抑制剂强度、泼尼松≥10 mg/d与风湿病合并NCP更高的死亡率相关[17]。在免疫介导的炎症性疾病中,与标准全身治疗相比,联合大多数靶向药物治疗的患者NCP不良结局的风险并未增加[18]。有学者总结医源性或疾病相关的免疫抑制与NCP不良预后无明确相关性,但某些特定疾病状态或免疫抑制剂可能存在有害或有益的影响,例如人类免疫缺陷病毒(HIV)感染者中严重CD4+T细胞减少的NCP患者预后较差,实体器官移植常用的钙调神经磷酸酶抑制剂和治疗风湿病的肿瘤坏死因子α抑制剂可能对其合并NCP的患者有益[19]。本研究发现COVID-19前CKD患者存活组和死亡组免疫抑制剂强度无明显差异。考虑本研究样本数量较少,对于CKD病情活动程度和免疫抑制强度对NCP预后的影响需要扩大样本进一步探索。
荟萃研究发现,14%~25%的NCP患者存在混合感染,19%~30%存在重叠感染。混合或重叠感染比单纯COVID-19者死亡风险更高[20]。COVID-19相关肺曲霉菌病(CAPA)患病率在2.7%~27.7%,血液真菌GM阳性者,即使接受全身抗真菌治疗,死亡率也超过80%[21]。无论是预防、抢先还是靶向治疗,没有研究表明抗真菌治疗可降低死亡率。由于COVID-19和PJ混合或重叠感染仅限于少数病例报告,因此无法准确评估NCP合并耶氏肺孢子菌肺炎(PJP)患者的真实发病率、危险因素和预后[22]。参照既往非HIV-PJP人群的研究,NCP期间使用激素[15]、病毒诱导[23]和医源性淋巴细胞减少是潜在的危险因素。本研究发现CKD合并NCP死亡组中血液真菌G、GM阳性率达57.14%,部分患者通过培养、mNGS可发现曲霉及PJ[24]。是否需要抗真菌、抗真菌药物时机及种类、与抗病毒药物配伍禁忌的问题,是整个治疗过程中最棘手的问题。
本研究的局限在于单中心回顾性研究的样本量较小,既往有CKD但感染前未在我院就诊的NCP患者可能有所遗漏,CKD病因覆盖不全面,随访时间偏短,缺少新冠病毒抗体的完整数据对患者的免疫应答进行全面评估。救治药物及医疗设备供应早期曾一度短缺,同时抗病毒及免疫治疗在重型和危重型NCP的应用,一直处于边摸索、边使用、边总结的过程,迄今为止仍无定论,需待后续多中心、扩大样本量进行进一步研究[25]。
综上所述,CKD合并NCP患者,DN占比高,疫苗接种率低,伴发疾病多。高龄、缺氧、免疫功能低下、炎症反应强的患者预后差。治疗过程中易出现混合或重叠真菌感染以及多器官功能衰竭。
