新型冠状病毒感染相关肾小球疾病
2023-09-19任语谦综述谢红浪审校
汪 卿 任语谦 综述 谢红浪 审校
2020年开始,新型冠状病毒感染(COVID-19)给全球医疗卫生系统带来了巨大挑战,全球累计报告确诊病例逾7.6亿,死亡病例超过690万。2023-05-05世界卫生组织宣布,新冠疫情不再构成“国际关注的突发公共卫生事件”,我国对新冠疫情实施“乙类乙管”政策,但并不意味着COVID-19已经对人类无害,我国仍然要坚持预警监测、疫苗接种等必要的防控措施。
新型冠状病毒(简称新冠病毒)可以通过病毒的直接侵袭、内皮细胞损伤、免疫系统调节失衡和肾素-血管紧张素-醛固酮系统(RAAS)功能紊乱等多种机制造成组织器官损伤。虽然COVID-19以肺部损伤为主要表现,但由其导致的呼吸系统外的病变同样不容忽视[1]。其中,急性肾损伤(AKI)在COVID-19患者中并不罕见,住院患者和ICU患者中的发生率分别超过20%和50%,而31%的AKI患者需要进行肾脏替代治疗[2],成为影响患者预后的重要危险因素。
同样,新冠病毒可通过细胞毒性、补体激活、免疫失调和凝血异常等多种途径[3-4],直接导致肾小球损伤。一项单中心研究中,住院治疗的COVID-19患者中65.8%有蛋白尿[5],主要与缺氧、脓毒症和血流动力学紊乱导致的急性肾小管坏死相关,但其中也不乏COVID-19引发免疫紊乱所致的肾小球疾病患者。对76项共511例与COVID-19相关的自体肾脏病理研究发现,80.2%的患者表现为肾小球病变,其中足细胞损伤占47.1%,寡免疫复合物性新月体肾炎占7.6%,IgA肾病和膜性肾病各占5.6%,25.1%为其他肾小球病变[6]。已经有相关研究发现,新冠疫情期间某些肾小球疾病的发病率明显升高[7],可能是与免疫失衡、自身抗体产生、细胞因子上调、补体激活或病毒的直接毒性等相关因素有关[3]。因此,了解新冠病毒导致的肾小球损伤,可有助于临床医师对肾脏疾病患者实施更为有效地评估和诊治。
足细胞损伤
塌陷性肾小球病塌陷性肾小球病也称为新冠病毒相关性肾炎(COVAN),是COVID-19患者肾活检的主要病理类型[6]。Larsen等[8]首次在黑人COVID-19患者中发现此类病变,患者的主要临床表现为肾病范围蛋白尿及重度AKI,肾脏病理结果提示塌陷性局灶节段肾小球硬化(FSGS)及弥漫的急性肾小管坏死,APOL1基因分型结果提示患者是G1风险等位基因的携带者。随后,陆续有作者报道了COVID-19患者中塌陷性肾小球病和APOL1的两个风险位点相关。May等[7]研究显示,91.7%的塌陷性肾小球病非裔及西班牙裔患者中携带APOL1的两个风险位点,而非塌陷性肾小球病的患者中只有35.6%携带两个风险位点。APOL1基因型与肾脏疾病的关联以前曾在多种病毒感染中有所报道,如巨细胞病毒、B19副病毒、Epstein-Barr病毒及人类免疫缺陷病毒(HIV)[9]。尽管COVID-19的肾小球损伤与HIV的肾脏损伤病理生理学上有相似之处,但在患者的肾组织中并未如同HIV一样直接检测到病毒的存在。目前认为COVID-19导致的肾小球损伤与新冠病毒导致的免疫失调有关,白细胞介素(IL)-1β、IL-6、IL-10和干扰素(IFN)-γ等细胞因子在COVID-19感染时表达上调[10]。而患者携带APOL1的风险位点突变时,IFN与其相互作用,最终导致肾小球上皮细胞自噬功能受损、线粒体功能障碍和细胞损伤[9]。根据既往报道统计分析显示[6],病理表现为塌陷性肾小球病的患者发病中位年龄为57岁,由于和遗传背景相关,90%以上的患者拥有非裔血统。患者临床表现为大量蛋白尿及严重的AKI。病理结果显示肾小球簇塌陷伴肾小管损伤,小管间质的损伤程度与发病时间相关,一些患者肾组织中可见淋巴细胞浸润。免疫荧光通常为阴性。电镜下,在肾小球基膜(GBM)与毛细血管腔之间,偶见管网状包涵体(tubuloreticular inclusions,TRI),亦称“干扰素印迹”(interferon foot-print)。目前尚无证据在塌陷性肾小球病患者直接发现病毒存在,仍需进一步的研究证实新冠病毒与此类病变的关系。此类患者预后较差,大约70%的患者需要维持性透析治疗,明显高于非COVID-19的塌陷性肾小球病患者(30%)[11]。
非塌陷性足细胞病包括微小病变性肾病(MCD)和FSGS,是仅次于塌陷性肾小球病第二常见的肾脏病理损伤类型,亦多见于非裔美国人(75%)。MCD患者电镜下可见弥漫的足突消失和微绒毛化,其发病机制可能与COVID-19引发的T淋巴细胞活化和细胞因子(如IL-4、IL-10和IFN等)有关,未发现病毒存在的直接证据。有文献报道1例携带高危APOL1基因(G1/G1)风险位点的COVID-19患者发生MCD,肾组织中可见TRI[7,12],提示细胞因子介导的足细胞损伤对易感人群的致病性。FSGS是由多种因素导致的异质性疾病,部分患者的FSGS病变可能继发于COVID-19之前的基础疾病(如糖尿病、高血压等),应注意区分。非塌陷性足细胞病与APOL1高危等位基因的关联性稍弱,但在非裔美国人和西班牙裔患病人群中的携带率仍高达85.7%[6]。其临床表现与非COVID-19者相似,预后好于塌陷性肾小球病患者,37.5%的患者需要肾脏替代治疗,25%的AKI患者肾功能完全恢复,仅6%的患者需要长期血液透析[6]。
膜性肾病
膜性肾病可继发于病毒感染,有报道发现COVID-19后出现膜性肾病。新冠病毒导致膜性肾病的致病机制仍不清楚,少数患者磷脂酶A2受体抗体阳性,可能与针对病毒性免疫反应失调导致自身抗体的产生有关。但多数患者磷脂酶A2受体抗体为阴性,提示膜性肾病与病毒感染有关。与足细胞损伤不同的是,膜性肾病患者并无明显的种族倾向性,大多于病毒感染1周后发病。肾脏病理损伤通常为轻到中度,少数病例伴急性小管间质病变。多数专家建议在没有肾功能下降或其他并发症的病例中推迟使用免疫抑制。由于目前临床病例数较少,预后结果相对不详,部分患者需要透析维持甚至死亡[13]。
神经表皮生长因子样蛋白1(NELL1)是膜性肾病的一种新发现的抗原标志物。在与NELL1相关的膜性肾病中,NELL1从足细胞脱落,并与针对NELL1的自身抗体结合,形成抗原抗体复合物,定位于GBM。在一项猕猴的体内研究中,观察者们发现感染新冠病毒后,猕猴肾脏足细胞NELL1基因表达显著上调;免疫荧光染色显示,感染组的GBM上可见IgG染色阳性,而健康对照组IgG染色为阴性,这表示COVID-19可能导致猕猴出现NELL1相关的膜性肾病。该研究的发现为膜性肾病的临床研究提供了新思路[14]。
IgA肾病
IgA是COVID-19病程早期的最主要免疫球蛋白,并且与临床严重程度直接相关[15]。新冠病毒本身与新冠疫苗都会导致临床IgA肾病的发生[16]。由COVID-19导致的炎症和细胞因子风暴是触发易感个体IgA肾病的危险因素。与普通IgA肾病患者相比,COVID-19后的IgA肾病患者发病年龄明显较大(64.5岁vs34岁)[17],并以男性和白人多见。大部分患者在病毒感染3周左右发病,多伴有AKI。几乎所有的患者均有血尿及肾病范围的蛋白尿,约半数患者同时合并有皮肤血管炎的表现。肾脏病理表现与普通IgA肾病相似,光镜下可见节段硬化、系膜增生及内皮细胞增殖等表现。COVID-19相关的IgA肾病患者肾活检病理中,新月体等活动性病变出现的概率更高[6]。有报道通过免疫组化在IgA肾病患者肾小管上皮细胞的细胞质发现了新冠病毒颗粒,然而新冠病毒的PCR结果是阴性的[18],提示仍然需要进一步的研究来证实新冠病毒直接导致IgA肾病的可能。大部分患者预后较好,经过积极治疗的少部分患者蛋白尿可以完全缓解,多数患者得到了部分缓解。仅有1例患者由于合并感染等原因未能实施更为积极的免疫抑制治疗,导致报道时仍未能摆脱血液透析[19]。
抗中性粒细胞胞质抗体(ANCA)相关性肾损害
据报道,巨细胞病毒、Ebstein-Barr病毒和登革病毒与ANCA相关性肾损害有关[20],目前认为COVID-19相关的免疫失调和细胞因子风暴可导致ANCA的产生;另一种相关机制认为由于COVID-19作为第二次打击,导致易感宿主发病。绝大部分COVID-19后的ANCA相关性肾损害患者临床表现为严重的AKI,通常于感染后1周发病。ANCA类型有差异,MPO-ANCA占43.7%,PR3-ANCA占25%,C-ANCA占12.5%,6.3%的患者同时发现有C-ANCA和P-ANCA,还有6.3%的患者为MPO-ANCA和PR3-ANCA双阳性,另外有部分患者(6.3%)ANCA阴性[6]。肾组织病理结果显示肾小球硬化程度轻重不一,部分患者可以同时发现肾小管坏死及间质炎症浸润。Uppal等尝试在患者肾组织中寻找新冠病毒的存在但未有明显阳性结果的发现[21]。仅有少部分患者可以完全康复,大部分患者持续表现为肾功能不全,另有一小部分患者依赖肾脏替代治疗甚至死亡[6]。
抗GBM疾病
美国病理学家Ernest Goodpasture在1919年西班牙大流感流行季首次报道了抗GBM疾病。研究表明[6],抗 GBM 疾病病例在空间和时间上都有集群现象,因此认为特殊基因背景(如DRB1*1501,DRB1*03,DRB1*04)和环境诱因(如感染、吸烟、有机溶剂、肾切除术/体外冲击波碎石)可能与抗 GBM 疾病的发生有关。在新冠疫情期间,印度钦奈地区由于AKI或急进性肾小球肾炎(RPGN)而进行肾活检的患者中,抗GBM疾病的发病率较之前增加了68%,活检病理提示所有患者均见IgG沿GBM呈线样沉积,并伴细胞性新月体[22]。Prendecki等[23]报道,2019年12月至2020年4月,在英国North West London地区,抗GBM疾病患者数增加,发病率增至既往同期的5倍,从1.5 PPM升至8.0 PPM。
COVID-19引起抗GBM疾病机制尚不明确。新冠病毒可感染肺的内皮细胞,引起局部炎症和补体活化并损伤内皮细胞,从而导致肺基底膜上隐藏的GBM表位被暴露,刺激浆细胞产生相应的自身抗体,导致抗GBM疾病的发生。其临床表现通常在新冠感染数天或数周之后出现。多数患者血清中检出 IgM 或 IgG型抗新冠病毒抗体,病毒RNA多为阴性,提示病毒感染启动了一种靶向基底膜的异常适应性免疫反应,在急性感染后数天至数周出现显著的临床症状[22-23]。
值得注意的是,由于新冠病毒具有复杂的转录组,与人类蛋白具有分子相似性,因此可以产生多种自身抗体。Babu等[24]报道1例59岁男性患者COVID-19后MPO-ANCA与抗GBM抗体均阳性,肾活检显示新月性肾小球肾炎,免疫荧光见GBM的线样IgG沉积。在接受甲泼尼龙和环磷酰胺静脉冲击治疗3周后抗GBM抗体转为阴性;5月后,ANCA和抗 GBM抗体均转为阴性,治疗期间未接受血浆置换和肾脏替代治疗。有证据表明,ANCA相关性血管炎(AAV)有时会并发抗GBM疾病,反之亦然。在 AAV 中,被ANCA激活的中性粒细胞释放的蛋白酶会消化Ⅳ型胶原,导致其α3链非胶原区结构域1暴露,被AAV特异性 CD11c+巨噬细胞捕获并呈现GBM 表位,再被宿主免疫系统识别,从而产生抗GBM抗体[25](图1)。
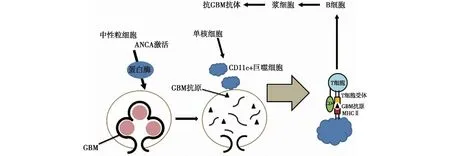
图1 AAV时产生抗 GBM 抗体的机制示意图[25]
血栓性微血管病(TMA)
多种病毒感染可以诱发TMA,其发病机制可能与携带补体基因变异的患者受到感染的二次打击有关[26]。COVID-19可能导致TMA的潜在机制包括病毒感染活化巨噬和单核细胞,释放炎症介质,损伤血管内皮细胞,激活补体、血小板和凝血通路等,导致微血管病变和微血栓形成[27]。目前已经报道的TMA样病变COVID-19患者均表现为AKI 3期,伴有镜下血尿及中等量蛋白尿。少部分患者被证实携带补体相关基因变异而导致的补体系统功能异常;部分患者血浆C5d水平升高,伴内皮细胞C5b-9沉积。TMA患者的预后较差,在接受依库利珠单抗和利妥昔单抗等新型生物制剂治疗的前提下,仍有2/3的患者无法摆脱透析,23%的患者死亡[6]。临床上可能对此类患者需要更为积极的干预措施来确保取得相关较好的治疗效果。
小结:尽管自新冠病毒大流行以来已有一些关于COVID-19患者肾小球疾病的系列病例和报道,但目前仍缺乏大规模的人群研究,探讨COVID-19后肾小球疾病的发病率和流行率。许多肾小球疾病可能与COVID-19仅仅是巧合而非真正相关。仍需进行相应的对照研究来比较非COVID-19及COVID-19患者在临床、病理和预后方面的差异。另外,在COVID-19流行的情况下,肾小球疾病的治疗仍具有挑战性。在COVID-19后如何进行免疫抑制治疗,仅通过抗病毒治疗能否改善COVID-19相关的肾小球疾病的预后,还是需要额外的免疫抑制治疗,治疗药物的类型、剂量、免疫抑制的持续时间和长期疗效都需要相应的研究证据来明确并进一步探讨。上述问题均进行更大规模的前瞻性研究,以更好地了解COVID-19相关肾小球疾病的临床特征、流行病学特点和预后。
目前已有临床报道发现COVID-19患者可发生多种的肾小球疾病。每种疾病过程的潜在机制仍不清楚,很可能是多种因素共同导致。高炎症状态和病毒的直接细胞毒性可能是足细胞损伤的原因,尤其是高风险的APOL1基因型携带者。免疫失调可能诱发或揭示某些自身免疫过程,例如膜性肾病、IgA肾病、ANCA相关性肾损害。临床医生在判断肾小球疾病与COVID-19之间可能的因果关系时,应考虑肾脏表现的起始时间、病变类型、病变的慢性化程度及病理生理学的合理性。不同种类肾小球病变患者远期预后仍有待观察和随访。
