雷公藤红素通过下调FAT10抑制结直肠癌细胞增殖促进凋亡的研究
2023-09-19王雪丽张昱郝荣荣胡英男王建伟张威
王雪丽 张昱 郝荣荣 胡英男 王建伟 张威
结直肠癌(CRC)是常见的恶性肿瘤之一,其发病率位居全球新发癌症的第三位,约为10.2%,死亡率位列全球第二,约为9.2%[1]。近年,我国结直肠癌的发病率和死亡率还在逐年上升,且呈现年轻化趋势,已经成为严重的公共卫生问题[2]。研发新型治疗药物有望使我国CRC患者在临床治疗中有更大获益,并且减轻医疗和社会的负担。人白细胞抗原F位点相邻转录本10(FAT10)是一种类泛素样蛋白,其功能类似于泛素化蛋白,是蛋白酶体靶向的标签[3]。有研究表明FAT10在多种肿瘤中高表达,例如胶质瘤、肝细胞癌、乳腺癌、胰腺癌和胃肠道癌,表明其可能参与癌症发展的途径[4-5]。然而,FAT10与细胞恶性转化和进展之间的联系尚未确定。雷公藤红素(Cel)是一种从雷公藤植物中分离的一种活性成分,具有广泛的生物学特性,如抗肿瘤、免疫抑制和减肥活性[6-7]。《Cell》杂志曾将Cel评价为最有可能开发为现代药物的天然化合物之一[8]。然而,Cel对FAT10表达的影响并未报道,本文旨在研究Cel在结直肠癌中的作用,尤其是对FAT10的调控。
1 材料与方法
1.1 材料 人源结直肠癌细胞株SW480、HCT116,购买自武汉普诺赛生命科技有限公司;Cel,批号(HC020128),纯度>98%,购买自辰光生物科技有限公司;DMEM培养基、青霉素和链霉素、胰蛋白酶,全购自美国HyClone公司;胎牛血清购自以色列Biolnd公司;FAT10一抗、GAPDH一抗、辣根过氧化物酶标记兔二抗,购自中国杭州华安生物公司;细胞计数试剂-8(cell counting kit-8,CCK-8)试剂盒、RIPA裂解液、苯甲基磺酰氟(PMSF),购自碧云天生物技术有限公司;细胞凋亡试剂盒,购自杭州联科生物技术股份有限公司;M-MLV反转录预混试剂盒和SYBR Green qPCR试剂盒购自湖南艾科瑞生物公司;ECL发光液购自弗德生物科技有限公司。
1.2 方法 (1)细胞培养:SW480和HCT116细胞在含10%胎牛血清、1%青霉素、链霉素的DMEM培养介质中,细胞传代后放置在37℃、5%CO2的培养箱中。(2)Cel溶液配制:精确称取Cel约45.0609 mg溶于精密移取的1 mL DMSO溶液中配置成100 mM的母液,分装冻存于-20℃。(3)细胞毒性实验:将状态良好的处于对数生长期的SW480、HCT116细胞消化后铺在96孔板中(5,000个/孔),细胞贴壁后用梯度稀释法配制不同浓度的Cel(0、0.315、0.625、1.25、2.5、5、10、20 μmol/L)处理,Cel作用24 h后,吸除旧培养基,每孔添加90 μL新鲜DMEM和10 μL CCK8溶液,37℃避光孵育2 h,用酶标仪检测450 nm处的吸光度(A)值。细胞活力(%)=[A(加药组)-A(空白组)]/[A(对照组)-A(空白组)]×100%。(4)细胞凋亡检测:将细胞培养于12孔板,加入不同浓度的Cel和不含药物组,待药物作用24 h后,按照凋亡试剂盒说明书用Annexin V-FITC/PI染色,然后采用流式细胞术检测细胞的凋亡情况。(5)实时荧光定量聚合酶链式反应(real-time quantitative polymerase chain reaction,RT-qPCR)检测FAT10的表达:采用Trizol试剂提取细胞总RNA,之后按照说明书步骤用逆转录试剂预混液合成cDNA。以该cDNA为模板,使用SYBR Green进行实时荧光定量PCR实验,采用2-ΔΔCt法计算FAT10 mRNA的相对表达量。FAT10引物:正向序列为 5′-CTTGTGGAGTCAGGTGATG-3’,反向序列为5′-CCATTGCAAGTCACAATCTG-3’。GAPDH引物:正向序列为5′-AGAAGGCTGGGGCTCATTTG-3’,反向序列为5′-AGGGGCCATCCACAGTCTTC-3’。(6)Western Blot实验:采用RIPA裂解液提取细胞蛋白并BCA定量。10%的十二烷基硫酸钠-聚丙烯酰胺凝胶分离等量的蛋白样品,然后转至聚偏氟乙烯(PVDF)膜上。在室温下用5%脱脂牛奶封闭1 h后,分别用相应的一抗4 ℃孵育过夜,FAT10单抗(18 kDa;1∶1,000)、GAPDH抗体(36 kDa;1∶10,000)。室温下与HRP结合的二级抗体孵育1 h。TBST洗涤3次后,用ECL发光液检测,并使用Bio-Rad图像系统获取蛋白质条带。
1.3 统计学方法 每种实验均重复≥3次,并采用GraphPad Prism 8.0进行统计绘图分析。多组间比较采用单因素方差分析,两组间比较采用t检验,P<0.05为差异具有统计学意义。
2 结果
2.1 FAT10在结直肠癌细胞系中的表达 在mRNA水平上检测了正常结肠上皮细胞NCM460和5个结直肠癌细胞系中FAT10的表达。FAT10 mRNA在这些细胞系中表达不同,在肿瘤细胞中的表达明显高于正常结肠上皮细胞(P<0.01,见图1)。结果表明,FAT10基因在结直肠癌中高表达并且差异具有统计学意义。
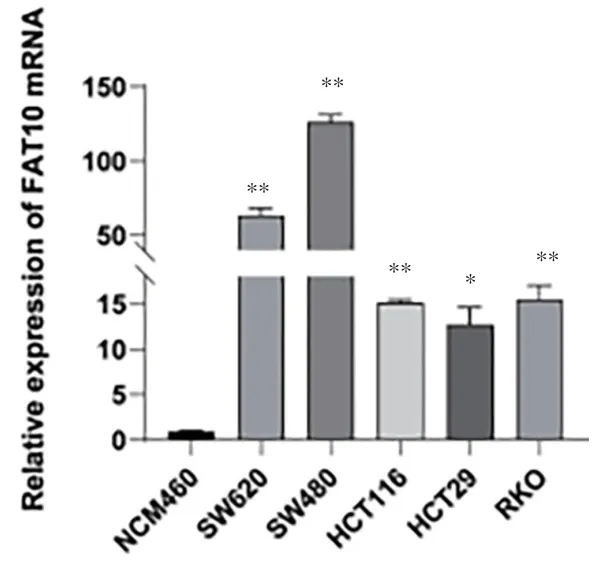
图1 RT-qPCR分析肠上皮细胞和结直肠癌细胞中FAT10 mRNA的表达(注:*P<0.05,**P<0.01)
2.2 Cel对SW480和HCT116细胞增殖的影响 用不同浓度Cel(0、0.625、1.25、2.5、5、10、20 μmol/L)分别作用SW480、HCT116细胞24 h后,相对于对照组的0 μmol/L,随着药物浓度增加细胞活力显著下降(P<0.05,见图2)。根据Cel对SW480和HCT116细胞的毒性影响,当药物浓度>10 μmol/L时,其抑制作用可以到达90%以上。计算IC50各自为3.03、1.63 μmol/L。后续实验的药物剂量根据IC50做参考,SW480选用0、1.25、5 μmol/L而HCT116选用0、1.25、2.5 μmol/L。
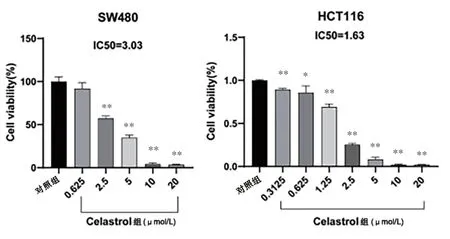
图2 不同浓度的Cel对SW480和HCT116细胞增殖的影响(注:*P<0.05,**P<0.01)
2.3 Cel对SW480和HCT116细胞凋亡的影响 用贝克曼流式细胞仪,检测1.25、5 μmol/L Cel处理SW480和1.25、2.5 μmol/L Cel处理HCT116细胞24 h后的凋亡情况,SW480细胞与对照组的晚期凋亡率5.35%相比,给药组的晚期凋亡率分别为25.2%、75%(P<0.01,见图3A、B),HCT116细胞的凋亡占比也随着Cel浓度的增高而增大(P<0.01,见图3A、C)。说明Cel能显著诱导结直肠癌细胞凋亡。

图3 不同浓度的Cel对SW480和HCT116细胞凋亡的影响(注:*P<0.05,**P<0.01)
2.4 Cel对FAT10表达的影响 有研究发现FAT10在几种癌症中呈高表达,下调其表达可能是一种潜在的癌症治疗手段。因此,在本研究中作者检测了Cel是否对FAT10表达产生影响。以SW480和HCT116细胞为研究对象,RT-qPCR结果表明,与Cel未处理的细胞相比,FAT10 mRNA在Cel处理的细胞中表达下降,而当Cel浓度为1.25 μmol/L时,FAT10 mRNA表达明显降低(P<0.05,见图4A、B)。为了进一步研究Cel是否会对FAT10产生作用,通过Western blot实验,检测其蛋白的表达情况。图4C、D的Western blot条带显示随着药物浓度升高,FAT10条带的灰度值随之下降,说明Cel对FAT10蛋白有抑制作用。这与FAT10 mRNA表达的趋势是一致的。以上研究结果提示Cel可能通过触发FAT10的下调导致的结直肠癌细胞的凋亡。

图4 不同浓度的Cel对FAT10表达的影响(注:*P<0.05,**P<0.01)
3 讨论
研究表明,泛素样修饰剂FAT10直接参与调节癌症的发展途径[9-10]。最近报道,FAT10在胰腺癌中的表达增加与TNM晚期和总生存期降低有关,并通过功能实验表明,下调FAT10的表达可抑制胰腺癌细胞的增殖和上皮-间充质转化,促进胰腺癌细胞凋亡,增强肿瘤化疗的耐药性[11]。此外,FAT10是癌症和炎症研究和治疗的重要靶标,涉及FAT10对炎症诱导的肿瘤发生的潜在作用。由于FAT10与炎症信号通路之间的联系,最终导致肝细胞癌的发展[12]。REN等[13]发现,TNF-α激活NF-κB通路,该通路导致细胞中的FAT10基因表达并导致肿瘤发生。沉默FAT10显著抑制骨肉瘤细胞的侵袭和迁移能力[14]。这些研究强烈表明FAT10可用作肿瘤疾病的预后标志物,并且是潜在的治疗靶点。值得注意的是,FAT10可以通过改变凋亡途径在促生存途径中发挥作用。DONG等[15]报道了FAT10直接结合并稳定Survivin蛋白,从而通过抑制泛素介导的降解来促进癌细胞增殖,揭示了FAT10通过直接稳定膀胱癌中的Survivin蛋白来促进肿瘤增殖的新机制。同时,FAT10在染色体稳定性的调节中发挥作用,FAT10表达的失调将导致G2/M细胞周期阶段控制的失调,从而导致细胞分裂过程中染色体的异常分布,增强癌细胞的存活、增殖及转移[16]。
目前,可以有效治疗CRC的潜在药物正在不断探索中。有文献记载的古代草药的有用性使得药用植物成为药物发现的潜在来源。许多由植物分离物制备的重要化疗药物已被用于治疗各种类型的癌症。因此,草药植物提取物可能是开发抗癌药物的一个有前途的来源。此前已经证明,Cel对多种癌症产生有益作用,表明可能使用其来开发潜在的抗癌治疗方法[17]。在各种肿瘤模型中,Cel已被证明通过抑制细胞增殖、诱导凋亡和抑制血管生成来调节肿瘤生长。CHEN等[18]研究发现Cel对过氧化还原酶-2(PRDX2)的抑制增加了细胞活性氧(ROS)水平,并导致ROS依赖性内质网应激,线粒体功能障碍和胃癌细胞凋亡。LIU等[19]报道了Cel通过神经胶质瘤细胞中的ROS/JNK和AKT/mTOR信号通路介导自噬和凋亡。ZHANG等[20]报道了Cel增强了转录因子EB(TFEB)介导的自噬和溶酶体生物发生,改善了微管相关蛋白tau病理学,表明Cel是治疗阿尔茨海默病有前途的候选药物。此外,Cel可以通过靶向过氧化还原酶-1(PRDX1)抑制结直肠癌细胞的增殖,PRDX1的抑制导致细胞内ROS升高以及细胞周期停滞和凋亡增加[21]。然而,关于Cel在CRC中的潜在抗癌作用及其作用机制仍存在许多尚不明确的问题。先前揭示的靶点和机制表明,Cel通过不同癌细胞中的不同靶点发挥抗肿瘤功效,但是Cel对FAT10表达的影响尚未见报道。因此,本研究旨在评估Cel对CRC的治疗作用,重点是对FAT10的调控。
在本研究中,作者发现Cel对结直肠癌细胞的增殖具有显著的抑制作用,而且还能明显促进结直肠癌细胞的凋亡。值得注意的是,进一步通过RT-qPCR和Western blot检测发现,Cel能够下调FAT10的表达。本研究证实了雷公藤素能够抑制CRC的发展,这可能是通过抑制FAT10基因表达来逆转的。虽然这项研究取得了有价值的结果,但仍存在不足和局限性。本研究结论主要是基于对CRC细胞分子水平的研究,需要更多体内和体外实验相结合来探究FAT10蛋白发挥的独特功能和机制。
总之,本研究证明了FAT10在CRC细胞中的表达水平升高,Cel能够抑制CRC细胞的增殖促进凋亡,其作用的机制可能与下调FAT10表达有关,这是以前在文献中未报道过的。深入探索FAT10与Cel作用之间的关系,了解Cel诱导的CRC细胞凋亡的具体机制,将为开发Cel作为治疗CRC的潜在候选药物提供了新的见解。总之,本研究为FAT10抑制作用对Cel诱导的CRC细胞活性抑制的发生提供了初步证据,并且表明Cel可能作为开发FAT10抑制剂的先导化合物。
