慢性乙型肝炎急性发作期患者肠道菌群的变化
2023-09-19周灏溦陆振华付婷贺真孔祥宇李怡君张维璐邵中军
周灏溦,陆振华,付婷,贺真,孔祥宇,李怡君,张维璐,邵中军*
(1包头医学院公共卫生学院,内蒙古自治区 包头014040;2空军军医大学军事预防医学系军队防疫与流行病学教研室,特殊作业环境危害评估与防治教育部重点实验室,西安710032)
乙型肝炎病毒(hepatitis B virus,HBV)感染引起的慢性乙型肝炎(chronic hepatitis B,CHB)是一个世界性的公共卫生问题[1]。CHB感染者的丙氨酸氨基转移酶(alanine transaminase,ALT)突然升高至正常值上限的10倍以上被称为“慢性乙型肝炎急性发作”。CHB急性发作是乙型肝炎肝病进展的重要原因之一。有研究显示,14%的失代偿期肝硬化是由CHB急性发作导致的。
从早期胚胎学开始,肝脏和肠道就有联系,在生命早期肝脏作为前肠的一个芽孢开始发育[2]。研究表明,肠-肝轴在肝病的病因中起着关键作用,当肠道菌群失调时,过量的毒素会通过肠道血液转移到肝脏,若超过肝脏正常的解毒和代谢能力,则会导致机体免疫系统过度激活,造成免疫反应异常、肝细胞凋亡和坏死以及器官功能的其他改变,从而导致或加剧慢性肝脏疾病。另一方面,肝脏疾病造成的肝脏损伤也会导致胆汁酸产量降低,肠道pH值升高,进而改变肠道定植微生物的内部环境,造成肠道菌群失调[3]。因此,本研究应用16S核糖体核糖核酸(16S ribosomal ribonucleic acid,16S rRNA)扩增子测序技术对CHB急性发作期患者肠道菌群进行分析,探讨肠道菌群对CHB急性发作患者的影响及其作用机制。
1 对象与方法
1.1 研究对象
收集2021年4月至9月在空军军医大学第二附属医院感染科入院治疗的20例CHB急性发作患者的粪便样本作为病例组(CHB组)。根据CHB组的年龄、性别和体质量指数(body mass index,BMI)进行匹配,最终纳入体检科23例健康人群的粪便样本作为对照组。CHB急性发作期的诊断标准为ALT突然升高至正常值上限的10倍以上[4]。排除标准:(1)过去1个月内使用抗生素及益生菌;(2)其他HBV感染导致的肝脏疾病;(3)炎症性肠病、糖尿病及高血压等影响肠道内环境的其他疾病。
1.2 观察指标
通过医院病历检索系统和调查问卷,收集受试者的人口统计学和临床病理学数据。包括姓名、性别及年龄等人口学信息;血清中天冬氨酸氨基转移酶(aspartate aminotransferase,AST)、ALT、总胆红素(total bilirubin,TBIL)、直接胆红素(direct bilirubin,DBIL)、间接胆红素(indirect bilirubin,IBIL)、γ-谷氨酰转肽酶(γ-glutamyl transpeptidase,GGT)、甲胎蛋白(alpha-fetoprotein,AFP)、总蛋白(total protein,TP)、血小板(platelet,PLT)和凝血酶原时间(prothrombin time,PT)等实验室指标。
1.3 粪便样本采集、DNA提取及文库构建
收集受试者入院次日早上6∶30~8∶30自然排出的新鲜粪便标本约3~5g于采集管中,采集后立即在-20℃的冰箱中冻存。低温转运到实验室后,使用天根TIANamp Stool DNA Kit粪便DNA提取试剂盒提取粪便基因组DNA。
1.4 菌群多样性分析
使用R软件(4.1.2版本)“GUniFrac”包对ASVs表格进行抽平处理,随后用“vegan”包对抽平后的ASVs表格进行菌群多样性的计算。α多样性指标由Shannon、Simpson、Ace和Chao1指数进行量化描述。使用R语言中“t.test”函数进行独立样本t检验,分析2组人群在α多样性上的差异,并用R语言中的“ggplot2”软件包绘制2组人群之间的α多样性箱线图。使用R语言中的“ade4”包,基于加权UniFrac距离进行主坐标分析(principal coordinates analysis, PCoA),比较2组人群间的β多样性差异,并采用置换多元方差分析对PCoA结果进行差异分析。
1.5 菌群分类组成分析
使用R语言中“ggplot2”软件包对2组相对丰度前10位的菌门、相对丰度前15位的菌科及相对丰度前20位的菌属进行物种组成柱状图绘制。使用R语言中“t.test”函数进行独立样本t检验,分析2组间门、科和属水平中具有显著差异的关键菌群,并绘制差异性箱线图。
1.6 菌群功能预测分析
使用PICRUST2软件对菌群代谢通路进行预测分析,并使用京都基因和基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)数据库进行代谢通路的注释。同时使用独立样本t检验对2组间所预测到的代谢通路进行比较,并用R语言中的“ggplot2”软件包绘制差异代谢通路柱状图。
1.7 统计学处理
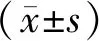
2 结 果
2.1 2组人群基线资料比较
CHB急性发作期患者AFP、ALT、AST、GGT、TBIL、DBIL、IBIL及PT均较对照组显著升高,TP及PLT均较对照组显著降低,差异均有统计学意义(P<0.05;表1)。
表1 2组受试者基线资料比较
2.2 CHB急性发作期患者肠道菌群多样性分析
Shannon(图1A)和Simpson(图1B)指数用于描述菌群的多样性,Ace(图1C)和Chao1(图1D)指数用于描述菌群的丰富度。结果显示CHB急性发作期患者肠道菌群多样性和丰富度均显著低于对照组,差异均有统计学意义(均P<0.001)。
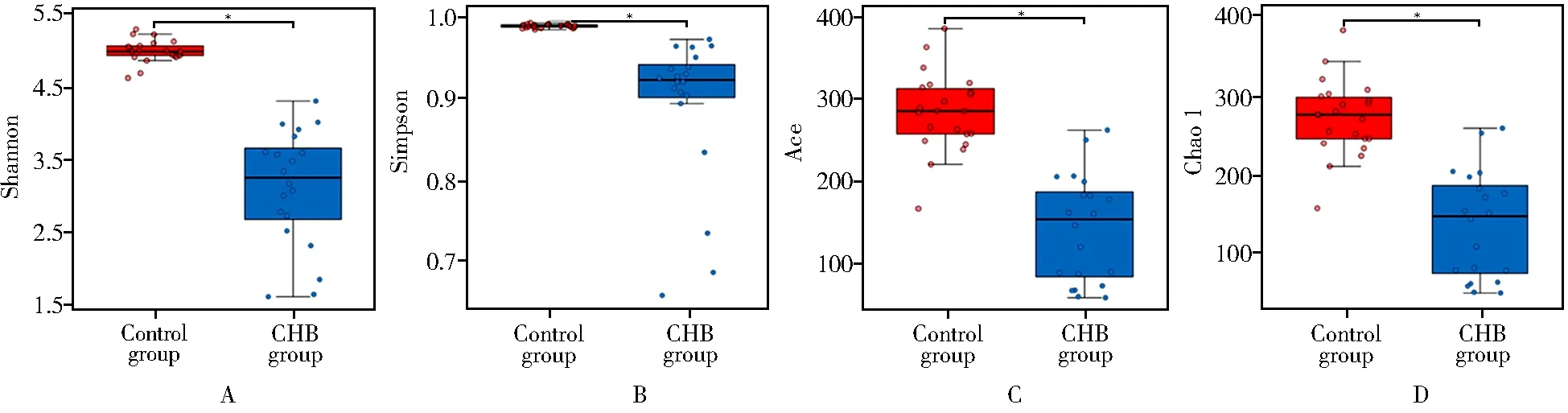
图1 2组肠道菌群α多样性分析
应用基于加权UniFrac距离的PCoA法,对菌群的β多样性进行分析。结果表明CHB急性发作期患者和对照组人群的细菌群落各自聚类(F=4.931,P=0.001;图2)。2组样本间的菌群结构相似度较低,CHB急性发作期患者肠道菌群结构发生了改变。
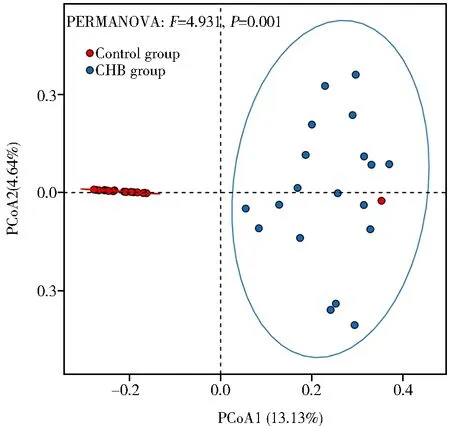
图2 2组肠道菌群β多样性PCoA图
2.3 CHB急性发作期患者肠道菌群分类组成分析
2组患者肠道菌群在门、科和属水平上的物种组成详见图3。拟杆菌门(Bacteroidota)、厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)是2组中检测到的3种主要菌群,占总体的90.86%(图3A)。

图3 2组菌群物种组成柱状图
在门水平上,CHB急性发作期患者菌群中厚壁菌门(Firmicutes)的相对丰度显著低于对照组,放线菌门(Actinobacteria)的相对丰度显著高于对照组,差异均有统计学意义(P<0.05;图4A)。在科水平上,CHB急性发作期患者菌群中紫单胞菌科(Porphyromonadaceae)、理研菌科(Rikenellaceae)、月形单细胞菌科(Selenomonadaceae)和瘤胃球菌科(Ruminococcaceaede)的相对丰度显著低于对照组,链球菌科(Streptococcaceae)的相对丰度显著高于对照组,差异均有统计学意义(P<0.05;图4B)。在属水平上,CHB急性发作期患者菌群中另枝菌属(Alistipes)、类杆菌属(Bacteroides)、布劳特氏菌属(Blautia)、梭状芽胞杆菌属(Clostridium)、小杆菌属(Dialister)、栖粪杆菌属(Faecalibacterium)、芽殖菌属(Gemmiger)、丝状菌属(Kineothrix)、巨单胞菌属(Megamonas)、副拟杆菌属(Parabacteroides)和瘤胃球菌属(Ruminococcus)11个菌属的相对丰度显著低于对照组,普雷沃氏菌属(Prevotella)和韦荣氏球菌属(Veillonella)的相对丰度显著高于对照组,差异均有统计学意义(P<0.05;图4C)。
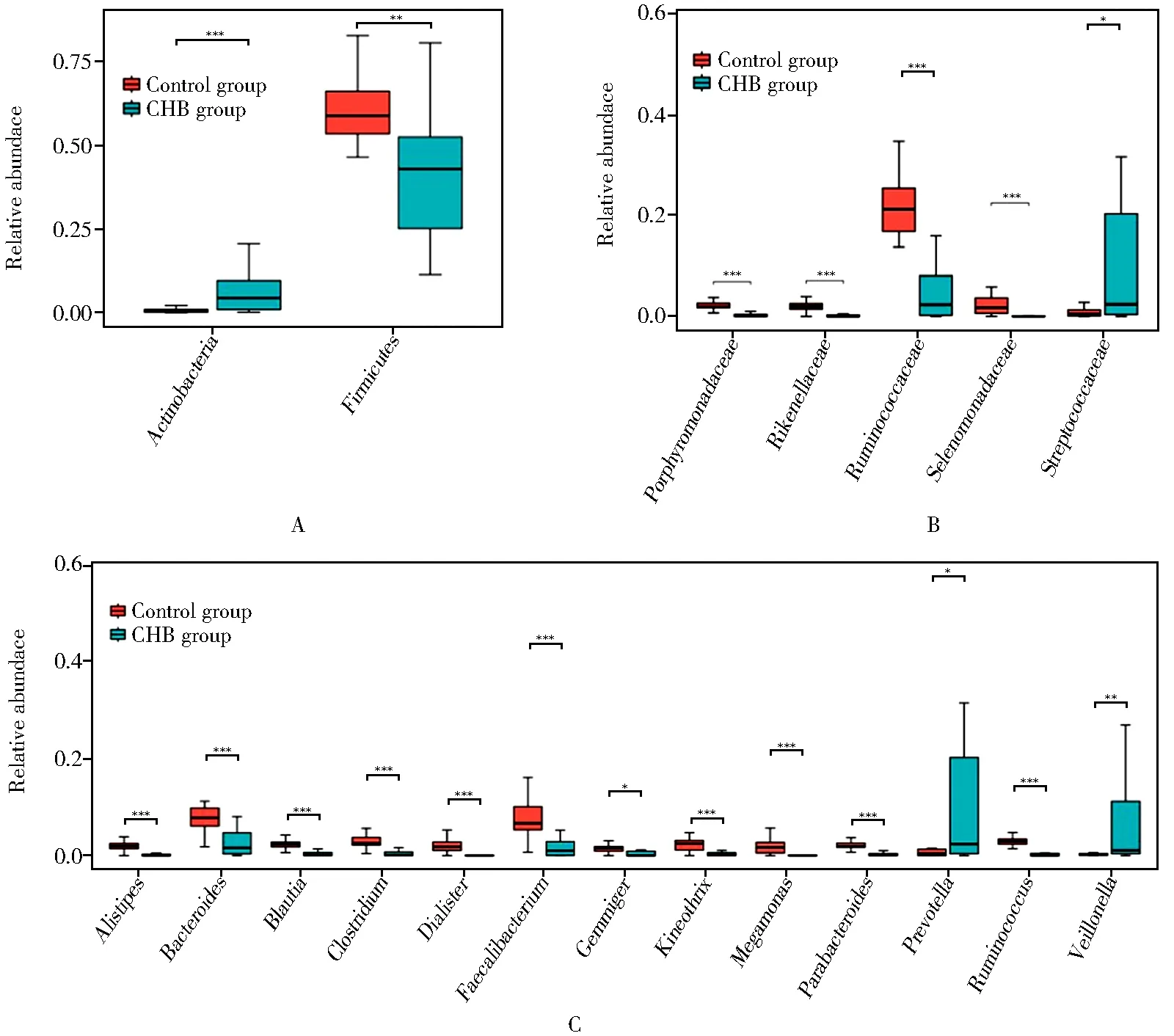
图4 2组肠道菌群差异分析
2.4 CHB急性发作期患者肠道菌群的功能预测分析
使用PICRUST2软件对样本的KEGG数据库进行代谢通路的功能注释分析,结果显示CHB急性发作期患者与聚糖生物合成和代谢以及脂质代谢相关的基因较对照组更丰富(P<0.001;图5)。
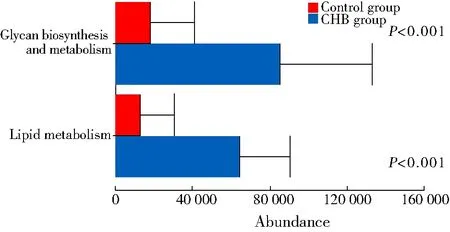
图5 2组肠道菌群功能差异分析
3 讨 论
HBV感染在世界范围内流行,据世界卫生组织报道,全球约有2.57亿慢性HBV感染者,约有88.7万人死于HBV感染的相关性肝脏疾病[5]。CHB急性发作是CHB的一种特殊类型,因其发病急的特点,少数患者会出现急性肝功能衰竭,危及生命[6]。肝脏和肠道之间的联系是密不可分的,二者通过“肠-肝轴”相互作用[7]。已有研究表明,慢性HBV感染的相关性疾病与肠道微生物群的失调密切相关[8]。然而,肠道微生物群与CHB急性发作的关系尚未见报道。本研究利用16S rRNA测序技术对CHB急性发作期患者和健康对照人群肠道菌群的V3~V4区进行分析,对比2组人群肠道微生物群多样性及菌群组成的差异,探讨CHB急性发作期患者肠道菌群的变化规律。
本研究发现,CHB急性发作期患者和健康对照者肠道菌群多样性存在显著差异。α多样性研究结果显示,CHB急性发作期患者的菌群多样性与丰富度均显著低于对照组。此外,β多样性分析结果也表明,CHB急性发作期患者的肠道菌群结构组成与健康对照人群明显不同。提示CHB急性发作期患者的肠道微生态发生紊乱、菌群多样性降低、肠道稳定性被破坏,肠道微生物群的改变或在CHB急性发作中起潜在的致病作用。
本研究发现CHB急性发作期患者的肠道菌群在门、科和属水平的组成上均与健康人群存在显著差异。2组间肠道菌群差异分析结果显示 ,CHB急性发作期患者另枝菌属(Alistipes)及梭状芽胞杆菌属(Clostridium)的相对丰度显著低于对照组。另枝菌属(Alistipes)已被证明可预防肝纤维化、癌症和心血管疾病等[9]。梭状芽孢杆菌(Clostridium)属于肠道菌群中的有益菌,可产生短链脂肪酸,如丙酸、乙酸和丁酸[10]。而短链脂肪酸在人类健康中具有多种功能,可作为肠道细胞营养和能量成分的特定来源,改善上皮屏障功能,降低炎症水平[11]。丁酸盐是肠上皮细胞的主要能量来源,被认为是宿主细胞基因表达、炎症、分化和死亡的重要调节剂,也是细菌能量代谢和肠道健康的关键参与者[12]。因此,产丁酸细菌的减少可能会促进肠上皮细胞的破坏,从而导致肝病的发展。
本研究结果显示,与对照组相比,CHB急性发作期患者菌群内产脂多糖(lipopolysaccharide, LPS)的普雷沃氏菌属(Prevotella)的相对丰度增加。LPS是革兰氏阴性细菌细胞壁中的一种组成成分,也是细菌内毒素的主要成分,LPS增加会引发各种病理反应。高浓度的LPS会破坏肠黏膜功能,诱发全身炎症反应[13]。如上所述,在CHB急性发作期患者中肠黏膜保护细菌的减少和破环细菌的增加,会加重乙型肝炎的发展。
本研究发现,CHB急性发作期患者与聚糖生物合成和代谢以及脂质代谢相关的基因较对照组更丰富。研究表明,聚糖和脂质代谢是肝脏的主要功能,肝脏通过合成糖原和分解糖异生作用来维持血糖浓度的恒定[14]。同时,肝脏也是氧化分解脂肪酸、脂肪和磷脂等脂类物质的重要场所[15]。CHB急性发作期患者的肝组织损伤会导致糖类和脂类合成与代谢活动更加频繁,引起糖脂代谢紊乱诱发的糖尿病及心血管疾病等。
本研究通过分析CHB急性发作期患者的肠道菌群特征,发现其肠道菌群多样性及丰富度均显著低于健康对照者,肠道内有益菌的相对丰度显著低于对照组,而致病菌的相对丰度显著高于对照组。这为临床预防CHB急性发作提供了线索,也为研究CHB患者的预后提供了方向。同时,本研究提供的CHB相关疾病的肠道菌群谱,对于全面理解CHB相关性疾病进程有重要意义。本研究存在以下局限性:研究设计无法评估肠道微生物群和CHB急性发作之间因果关系,后期我们将考虑使用动物模型来确定二者之间的因果关系。
