CRISPR‑Cas9系统在肿瘤生物学中的应用及前景
2023-09-16马孟丹尚梦宇刘宇辰
马孟丹,尚梦宇,刘宇辰
(1 深圳大学第一附属医院,深圳市第二人民医院,深圳转化医学研究院,广东 深圳 518035; 2 广东省泌尿生殖肿瘤系统生物学与合成生物学重点实验室,广东 深圳 518035; 3 汕头大学医学院,广东 汕头 515041; 4 深圳大学医学部基础医学院,广东 深圳 518060)

CRISPR‑Cas 系统是生物体内一种RNA 引导的适应性免疫系统,利用RNA 来引导Cas 蛋白对目标基因结合并剪切。已经发现了多种天然存在的CRISPR‑Cas 系统,其中2 类系统只需要引导RNA及Cas蛋白即可完成对靶点的切割,其中最早发现的Cas9 是目前最广泛使用的Cas 效应子,此外还有可以靶向DNA 的Cas12 和靶向RNA 的Cas13。由RNA 引导的核酸酶系统的可编程性大大增加了它的功能和使用场景,通过对Cas蛋白进行修饰改造,CRISPR 系统除用于基因剪切外还可在转录水平、蛋白质翻译水平进行调控,基因组成像,单/多碱基编辑以及甲基化、乙酰化等表观遗传水平的修饰(图1),这些功能在疾病治疗的研究与临床应用中极具潜力。CRISPR‑Cas 系统被称为革命性的“基因剪刀”技术,为癌症研究和治疗带来了新的曙光[1],该系统已被研究人员用于研究癌症发生机制、发现耐药相关基因,并开展与细胞信号通路、细胞功能基因组学、药物研发、预测细胞对药物的反应,以及癌症治疗等相关工作。
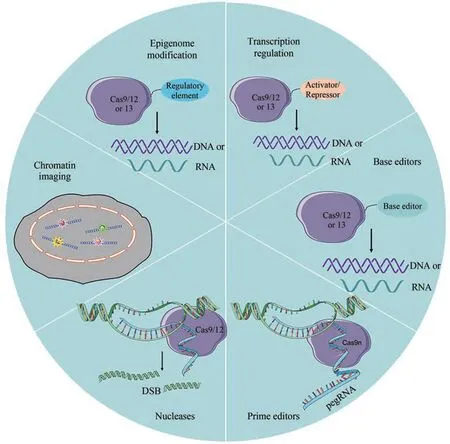
图1 CRISPR‑Cas系统衍生工具的应用Fig. 1 Application of CRISPR‑Cas system derivatives
为了解决现有的临床问题,许多研究使用CRISPR 技术建立细胞、类器官和动物癌症模型[2‑3],探索肿瘤发生发展的分子机制,筛选耐药细胞株[4‑5]以及全基因组筛选肿瘤耐药相关基因。该技术可高特异性地筛选靶向药物,从而提高基因治疗和免疫细胞治疗对癌症患者的疗效[6‑12]。本文将着重介绍CRISPR‑Cas9系统及其衍生工具在肿瘤生物学基础研究和临床应用中的研究现状及潜力。
1 基础研究
通过基因测序和全基因组筛选,识别癌症患者中常见的突变基因,利用CRISPR‑Cas 技术进行基因敲除、敲入、激活或抑制来模拟肿瘤基因突变,有助于我们快速、准确地建立相关的细胞或动物模型,用于研究遗传决定因素和肿瘤发展的潜在机制。
1.1 疾病模型构建
1.1.1 细胞模型
细胞模型具有较短的实验周期和清晰的背景,并且易于提供结果。成神经细胞瘤是一种在儿童中发病率较高的神经内分泌肿瘤,George 等[13]为了研究成神经细胞瘤的不良预后与ATRX突变的关系,利用CRISPR‑Cas9 技术,通过同源基因靶向,生成具有ATRX突变的成神经细胞瘤细胞系,并利用这些细胞模型设计了可能用于治疗成神经细胞瘤的创新方法。骨肉瘤是最常见的骨原发性恶性肿瘤,现有化疗药物预后较差[14],开发新的治疗策略来改善治疗效果和提高患者生存率十分重要。研究人员采用CRISPR‑Cas9 技术实现敲除骨肉瘤细胞系KHOS 和U‑2OS 中CDK11基因表达,细胞增殖和侵袭能力显著减弱[15]。从而证明CRISPR‑Cas9 靶向敲除CDK11基因为一种骨肉瘤的潜在治疗方案。根据不同的研究目的,利用CRISPR‑Cas9技术在编辑肿瘤细胞模型上对肿瘤细胞采取不同的编辑策略,通过建立新的肿瘤细胞模型,阐明发病机制,探讨药物作用机制,检验体外治疗效果。
1.1.2 类器官模型
类器官是一种利用成体干细胞或组织中衍生的、在体外培育而成、具备三维结构的微器官,可以发展成类似于完整器官体内解剖和生理的结构。类器官培养提供了研究人类发育和疾病发生过程的潜力[16]。
脑瘤是最致命和最具破坏性的癌症之一,但由于基因异质性和缺乏模型,脑瘤的研究一直受到阻碍[17]。Bian团队[18]建立了一种新的脑肿瘤类器官(neoCOR)模型,在该模型中,利用转座子和CRISPR‑Cas9 技术将致癌突变引入类器官,再现了脑肿瘤的发展过程。该模型的建立补充了目前脑肿瘤生物学中的基础和临床前研究模型。此外,为了探索乳腺癌的病因,Dekker 等[19]利用Cas9 敲除乳腺祖细胞中P53、Pten、RB1和NF1四个乳腺癌相关基因。随后,将突变后的肿瘤类器官移植到小鼠体内,发现这些突变的乳腺类器官获得了可以被长期培养的能力,形成雌激素受体阳性的腔内肿瘤,并对化疗药物敏感。这些具有肿瘤特征的类器官模型的开发为肿瘤生物学的进一步研究提供了一种新的途径。
1.1.3 动物模型
动物模型可以反映肿瘤生长情况,更方便、快速地检测潜在的肿瘤和转移相关基因,探索肿瘤免疫逃逸、耐药等机制,成为临床前药物试验的主要工具。除了利用CRISPR‑Cas 实现胚系突变外,也将构建好的质粒原位导入动物体内诱导产生原位肿瘤模型[20]。Yang等[21]通过在小鼠受精卵中共注射Cas9 mRNA 和不同sgRNA,生成了在Nanog、Sox2和Oct4基因中携带标签或荧光报告结构的小鼠模型以及Mecp2条件突变小鼠。Xue等[22]在野生型小鼠体内使用流体动力注射将表达Cas9 和sgRNA 的质粒递送到肝脏,直接靶向肿瘤抑制基因Pten和P53诱导肝肿瘤,为肝癌模型和功能基因组学的快速发展提供了新的途径。研究已经发现了多种癌症相关的突变基因,但由于患者之间存在个体差异,研究它们如何影响体内肿瘤的生长和扩散仍是一个挑战。建立能够稳定维持肿瘤细胞特性的动物模型,有利于进一步研究肿瘤生长微环境,探索基因突变机制,并在此基础上筛选或研发靶向药物。
1.2 肿瘤机制研究
利用CRISPR‑Cas 技术可研究肿瘤发生机制,如单核苷酸突变、染色体异位事件和其他因素在肿瘤发展中的作用;此外,它还可用于肿瘤细胞中功能基因的筛选。这些基因关联与肿瘤发生过程中发生的基因功能变化相对应,从而有助于研究疾病机制[23]。
大量研究表明,在良性肿瘤中,血管生成罕见,血管生长缓慢;相反,大多数恶性肿瘤表现出致密的血管生成和快速的血管生长[24]。因此,血管生成在肿瘤的发展和转移过程中起着重要作用,抑制这一过程将显著阻止肿瘤组织的发展、扩散和转移。抗血管生成疗法(ATT)已经成功地用于抑制肿瘤的异常血管生成,然而,恶性肿瘤往往表现出对ATT 的耐药,CRISPR‑Cas9 技术用于研究肿瘤血管生成的机制和耐药的可能原因[25‑26]。He 等[26]使用基于三维微载体的细胞培养和CRISPR‑Cas9 进行混合遗传筛选,揭示了血液内皮细胞(EC)对广泛使用的AAT 贝伐单抗耐药反应的分子修饰机制。ARID1A 突变是人类癌症中最常见的分子畸变之一,但其致癌机制尚不清楚。Lo 等[27]在TP53‑/‑的人胃器官中建立了ARID1A 敲除的缺陷模型,这些工程化的ARID1A缺陷器官反映了ARID1A突变型胃癌的临床病理特征,结合基于调控网络的分析和高通量药物筛选,发现了ARID1A在胃上皮癌发生中的潜在机制。
CRISPR 衍生物也在癌症研究中发挥了重要作用。当失活的Cas9(dCas9)蛋白与转录激活物或抑制蛋白结构域融合后,其随后与sgRNA 序列结合靶向基因的上游调控区域,使得转录调控复合体能够有效地控制基因的表达水平,进而探索其功能。构建靶向全基因组gRNA 文库,利用dCas9与转录激活蛋白的协同活性上调全基因组表达,可用于高通量、快速的功能获取筛选。单碱基编辑器,主要包括胞嘧啶碱基编辑器(CBE)和腺嘌呤碱基编辑器(ABE),其用于产生多个DNA损伤响应基因的单核苷酸突变,导致细胞在DNA 损伤发生时发生适应性变化,以筛选和识别DNA 损伤响应[28]。
2 肿瘤治疗
癌症是一种基因组疾病,其特征是整体基因组不稳定、大量积累的点突变和肿瘤进展中的结构变化。这些基因组突变可能产生肿瘤抗原,这些抗原可能被免疫系统识别为非自身抗原,从而引发细胞免疫反应。因此,免疫系统在免疫监测中起着至关重要的作用,来自适应性免疫系统和先天免疫系统的免疫细胞渗透到肿瘤微环境(TME)中,帮助调节肿瘤的发展[29]。免疫细胞疗法在治疗癌症方面表现出了优异的疗效,多种免疫细胞疗法在临床试验中得到了成功的验证[30]。CRISPR‑Cas 系统作为一种新兴的基因编辑技术,用于靶向敲除肿瘤免疫检查点分子或进行快速简单的基因编辑,大大降低了肿瘤免疫治疗的操作难度,促进了该领域研究的发展。
2.1 免疫治疗
2.1.1 过继细胞转移疗法(ACT)
ACT 用于从肿瘤患者体内分离免疫活性细胞,扩增后在体外确定它们的功能,并将其送回患者体内,直接杀死肿瘤或激发免疫反应,最终杀死肿瘤细胞[31]。最广泛使用的ACT 技术包括嵌合抗原受体(CAR)T细胞治疗和使用CRISPR‑Cas9技术设计的T 细胞受体(TCR)T 细胞治疗[32‑33]。该技术是最成熟和广泛应用的免疫细胞治疗,在体内和体外均显示出良好的靶向性[34]。
CAR‑T 细胞疗法通过识别膜表面抗原工作,对血液肿瘤非常有效[35]。放疗联合CAR‑T 细胞治疗可提高治疗效果[32]。许多临床试验已经或正在进行中,以解决CAR‑T 细胞在血液系统恶性肿瘤或实体瘤患者中的安全性、可行性和有效性。CAR‑T 细胞治疗已被证明对血液瘤有效,因为血液瘤细胞有一个独特靶点CD19,可用来引导CAR‑T 细胞发现并摧毁癌细胞[36]。Zhang 等[37]利用非病毒系统CRISPR‑Cas9 对整合位点进行切割产生双链断裂(DSB),通过HDR 对其进行修复,HDR 以包含CAR 序列的外源DNA 供体为模板,该供体上有匹配整合位点上下游的序列,因此,HDR 修复断裂DNA 的同时会将CAR 序列定点整合进T 细胞基因组。利用Cas9 同源定向修复技术精准敲除PD1,首次生成非病毒、基因特异性靶向CAR‑T 细胞,并在临床试验表明以这种方式生成的CAR‑T 细胞是安全的,在接受治疗患者中未观察到CAR‑T 治疗相关的神经毒性和2 级以上的细胞因子释放综合征。此外,这种新型CAR‑T 疗法在难治性复发性淋巴瘤患者中显示出卓越的治疗效果,完全缓解率为87.5%,客观缓解率高达100%。
CAR‑T 对实体瘤的作用低于血液恶性肿瘤,Larson 等[38]通过CRISPR 全基因组筛选发现,在GBM 中,γ‑干扰素受体(IFN‑γR)信号通路是CAR‑T 细胞充分黏附所必需的,该基因的缺失将导致肿瘤细胞对CAR‑T 细胞的杀伤更具耐药性,为CAR‑T 治疗实体瘤提供新的方法。目前,自体CAR‑T 治疗已取得了临床和商业上的成功。开发更多靶点是使患者受益,扩大其应用价值的重要策略之一。此外,通用CAR‑T 治疗是CAR‑T 未来的一个重要方向,这些领先的技术更多地转化为产品,将为患者提供更广泛的治疗选择[39]。
同样,TCR‑T 疗法在黑色素瘤和滑膜肉瘤的临床试验中取得了重大突破,在治疗其他晚期实体瘤方面也取得了初步疗效[40]。Stadtmauer 等[41]使用CRISPR‑Cas9 敲除了T 细胞中的3 个基因,分别是:T 细胞受体α(TCRα)基因和T 细胞受体β(TCRβ)基因,这两个基因编码内源性TCR 链;PDCD1,一个基因编码细胞死亡蛋白1(PD‑1)的基因。并插入了一种癌症特异性TCR转基因NYESO-1。因此,修饰后的T 细胞被命名为NYCE(NY‑ESO‑1transduced CRISPR 3X edited cells)。最终,经过4 轮编辑后,T 细胞被注射回病人体内并保持长达9个月的修饰。结果表明这种方法免疫原性较低,并证明了CRISPR 基因编辑在癌症免疫治疗方面应用的可行性。我们相信,将TCR 转移和基因组编辑技术相结合,有望开发出更有效、更安全的癌症免疫疗法。
2.1.2 抗肿瘤抗体的导向治疗
抗肿瘤抗体的导向治疗是以抗肿瘤抗体为载体,结合具有细胞毒作用的物质,通过载体与肿瘤相关抗原的免疫蛋白结合,提高肿瘤内药物浓度的一种治疗方法。免疫检查点分子是调节免疫反应激活与抑制之间平衡的关键因子。癌细胞通常通过上调免疫检查点分子来逃避免疫监视,因此,阻断这一过程可以显著增强抗肿瘤免疫反应。PD‑1 和细胞毒性T 淋巴细胞相关蛋白4(CTLA‑4)是众所周知的免疫检查点,可以显著抑制T细胞的活性,从而使肿瘤细胞容易逃离机体的免疫机制,这导致T 细胞治疗效果不佳[42]。通过使用CRISPR‑Cas9基因编辑技术敲除参与免疫负调节的基因,也可以实现抗肿瘤免疫应答。例如,使用靶向基因编辑技术敲除免疫检查点是提高CAR‑T治疗实体肿瘤疗效的一种很有前途的策略[42]。此外,Lu 等[43]在CRISPR‑Cas9 基因编辑T 细胞治疗晚期非小细胞肺癌患者的首个人类Ⅰ期临床试验中证明了这种靶向免疫治疗在临床上是可行的。同样,Si 等[44]对造血祖细胞激酶1(HPK1)在调节T细胞功能障碍中的作用及其相关机制进行综合研究中发现,在多种血液和实体瘤小鼠模型中,以嵌合介导的HPK1降解为靶点的基因缺失、药物抑制或蛋白水解增强了CAR‑T 细胞为基础的免疫治疗的疗效。HPK1 是改善免疫治疗的一个有吸引力的药物靶点。CRISPR‑Cas9 技术制备的CD‑19 HPK1KOCAR‑T 细胞已用于临床试验,这是世界上第二次通过基因编辑技术改善T细胞功能的临床探索的一部分。
2.2 靶向致癌病毒感染
CRISPR‑Cas9系统在细菌适应性免疫中具有抗病毒作用,因此其在防御和清除受感染病毒方面具有巨大潜力,使用可特异性识别病毒基因组的Cas9‑sgRNA,直接靶向致癌病毒基因或维持病毒复制所需的基因,导致病毒基因组发生突变并抑制致癌病毒基因表达,从而诱导癌细胞死亡。人乳头瘤病毒(HPV)是宫颈癌发生的主要原因,HPV 致癌基因尤其是E7 是预防和治疗的关键靶点,研究人员使用由非病毒载体PBAE546 和靶向HPV16 E7 的CRISPR‑Cas9 重组质粒组成的纳米颗粒(NP),治疗HPV 感染和相关宫颈恶性肿瘤。结果表明NP 在裸鼠中显著抑制源自宫颈癌细胞系的异种移植瘤的生长,并显著逆转HPV16 转基因小鼠的宫颈上皮恶性表型[45]。
除HPV 外,慢性乙型肝炎病毒(HBV)感染则是肝细胞癌(HCC)最常见的危险因素。HBV表面抗原(HBsAg)高表达水平与肝癌发生和HBV 相关HCC 发展高度相关。研究人员设计了靶向HBV 基因组开放阅读框preS1/preS2/S 的特异性单导RNA(sgRNAs),并使用CRISPR‑Cas9 系统建立HBsAg 敲除HCC 细胞系。结果表明敲除HCC细胞系中的HBsAg 降低了HBsAg 的表达,并显著减弱了HCC的体外增殖和体内致瘤性[46]。然而,尽管这一策略可有效控制和清除致癌病毒,但除了CRISPR‑Cas9基因编辑技术的递送载体限制外,病毒靶点的高度变异性也对这些治疗方法提出了挑战。
2.3 基因治疗
在体外改造T 细胞疗法之外,使用CRISPR 基因编辑直接靶向驱动癌症的变异基因是一个吸引人但非常困难的挑战。理论上,通过CRISPR 基因编辑直接纠正驱动癌症的基因变异,或者杀死产生特定基因变异的癌细胞,可以达到抑制肿瘤生长的效果。然而,这一策略需要克服多重障碍,包括完成肿瘤特异性疗法递送,以及需要达到高效率的基因编辑。
目前的临床前研究已经发现一些肿瘤特异性基因编辑的策略。基因线路是合成生物学中的重要部分,由各种调控元件(包括特异性的启动子、增强子、逻辑门等元件)和被调控的基因组合而成的遗传装置,通过构建基因线路使细胞在特定情况下调节信号通路。目前常用的CRISPR 控制系统包括光学基因开关进行信号转导调节转基因活性[47]、基于蛋白质的信号传感器[48]以及RNA 信号传感器--核糖开关,由RNA 顺式调节模块组成,通过感测细胞内特定的小信号分子来操纵目标基因的表达。已经通过整合适体进行了广泛的工程化,适体通过配体与适体结合时产生的变化触发“开”或“关”信号。受核糖开关和反义RNA 调节装置的启发,在sgRNA 中引入核糖开关模块,它的5'端也包含一个反义RNA 区域。整合核糖开关特性的sgRNA允许整个CRISPR系统获得感知相关配体的能力,以调节CRISPR 系统的“开‑关”。
Liu 等[49]创建了基于CRISPR‑Cas9 的信号传导体,以响应外部或内部感兴趣的信号,调节内源性基因的转录。在缺乏特异性信号的情况下,原sgRNA 的引导区与设计的反义茎配对,不能与目标DNA 结合,一个特定的外源小分子或者内源蛋白质信号可以结合到适体,诱导构象改变,允许sgRNA 的间隔序列去结合对应的DNA 序列而影响另一个信号的转录。这些装置可以用来构造所有基本类型的布尔逻辑门,在哺乳动物细胞中执行逻辑信号操作,而不需要多层的遗传线路;还可以通过构建连接不同信号通路的合成链接来重新连接细胞信号。此外,这种方法可以通过控制同时的双向(ON‑OFF)基因转录来重定向致癌信号转导,从而实现癌细胞命运的重编程。
Liu 等[50]将人端粒酶逆转录酶(hTERT)启动子和人uroplakinⅡ基因的膀胱特异性启动子(hUPⅡ)结合(图2),该基因线路需要两个启动子,当且仅当两个启动子同时作用时,目的基因才能进行表达,为定向治疗癌细胞提供了高效且具有针对性的方案。经过进一步优化,UPⅡ和TERT 启动子被它们各自的转录因子结合元件所取代(图3)。C‑Myc 和Get1 仅在膀胱癌细胞中同时有较高水平的表达。在sgRNA1 和sgRNA2 的初始表达后,它们可以进一步结合各自转录起始点的上游,通过正反馈机制分别扩增c‑Myc 和Get1 的转录信号,从而扩增其下游基因的转录,与传统的基因线路相比,微基因线路显示出更高的癌症识别和干预能力,可用于一体化AAV 载体的体内癌症基因治疗[51]。
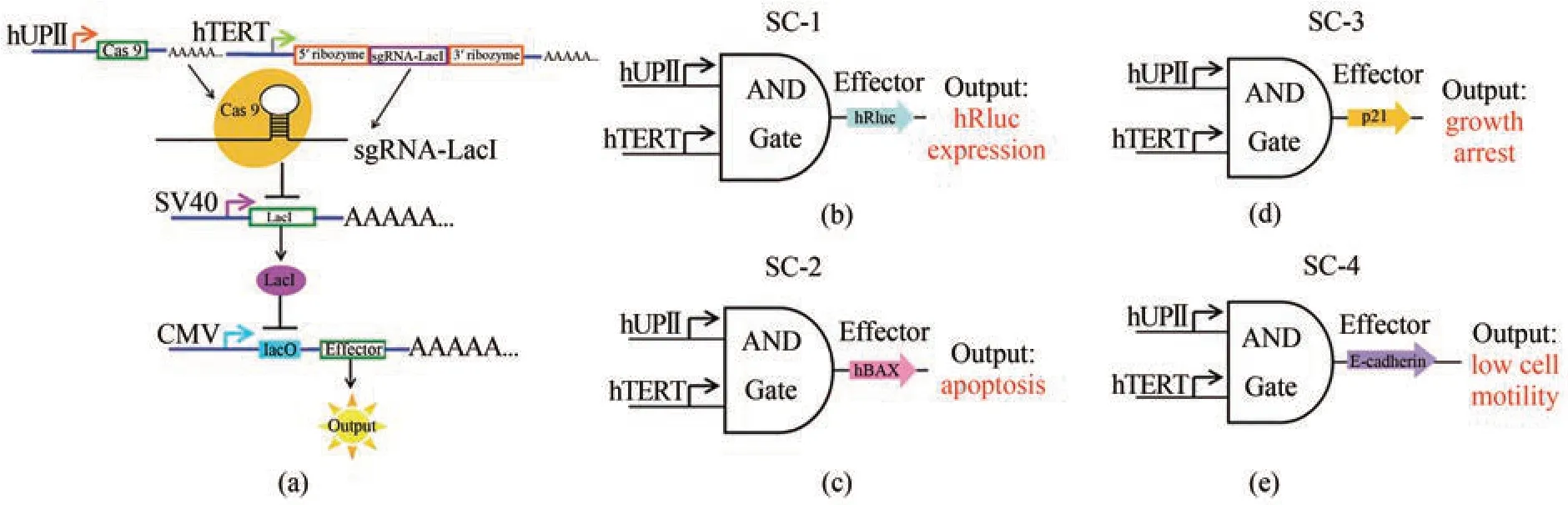
图2 与门遗传电路的设计与构建[50](a)hUPⅡ和hTERT 启动子是线路的输入端。hUPⅡ启动子驱动Cas9 mRNA 的转录,hTERT 启动子连接靶向LacI 的sgRNA 的转录。输出基因由LacI控制的CMV 启动子驱动。效应子只有在Cas9蛋白和sgRNA 同时存在时才能表达。(b)~(e)是合成线路(SC‑1,SC‑2,SC‑3和SC‑4)的示意图。输出基因分别为hRluc、hBAX、p21和E-cadherinFig. 2 Design and construction of the AND gate genetic circuits[50](a) The hUPⅡ and hTERT promoters are the inputs to the circuit. The hUPⅡ promoter drives the transcription of Cas9 mRNA and the hTERT promoter is linked to the transcription of sgRNA targeting LacI. The output gene is driven by a LacI‑controlled CMV promoter. The effector can be expressed only when both Cas9 protein and sgRNA are presented. (b)~(e) are schematic representations of the synthetic circuits (SC‑1, SC‑2, SC‑3 and SC‑4). The output genes were hRluc, hBAX, p21 and E-cadherin.

图3 与门微型基因线路的设计与构建[51]UPⅡ启动子驱动了Cas9 mRNA的转录,而TERT启动子被用来促进以LacI为目标的sgRNA的转录。输出的Renilla荧光素酶基因由LacI控制的CMV启动子调节。仅在UPⅡ启动子和TERT启动子都被激活时,荧光素酶基因才被表达。在迷你基因线路的设计中,UPⅡ和hTERT启动子被各自的转录因子结合元件所取代,c‑Myc和Get1仅在膀胱癌细胞中同时有较高的表达水平。sgRNA1和sgRNA2初始表达后,进一步结合自身转录起始位点上游,通过正反馈机制扩增c‑Myc和Get1的转录信号,分别扩增其下游基因的转录,此外,LacI基因被sgRNA2敲除,荧光素酶报告基因被转录激活。而在正常膀胱上皮细胞中,荧光素酶不能有效转录,并被背景水平表达的微量LacI进一步沉默Fig. 3 Design and construction of the AND gate minigene circuits[51]The UPⅡ promoter drove the transcription of Cas9 mRNA, while the hTERT promoter was used to promote the transcription of sgRNA targeting LacI. The output Renilla luciferase gene was regulated by a LacI‑controlled CMV promoter. The luciferase was expressed only when both UPⅡpromoter and TERT promoter were both activated. In the design of the minigene circuit, the UPⅡ and hTERT promoters were replaced by their respective transcription factor binding elements. Both c‑Myc and Get1, only in bladder cancer cells, had a relative high expression level at the same time. After initial expression of sgRNA1 and sgRNA2, they could further bind upstream of their own transcription initiation sites and then amplify the transcription signals of c‑Myc and Get1 through the positive feedback mechanism to amplify their corresponding downstream genes transcription,respectively. Furthermore, the LacI gene was knocked out by sgRNA2, and luciferase reporter gene was activated by transcription. In normal bladder epithelial cells, luciferase could not be effectively transcribed and was further silenced by trace amounts of LacI expressed at the background level
目前,用于基因治疗的CRISPR 技术大多基于产生DSB,诱导细胞DNA 修复途径,从而导致靶位点序列的改变。而大多数疾病都是由点突变引起的。因此,有必要开发针对特定点突变位点的工具。目前,现有的单碱基编辑技术包括CBE 和ABE[52‑55],先导编辑可以通过编辑sgRNA 为pegRNA 并在DSB 引入模板来进行精确的基因编辑,包括长片段的替换、插入和删除[56‑57],在遗传疾病的研究和治疗方面的应用非常广泛[58]。
CRISPR‑Cas9将有助于肿瘤细胞中新致癌基因的发现及验证其在肿瘤发生和转移中的关键作用,从而为肿瘤的治疗提供新的靶点,为肿瘤基因治疗提供了新思路。总的来说,基因治疗仍处于临床前探索阶段,其安全性、持久性和有效性的衡量标准有待进一步加强和完善。目前的监管模式需要大量的研究来确定其安全性和有效性,这不适用于处理在单个患者或极少数患者中发现的突变。理想方法是创造一种单一的组合物,可以治疗更多的患者群体。在不久的将来,在转向个性化疗法中,细胞和基因治疗领域的创新将面临独特的挑战。对核酸递送、免疫系统调节和人类基因组的精确操纵也将达到前所未有的控制水平。与此同时,这种技术激发了全新的研究领域,如合成生物学、细胞重编程和高通量功能基因组学,这些领域无疑将继续重塑生物医学研究的面貌。
3 肿瘤疫苗
与靶向免疫检查点的肿瘤免疫治疗不同,肿瘤疫苗利用抗原‑抗体反应[59],主要分为预防性和治疗性疫苗。预防性疫苗通过预防和杀死某些病毒或细菌感染来预防癌症,而治疗性疫苗通过癌细胞抗原激活机体的特定免疫功能来控制或杀死肿瘤细胞。细胞癌变后产生的肿瘤抗原可作为适应性免疫应答的靶点,这是制备肿瘤疫苗的基础;此外,测序突变基因和获得新抗原有助于制备个体化癌症疫苗[60‑61]。个体化癌症疫苗Neo Vax 在黑色素瘤患者的临床试验中表现出了优异的效果,并产生了持久的免疫反应[62]。与免疫检查点抑制剂或其他癌症疗法一起,这些个性化癌症疫苗可能具有较高的临床疗效[63]。Ravindranathan 等[64]利用CRISPR‑Cas9 技术筛选影响乳腺癌细胞免疫原性的细胞因子,增强自体肿瘤疫苗的有效性。Guo 等[65]发现STEAP1 在人鼠前列腺癌中均高表达,据此构建了一种融合蛋白疫苗,在体内抑制肿瘤生长,改善肿瘤微环境。当使用CRISPR‑Cas9敲除抗原靶点时,对前列腺癌的免疫反应被大大抑制。
除此之外,利用CRISPR 改造免疫系统自身产生抗体的B细胞,以便在感染的情况下按要求大量表达针对这些难治性病毒的抗体。研究人员成功对人类和小鼠B细胞进行基因修饰来表达靶向致癌病毒,如呼吸道合胞病毒(RSV)、艾滋病毒(HIV)、流感病毒和Epstein‑Barr 病毒(EBV),将编码抗体的DNA 插入到原代人B 细胞的抗体编码基因上产生的小切口中,使得新抗体蛋白的表达受到这些细胞自身启动子的调节,从而允许这些细胞能够像正常特异性免疫B细胞那样在经受病毒抗原触发后产生新抗体蛋白,Moffett等[66]证实这些经过基因改造的B 细胞在小鼠感染模型中阻止RSV 感染。将CRISPR 技术应用于肿瘤疫苗的开发,是一种全新的尝试,同时,也为肿瘤疫苗的探索提供了更加广阔的发展空间。
4 文库筛选作用靶点
CRISPR 技术还可以加速癌症治疗靶点基因的发现,使用靶向基因组中不同基因的引导RNA 文库,可以系统性地敲除细胞系或类器官中的任何基因,然后观察基因敲除对癌细胞生长或药物反应的影响,系统地研究癌症的发生、发展和代谢依赖性,以确定潜在的治疗途径[67‑68]。将特定抗癌药物的药敏与细胞系全基因组CRISPR 功能缺失筛查结合起来,研究支持药物敏感性的细胞通路,这些蛋白‑蛋白网络的识别有助于药物的开发[69‑70]。根据肿瘤细胞的耐药机制,已经发现了多种药物组合[4,71‑72],如在转移性前列腺癌(PC)中存在有害的共济失调性毛细血管扩张突变(ataxia telangiectasia‑mutated,ATM)缺陷时,PARP 抑制对该亚群具有抗肿瘤活性,但只有部分ATM 缺陷对PC 有反应。Neeb 等[72]利用CRISPR‑Cas9 修饰体外细胞系模型来破坏ATM功能,并用于药物敏感性和功能分析,然后在患者衍生模型中进行验证,发现聚腺苷二磷酸核糖聚合酶PARP和ATR联合抑制对上述模型具有良好的抗肿瘤活性。
Ouyang 等[73]利用CRISPR 敲除(GeCKO)文库筛选了卵巢癌细胞系中与顺铂耐药相关的新基因。研究中筛选了6个候选基因,包括一个先前验证的基因SULF1和5 个新基因ZNF587B、TADA1、SEMA4G、POTEC和USP17L20。经验证,发现两个基因(ZNF587B和SULF1)与顺铂耐药有关,其中ZNF587B可能是预测顺铂耐药的一种新的生物标志物。
二甲双胍是目前治疗多种癌症的强有力的候选抗肿瘤药物,然而,其抗肿瘤效果在不同的癌症或亚人群中存在差异,这可能是由于肿瘤的异质性。为了探究哪些肝细胞癌(HCC)患者亚群可以从二甲双胍治疗中获益,Feng 等[74]通过全基因组CRISPR‑Cas9 敲除筛选,发现DOCK1 水平可以决定二甲双胍的抗肿瘤作用,DOCK1 是二甲双胍在HCC 中的一个合成致死靶点。机制上,二甲双胍促进DOCK1 磷酸化,DOCK1 磷酸化激活RAC1 促进细胞生存,导致二甲双胍耐药。DOCK1选择性抑制剂TBOPP可增强二甲双胍在肝癌细胞株和患者源性肝癌类器官中的体外抗肿瘤活性,以及在体内异种移植肝癌细胞和具有免疫能力的小鼠肝癌模型中的抗肿瘤活性,二甲双胍可以改善DOCK1低水平HCC患者的总生存率,但对DOCK1 高表达的患者没有改善作用。二甲双胍的疗效取决于DOCK1 水平,二甲双胍联合DOCK1 抑制可能为二甲双胍耐药提供一种有前途的个体化治疗策略。
为了鉴定调控小鼠乳腺上皮细胞密度依赖性增殖的基因,研究人员建立了一种基于荧光泛素细胞周期标志物的荧光激活细胞分选方法,该方法以不同的荧光团标记细胞周期的不同阶段。接着,Fomicheva 等[75]在4000 万个上皮细胞中进行了CRISPR‑Cas9 全基因组敲除筛选,并通过选择那些在低密度下正常增殖但在高密度下继续分裂的细胞,首次发现了TRAF3与癌症的发生发展相关,TRAF3的缺失会激活增殖信号通路,进而推动细胞的分裂。
转移是造成癌症治疗困难的主要因素之一,与癌症预后不良有关。在最近的一项研究中,通过CRISPR 激活(CRISPRa)对编码细胞表面蛋白的基因进行筛选,以识别增强癌细胞转移能力的细胞表面分子,Van Der Weyden 等[76]发现,LRRN4CL基因的过度表达增加了小鼠和人类黑色素瘤细胞向肺部转移的能力。他们还测试了结肠癌、乳腺癌和膀胱癌的细胞模型,并证实了在所有转移至肺部的细胞中LRRN4CL的高表达。这是第一次发现LRRN4CL与癌症有关。此外,研究结果表明,降低LRRN4CL的表达有助于防止转移到肺部,从而使其成为潜在的药物靶点。
利用CRISPR‑Cas9 文库对遗传背景相同的一系列抑癌基因敲除细胞系进行全基因组功能筛选,发现并验证对于抑癌基因缺失的细胞,虽然CRISPR 系统无法靶向该基因本身,但是抑制DNA 修复、核苷酸代谢相关基因,或旁系同源基因,或其他抑癌基因等能够发挥抑制细胞生长的作用,这些基因可以作为临床治疗的潜在靶点[77]。CRISPR 技术可以筛选改善免疫细胞功能的靶点,从而改善免疫治疗[10,78]。通过CRISPR在体内筛选,建立表观遗传转录网络,筛选增强免疫治疗的新靶点[79]。张锋团队[80]对人类黑色素瘤细胞逃避细胞毒性T 细胞杀伤的基因进行了全基因组规模的CRISPR 激活筛选,以此寻找癌细胞对细胞毒性T 细胞产生耐药性的关键驱动因子。研究人员筛选鉴定了4 个候选基因:CD274(PD‑L1)、MCL1、JUNB和B3GNT2,这些基因在上调后,可以使人类黑色素瘤细胞逃避T 细胞的杀伤,系统的功能获得性筛查可以阐明耐药途径,并确定癌症免疫治疗的潜在靶点。CRISPR‑Cas9 高通量筛选文库在哺乳动物细胞中的应用无疑会为肿瘤等相关疾病机制的研究提供极大的帮助,可以预见,随着相关基础研究的深入,CRISPR‑Cas9 系统将在肿瘤个体化治疗方面得到更广阔的发展与应用。
5 谱系追踪
癌症的一大特征是它的异质性,癌细胞不断积累基因变异,导致产生具有不同特征的细胞克隆,追踪癌细胞的谱系变化,理解肿瘤内部的异质性并且追踪新克隆的产生和演化可以更全面地了解肿瘤发生。基于Cas9 的单细胞RNA 测序细胞谱系追踪的技术为大规模、高精度研究肿瘤进展提供了可行的方案,Cas9 切割特定的基因组位点,造成的稳定的插入/缺失等位基因突变可以被后代细胞继承,随着细胞分裂,它们在其他部位积累更多Cas9诱导的插入缺失突变(indel),从而进一步区分连续的细胞分支。在谱系追踪实验结束时,通过测序从单个细胞中收集indel 等位基因并与细胞状态的单细胞表达谱配对。然后利用回溯性追踪的计算方法重建系统发育树,对测序得到的indel进行亚克隆细胞关系建模[81]。
Christopher课题组[82]开发了一个基于CRISPR‑Cas9 的“谱系回溯记录器”macsGESTALT,使用CRISPR‑Cas9来诱变合成引入的DNA序列,作为细胞条形码,然后将这些工程化的癌细胞注射到小鼠体内并使其转移。当癌症在宿主小鼠中发展和扩散时,细胞条形码被CRISPR‑Cas9 随机“编辑”。因此,这种条码编辑模式用于重建癌细胞的系统发育树,可以动态追踪体内癌细胞转移过程,且成功鉴定出与癌细胞转移相关的基因。研究者将macsGESTALT 应用于小鼠转移性胰腺癌模型,通过分析38 万个CRISPR 靶向部位信息来追踪2.8万个癌细胞的体内扩散情况,鉴定出一类具有上皮‑间质转化(epithelial‑mesenchymal transition,EMT)特征的过渡态细胞。处于晚期混合EMT 状态的癌细胞具有更强的转移能力,在胰腺癌和肺癌患者中,这些晚期混合EMT 状态的基因特征预示着较低的生存率。
基于CRISPR‑Cas9 的谱系示踪技术与scRNA‑seq 结合,可以显著提高追踪的分辨率。Yang 团队[83]使用基于CRISPR 的谱系追踪方法,为每个细胞嵌入可遗传和可进化的DNA 条形码。他们对小鼠进行改造,当它们的肺细胞暴露于一种特制的病毒时,会激活Kras基因中的致癌突变,并使细胞中的肿瘤抑制基因Trp53失活,同时激活谱系追踪,每次细胞分裂时条形码都会被轻微修改。当研究人员最终收获原始细胞的后代时,就可比较细胞的条形码来重建每个细胞的“家谱”,就像相关物种的进化树一样。利用Cas9 编辑产生的indels 构建的谱系发育树并结合单细胞测序获得的转录组信息,文章揭示了癌细胞可塑性和肿瘤的平行进化路径,确定了肿瘤转移的亚克隆起源、空间位置和细胞状态,发现稀有的肿瘤亚克隆通过采用独特的适应度相关转录程序来驱动肿瘤扩张。除此之外,敲除肺腺癌中常见的抑癌因子LKB1和APC会引起肿瘤进化路径的改变,使用RNA测序测量了细胞中的基因表达,以表征每个细胞的状态。有了这些信息,研究人员就可以“拼凑”这种类型的肺癌如何变得具有侵袭性和转移性。
CRISPR‑Cas9系统产生的细胞条形码与单细胞测序技术结合的谱系追踪技术将会发展成为一种可综合理解生物体各种组织和器官发育的平台,从而加深我们对单细胞生长形成成年动物过程的理解,如果应用于疾病模型,它将为疾病如何出现发展提供新的见解。在癌症之外,该方法也为系统发育的基础研究提供了前所未有的分辨率和规模,大大增强了我们对于系统发生过程的理解。
6 技术挑战
6.1 脱靶效应
CRISPR技术自诞生以来,一直存在两大障碍阻碍其临床应用,即高脱靶效应和低递送效率。此前,已经开发出了多种Cas蛋白变体,包括:Cas9系统的dCas9[84]、SuperFi‑Cas9[85]Cas9切口酶(nCas9)[86]、xCas9[87],Cas12系统的Cas12f1[88]、hyperCas12a[89],Cas13系统的hfCas13d[90]、Cas13X[91]等。研究人员已经在改进Cas 酶和引导RNA 设计方面取得了长足进步,大幅度提高了核酸酶的特异性,结合预测靶向结果的设计工具和对基因表达的时空调控为提高靶向效率提供了全面应对的策略[87,92‑94]。CRISPR 单碱基编辑器也会导致许多不必要的和潜在危险的脱靶效应[95]。可以采取以下策略降低脱靶效率:研究脱靶效应机制,开发并合理利用预测脱靶效应的有效工具[85,96];开发新的基因编辑系统[97];利用高质量参考基因组设计靶标;靶向性强的基因编辑工具递送系统[97]。
6.2 递送效率
由于人类对Cas蛋白具有广泛的免疫性,优化Cas 系统递送策略变得更具挑战性。CRISPR 系统以DNA 形式进行的递送会长期表达,这可能导致脱靶效应和免疫反应的增加;由于mRNA 的稳定性较差,在传递过程中需要一种特殊的机制来保护其不被胞外核酸酶降解。为了最大限度地减少CRISPR‑Cas 系统的脱靶效应,最有效的传递方法是直接引入Cas 蛋白及其特异性sgRNA,而不是在细胞内表达Cas9 蛋白和sgRNA 的pDNA 或mRNA[98‑99]。基于RNP 的给药方法显示了细胞毒性和基因组重排效率之间的良好平衡[100]。解决这个问题的策略包括:利用较小的CRISPR 系统减轻递送压力,使用无细胞毒性的递送载体,以及对特定细胞的定向运输。例如可以在体内控制药效和器官选择性脂质iPhos[101]。张峰团队[102]利用天然存在于人类的类似逆转录病毒的蛋白质PEG10,开发了一种新的RNA 递送平台,名为SEND,该蛋白经过工程改造后能与mRNA 结合,形成一个模块化的递送平台,用于包装和传递RNA。使用SEND,CRISPR‑Cas9 系统成功地以mRNA 的形式传递到人类和小鼠细胞中,并编辑特定的基因。与其他载体相比,免疫反应低,安全性高。
分子量更小的递送系统也被不断发现,腺相关病毒(AAV)是目前极具潜力的临床应用的基因治疗载体,但其装载量较小,无法容纳多种传统的CRISPR‑Cas系统,需要使用双AAV 进行递送降低效率。Zhan 等[103]开发了CRISPReader,能够阅读基因簇的开放阅读框架,而不需要传统的调控元件或其他辅助因子。利用这一策略,通过从表达盒中去除启动子类元件来构建一个一体化的AAV‑CRISPR‑Cas9 系统,以解决现有的AAV 包装尺寸问题。以稳定的方式控制无启动子基因表达的技术,紧凑的AAV‑CRISPR‑Cas 在转录激活、DNA 切割和基因编辑方面比编码两个独立Cas9 元件的双AAV 载体更有效。Zhan 等[104]将各种lncRNA 功能基元集成到仅70~80 kDa 的CRISPR‑dCasΦ 系统中crRNA 的不同部分,开发了CRISPR信号导体2.0 版本。该系统可以通过招募细胞内源性转录因子直接调控靶基因的表达,有效地感知经典合成系统无法检测到的各种蛋白质信号,解决了背景泄露和信号响应不灵敏的问题,并实现了多达6个输入信号的逻辑门的构建,可用于特异性靶向癌细胞。最后通过重组内源性信号网络进一步证明了该系统在体内癌症基因治疗中的有效性和生物安全性。
6.3 DNA损伤
CRISPR 系统可以激活p53,从而导致DNA 损伤[105‑106]。在一项对小鼠和人类细胞的全面系统研究中,Kosicki等[107]发现,CRISPR‑Cas9系统导致了广泛的突变和基因重排,如大量细胞中DNA 的插入和缺失,这些变化可导致重要基因的开启或关闭,从而导致致病后果。Xu 等[108]发现Cas9 蛋白及其各种突变可以直接与DNA 修复途径中的关键因子KU86 结合,干扰DNA‑PK 复合体的形成;这可以抑制非同源端连接(NHEJ)修复途径介导的DNA 损伤修复,导致DNA 损伤和基因组不稳定。因此,在CRISPR‑Cas9 系统临床应用之前,还需要进一步的研究和特异性测试。此外,使用Cas 变体,如诱导单链断裂(SSB)而不是DSB 的Cas9n 产生碱基编辑和先导编辑的发展,是CRISPR技术安全治疗应用的一项关键创新。
6.4 细胞毒性
之前的研究表明,CRISPR‑Cas9基因编辑可以导致p53激活,进而导致DNA 损伤,因此,基因编辑成功的细胞中p53有可能存在缺陷。这增加了患癌症的风险,并可能在接受过这些基因编辑细胞治疗的个体中引发癌症[105‑106]。随后发现,CRISPR‑Cas9编辑小鼠的受精卵中出现了频繁和大量的碱基缺失[109‑110]。Wagner 等[111]在研究中发现几乎所有健康的人类受试者都拥有能对Cas蛋白产生反应的T 细胞,这可能是由于对Cas9 蛋白已有的免疫记忆,因为链球菌感染在人类中很常见,来自其他细菌的Cas 分子也会产生类似的免疫反应。此外,Cas9 特异性T 细胞可能会主动清除Cas9 修饰的细胞,导致治疗失败[112]。这些免疫细胞在基因治疗过程中可能会产生不良的免疫反应,从而影响CRISPR 技术的安全性和有效性。这些研究表明,人体的免疫反应可以破坏基因治疗,并对接受治疗的患者的健康构成威胁。Leibowitz[113]报道了在CRISPR‑Cas9 基因编辑过程中引入的DSB 可能导致染色体碎片化,这是一种具有高度破坏性的基因组重排形式,可能导致致癌融合蛋白的出现或特定基因表达的失调。对此,我们可以通过从一种从未感染过人类的细菌中寻找一种新的或者通过人工重新设计Cas蛋白酶,来避免免疫排斥反应。CRISPR‑Cas 系统引发的一系列问题的发现,说明我们对其机制认识还不够,需要对该技术的安全性评价保持谨慎。
7 总结及展望
在过去的十年里,CRISPR 技术从最初的基因敲除到模块化工具的飞跃发展,如今在疾病治疗和研究中发挥着重要作用,包括转录调控[114‑115]、表观遗传修饰[116‑117]、染色质成像[118‑119]和碱基编辑[120],关键的挑战是将新技术应用于临床治疗。相信随着安全有效的基因编辑工具的发展以及更完善的基因传递系统,未来CRISPR 技术将在疾病治疗中得到更广泛的应用。DNA 测序的发展及其大规模应用使人们认识到患者人群与普通人群之间的遗传变异;此外,它加深了我们对遗传变异(例如DNA突变)与疾病易感性、疾病发展和治疗反应之间相关性的理解[70]。这些进步刺激了个性化或精准医疗的发展。CRISPR‑Cas9系统也适用于大规模筛选,并已在各种环境中使用。在疾病模型构建、药物开发、药物靶点筛选、临床前研究等方面均取得了良好的效果。CRISPR 基因编辑系统还可以作为自我调节开关,可以帮助科学家开发用于研究的基因工程细胞的新方法[121]。更小的Cas 蛋白的开发和应用,可以简化基因传递过程,可以开发为基因调控和治疗的多种基因工程工具[122]。
CRISPR‑Cas9技术作为一种功能强大的编辑工具,具有巨大的治疗潜力,已经在临床中得到应用。接下来CRISPR 系统需要解决的关键挑战包括:编辑准确性(即目标位点的特异性)和精度(即产生确切的所需编辑结果);提高多基因调控效率;体外基因编辑的更广泛的应用;体内基因编辑的安全性和递送效率等。相信随着安全措施的完善和个性化治疗的发展,该技术在疾病治疗中的大规模应用将很快成为可能。尽管临床应用的路上仍具有一些挑战,我们依然有理由认为基因编辑疗法将预示着癌症领域一个新的时代的到来。
