TIM-3、CCN1及SII与胃癌患者预后的关系
2023-09-15陈胜利邢世江李新许家健曾欢玲赵玉华
陈胜利,邢世江,李新,许家健,曾欢玲,赵玉华
胃癌可侵袭胰脏、食管、肝等相邻器官,还可发生淋巴结转移,经由血液循环播散至肾、肺、脑、骨髓、腹膜等器官,临床可通过手术、靶向治疗、化疗等多种方式进行治疗,但远期疗效不尽如人意[1-2]。准确地评估胃癌患者预后,并给予个体化治疗方案,可提高远期疗效,改善生存[3]。T细胞免疫球蛋白黏蛋白-3(T-cell immunoglobulin mucin-3,TIM-3)属于一种负性共刺激分子,可调节机体免疫应答,介导机体抗肿瘤免疫反应[4]。结缔组织生长因子/富含半胱氨酸61/肾母细胞瘤-1(connective tissue growth factor/cysteine rich 61/nephroblastoma-1,CCN1)在肿瘤的增殖、侵袭、转移等过程中起重要作用[5]。全身免疫炎症指数(systemic immune inflammation index,SII)是一种反映机体炎症状态的指标,炎性反应可破坏机体免疫应答,促使恶性肿瘤逃脱机体免疫监视,还可影响基因组稳定性,促使肿瘤细胞血管形成,发生远处转移,多项研究发现机体炎症状态与癌症进展密切相关[6-7]。本研究分析TIM-3、CCN1及SII与胃癌患者预后的关系及其预测价值,现报道如下。
1 资料与方法
1.1 临床资料
选择于2018年1月至2022年1月南方医科大学附属小榄医院收治入院胃癌患者为研究对象,纳入标准:①符合胃癌的临床诊断标准[8],并经病理学检查确诊;②首次确诊;③年龄不低于18岁;④均接受胃癌根治术治疗;⑤临床及随访资料完整。排除标准:①术前接受过放化疗及其他癌症相关治疗;②存在远处转移;③伴有其他恶性肿瘤;④合并血液系统疾病。共120例入组,其中男83例、女37例;年龄32~86岁,平均(64.75±14.19)岁;体质量43.17~74.63 kg,平均(51.17±11.04)kg。
本研究经医院伦理委员会批准通过,所有患者及其家属均已知情同意,并签署同意书。
1.2 方法
1.2.1 检查方法 TIM-3及CCN1检测[9]:将手术收集的组织样本,进行石蜡包埋处理后,组织蜡块切片4 μm,经烤片、脱蜡、水洗处理,于1.0%的枸橼酸缓冲液(pH=6.0)中浸泡后,经PBS清洗,并滴加适量5%~10%的山羊血清进行孵育,分别滴加CCN1鼠抗人多克隆抗体、TIM-3兔抗人多克隆抗体与阴性对照进行孵育,滴加适量的辣根过氧化物酶标记的链霉卵白素工作液进行孵育,加入3,3′-二氨基联苯胺溶液显色,经冲洗、复染、脱水、透明、封片处理。以PBS溶液为阴性对照,以已知阳性组织切片为阳性对照。每份组织切片均经双盲阅片,随机选取10个高倍视野,每个视野计数100个细胞,共1 000个细胞,计算阳性细胞百分率。无阳性细胞记为0分,0<阳性细胞≤25%记为1分,25%<阳性细胞≤50%记为2分,50%<阳性细胞≤70%记为3分,70%<阳性细胞记为4分。细胞着色强度无色记为0分、淡黄色记为1分、棕黄色记为2分、黄褐色记为3分。阳性细胞百分率与细胞着色强度两项得分相乘,5分以下即为阴性(-),≥5分为阳性(+)。
SII检测[10]:术前使用采集患者空腹静脉血2 ml,使用全自动血液分析仪检测患者外周血淋巴细胞、血小板及中性粒细胞计数,计算SII。SII=中性粒细胞计数×血小板计数/淋巴细胞计数。
试剂及仪器:流式细胞仪(CytoFLEX,美国贝克曼库尔特有限公司),全自动血液分析仪型号:(DXH800,美国贝克曼库尔特有限公司)。
1.2.2 预后判断及分组 所有患者通过门诊复查及住院检查完成随访,随访1年或至患者死亡。随访项目包括CT、胃镜及肿瘤标志物等。根据患者预后情况进行分组,若1年内患者胃癌复发或死亡,提示预后较差纳入预后不良组,反之则提示预后良好纳入预后良好组。
1.2.3 影响胃癌患者预后的危险因素收集 收集患者的病理资料包括:性别、年龄、体质量、吸烟、饮酒、TNM分期、肿瘤最大径、血清癌胚抗原(CEA)、糖类抗原19-9(CA19-9)、CA72-4、TIM-3、CCN1及SII。
1.3 统计学分析
2 结果
2.1 单因素分析影响胃癌患者预后的相关因素
两组患者性别、年龄、BMI、吸烟、饮酒、CEA、CA19-9、CA72-4比较,差异无统计学意义(P>0.05)。随访后,31例纳入预后不良组,其余89例纳入预后良好组。与预后良好组比较,预后不良组患者pTNM分期Ⅲ~Ⅳ期、肿瘤最大径≥5 cm占比、TIM-3、CCN1阳性表达率及SII均更高,差异有统计学意义(P<0.05),见表1。
2.2 Logistic回归分析影响胃癌患者预后的危险因素
以胃癌患者是否出现预后不良为因变量,单因素分析中差异具有统计学意义的因素:pTNM分期、肿瘤最大径、TIM-3、CCN1及SII为自变量,进行赋值(出现=1,未出现=0),Logistic回归分析结果显示,pTNM分期、肿瘤最大径、TIM-3、CCN1及SII是影响胃癌患者预后不良的危险因素(P<0.05),见表2。
2.3 TIM-3、CCN1及SII对胃癌患者预后不良的预测价值
ROC曲线分析,结果显示TIM-3、CCN1及SII预测胃癌患者预后不良的曲线下面积(AUC)分别为0.725、0.748、0.837,三者联合预测胃癌患者预后不良的AUC为0.916大于三者单独预测,差异有统计学意义(P<0.05),见图1、表3。
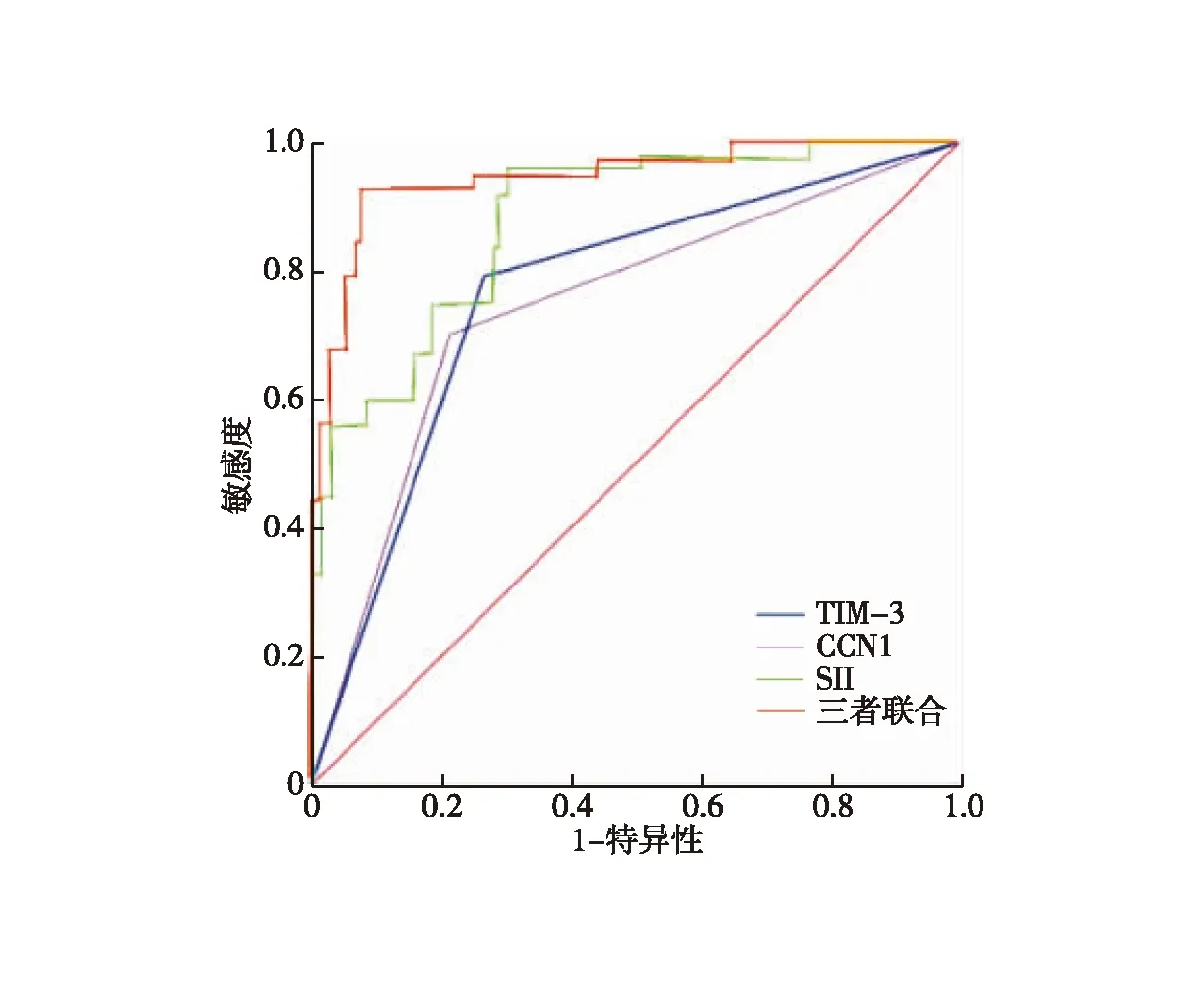
图1 TIM-3、CCN1及SII对胃癌患者预后不良的预测价值ROC图
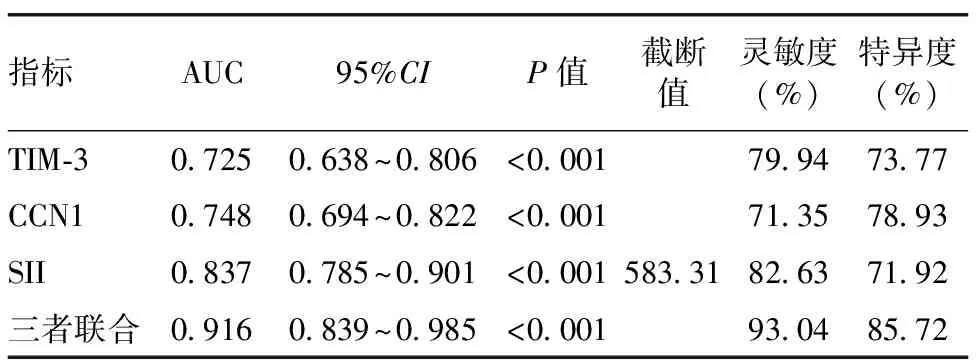
表3 TIM-3、CCN1及SII对胃癌患者预后不良的预测价值
3 讨论
胃癌是一种原发于胃黏膜上皮细胞的恶性肿瘤,早期症状不明显,随病情进展可见上腹部疼痛、食欲不振、乏力、体重减轻及进行性吞咽困难等症状,严重者可见呕血、黑便、剧烈疼痛、贫血及相关恶病质表现[11-13]。寻找灵敏度高及特异度高的指标,以预测患者预后,具有极高的临床价值。
TIM-3是一类Ⅰ型膜糖蛋白,可调节细胞免疫应答、介导细胞免疫耐受,在免疫耐受、自身免疫性疾病及抗肿瘤免疫中起重要作用,还可增强肿瘤细胞的存活能力及穿透血管的能力,进而可促进肿瘤细胞发生转移,对胃癌的发生及发展具有负性调节作用[14-15]。CCN1能够调控多种细胞功能,可通过多种机制参与恶性肿瘤的增殖、转移、血管生成等[16]。相关研究显示,CCN1在癌组织中的表达水平显著高于癌旁组织,且肿瘤分期、病理分型的不同及是否发生微血管浸润,其表达水平亦有所不同,与癌症进程中的侵袭、转移密切相关[17]。SII是一种衡量人体炎症反应情况的复合指标,可全面反映机体免疫与炎性状态的平衡。多项研究证实[18-19],SII异常升高与癌症患者预后不良有关。本研究通过单因素及Logistic回归分析影响胃癌患者预后的影响因素,结果显示,与预后良好组比较,预后不良组患者pTNM分期Ⅲ~Ⅳ期、肿瘤最大径≥5 cm占比、TIM-3、CCN1阳性表达率及SII均明显更高;pTNM分期、肿瘤最大径、TIM-3、CCN1及SII是影响胃癌患者预后不良的危险因素。说明pTNM分期Ⅲ~Ⅳ期、肿瘤最大径≥5 cm、TIM-3、CCN1呈阳性表达及SII异常升高的胃癌患者出现预后不良的风险较高,临床需密切关注患者身体状况,并制定相关治疗及预防措施。此原因可能是:①SII是一种综合中性粒细胞、淋巴细胞及血小板的复合指标,而血小板可通过分泌多种肿瘤生长因子,促进肿瘤生长,还可促使肿瘤细胞逃逸免疫监视,促使恶性肿瘤扩散;淋巴细胞可促进肿瘤血管形成、抑制抗肿瘤免疫反应;中性粒细胞可介导肿瘤细胞的增殖、转移,促进癌症进程。②TIM-3配体与Th2细胞表面TIM-3结合,对T细胞基于负性刺激信号,导致T细胞功能障碍,通过介导细胞间相互作用,促使机体形成有利于肿瘤细胞生存的免疫环境[20]。③CCN1的表达上调,通过与硫酸乙酰肝素蛋白聚糖(heparan sulfate proteoglycan,HSPG)结合以介导细胞黏附和纤维化,同时CCN1为多种整合素的配体,可通过影响相关整合素受体的表达,以影响整合素和细胞外基质间的相互作用,从而影响细胞黏附,参与免疫应答、肿瘤的扩散转移及微血管形成等[21]。
此外,本研究分析TIM-3、CCN1及SII对胃癌患者预后不良的预测价值,结果显示,TIM-3、CCN1及SII预测胃癌患者预后不良的AUC分别为0.725、0.748、0.837,三者联合预测胃癌患者预后不良的AUC为0.916大于三者单独预测。提示TIM-3、CCN1及SII联合检测对胃癌患者预后不良的预测价值较高。单独检测时,TIM-3、CCN1表达及SII水平易受检测方式、标本采集及保存方式等多种因素影响,存在一定误差,影响检测准确性联合检测可有效提高检测准确性,具有较高的灵敏度及特异度,故联合检测时对胃癌患者预后不良的预测价值较高。
综上所述,TIM-3、CCN1及SII是影响胃癌患者预后不良的危险因素,三者联合检测对预测胃癌患者预后不良的价值较高。
