PD-1抑制剂联合化疗治疗非小细胞肺癌的疗效
2023-09-15周雪峰高冬蕴耿炜
周雪峰,高冬蕴,耿炜
非小细胞肺癌(non-small cell lung cancer ,NSCLC)是临床常见的恶性肿瘤,流行病学调查发现,肺癌的发病率在恶性肿瘤中排名第2,占恶性肿瘤总发病率的11.4%,而肺癌患者中85%以上为NSCLC,由于NSCLC早期症状并不明显,相当一部分患者确诊时已至中晚期,失去最佳的手术治疗时机[1]。目前对于晚期NSCLC患者以放化疗、靶向及免疫治疗等方法为主,免疫治疗是通过促进宿主免疫系统识别肿瘤细胞,刺激自身免疫系统,从而抑制肿瘤细胞增殖[2]。
程序性死亡受体1(PD-1)是由268个氨基酸组成的Ⅰ型跨膜蛋白,是免疫细胞的共抑制分子,是T细胞常见的免疫检查点[3]。PD-1抑制剂可通过激活PTEN抑癌基因而产生抗肿瘤作用。帕博利珠单抗是PD-1抑制剂的代表药物,是首批同时获得美国食品药品监督管理局和欧洲药品管理局批准用于治疗晚期NSCLC的PD-1抑制剂[4]。本研究探讨帕博利珠单抗联合化疗在NSCLC中的应用效果及对生存期的影响,现报道如下。
1 资料与方法
1.1 一般资料 选取2020年1月至2022年1月在东台市人民医院治疗的晚期NSCLC患者120例,纳入标准:①均经病理组织学确诊为NSCLC;②临床分期为Ⅲ~Ⅳ期;③卡氏评分(KPS)≥60分;④表皮生长因子受体(EGFR)、间变性淋巴瘤激酶(ALK)等基因突变阴性;⑤年龄≥18岁;⑥患者及家属知情同意。排除标准:①合并有其他恶性肿瘤者;②合并有肝肾功能障碍、血液系统疾病、心脏病等其他严重疾病;③有肺纤维化、间质性肺炎等所致的肺功能受损;④对药物不耐受。详细告知患者治疗方案后,遵从患者选择,常规化疗组为对照组,接受PD-1抑制剂治疗的为观察组,观察组和对照组各60例,临床一般资料比较见表1,两组性别、年龄、卡氏评分、体质量指数、病理类型、临床分期之间比较,差异无统计学意义(P>0.05),具有可比性。本次研究获得医院伦理委员会批准。

表1 观察组和对照组临床一般资料比较
1.2 治疗及随访方法 对照组给予常规化疗,静脉滴注紫杉醇(哈药集团生物工程有限公司)135 mg/m2,第1天;静脉滴注顺铂(齐鲁制药有限公司)45 mg/m2,第1~3天;化疗开始前静脉注射地塞米松、昂丹司琼减轻不良反应,化疗期间常规水化,3周为1个疗程。
观察组在对照组基础上给予PD-1抑制剂帕博利珠单抗治疗,静脉滴注帕博利珠单抗2 mg/kg,每3周1次。
所有患者均至少治疗3个疗程。每个疗程开始前和结束时均常规检测血常规、肝肾功能。对结果异常者进行对症治疗,使其达标后再开始下一疗程。观察患者化疗不良反应,随访终点为患者死亡。
近期疗效采用实体瘤疗效评价标准(RECIST)评价[5],其中完全缓解(CR)为病灶消失,且维持1个月以上,部分缓解(PR)为病灶长径总和缩小超过30%及以上,病情稳定(SD)为病灶长径总和缩小不超过30%或增大不超过20%,疾病进展(PD)为病灶长径总和增大超过20%及以上,或出现新病灶。其中客观缓解率(ORR)为(CR+PR)/总例数×100%,疾病控制率(DCR)=(CR+PR+SD)/总例数×100%。
1.3 检查方法 于化疗前、化疗1个月后抽取患者外周空腹静脉血标本4 ml,离心处理取血清,转速3 000 r/min、时长10 min,采用电化学发光法检测血清CA125、Cyfra21-1、CEA和CA199,试剂盒购自上海臻科生物科技有限公司,化学发光免疫分析仪(E601)购自瑞士罗氏公司。另取一份血标本,采用流式细胞术检测CD3+、CD4+和CD8+T细胞亚群,检测仪器流式细胞仪(CytoFLEX)购自美国贝克曼公司。
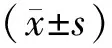
2 结果
2.1 两组血清肿瘤标志物水平比较 观察组和对照组化疗后血清CA125、Cyfra21-1、CEA和CA199较化疗前降低(P<0.05);观察组化疗后血清CA125、Cyfra21-1、CEA和CA199低于对照组(P<0.05)。见表2。
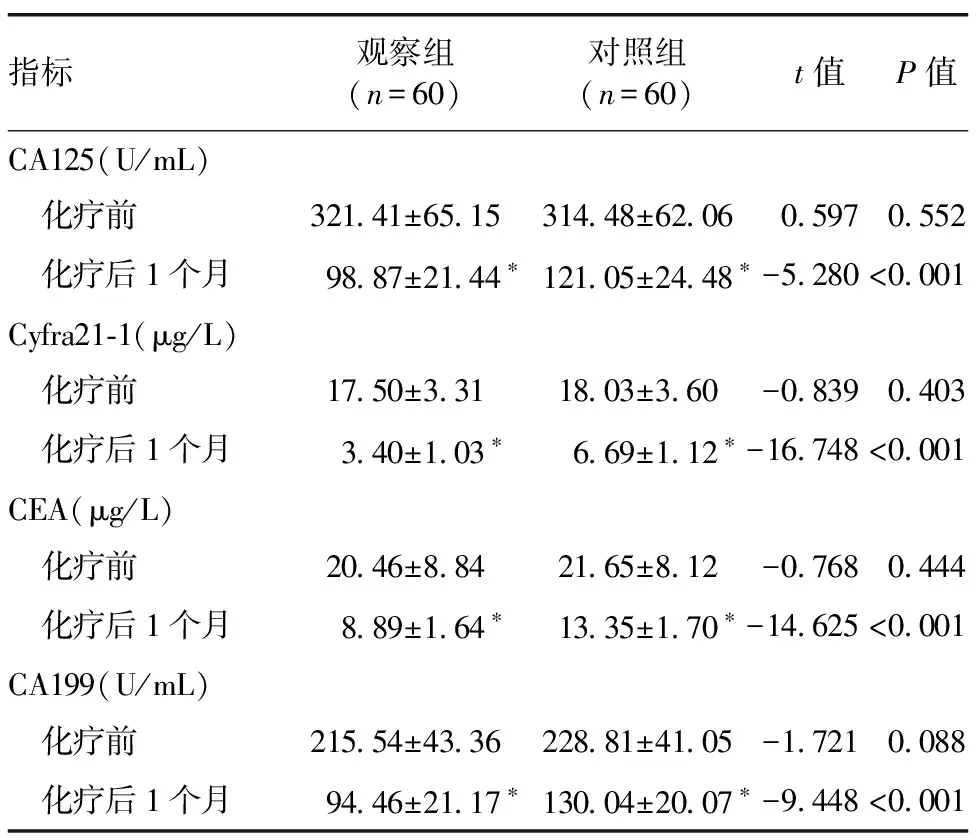
表2 观察组和对照组血清肿瘤标志物水平比较
2.2 两组T淋巴细胞亚群比较 观察组和对照组化疗后CD3+、CD4+和CD8+比例均较化疗前降低(P<0.05);观察组化疗后CD3+、CD4+和CD8+比例均高于对照组(P<0.05)。见表3。
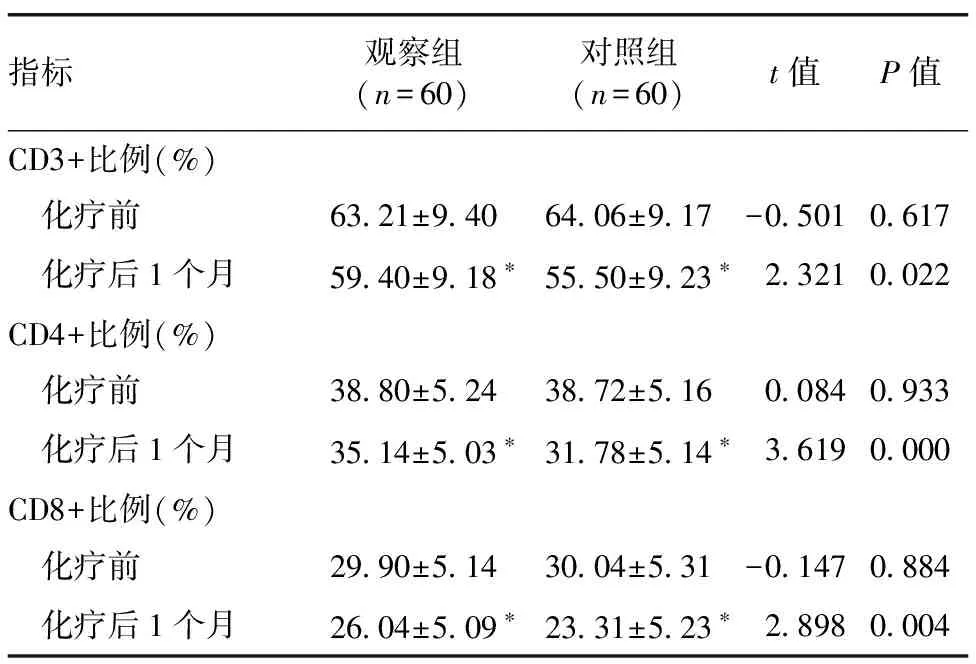
表3 观察组和对照组血清T淋巴细胞亚群比较
2.3 两组不良反应比较 观察组和对照组不良反应发生率比较,差异无统计学意义(P>0.05),见表4。
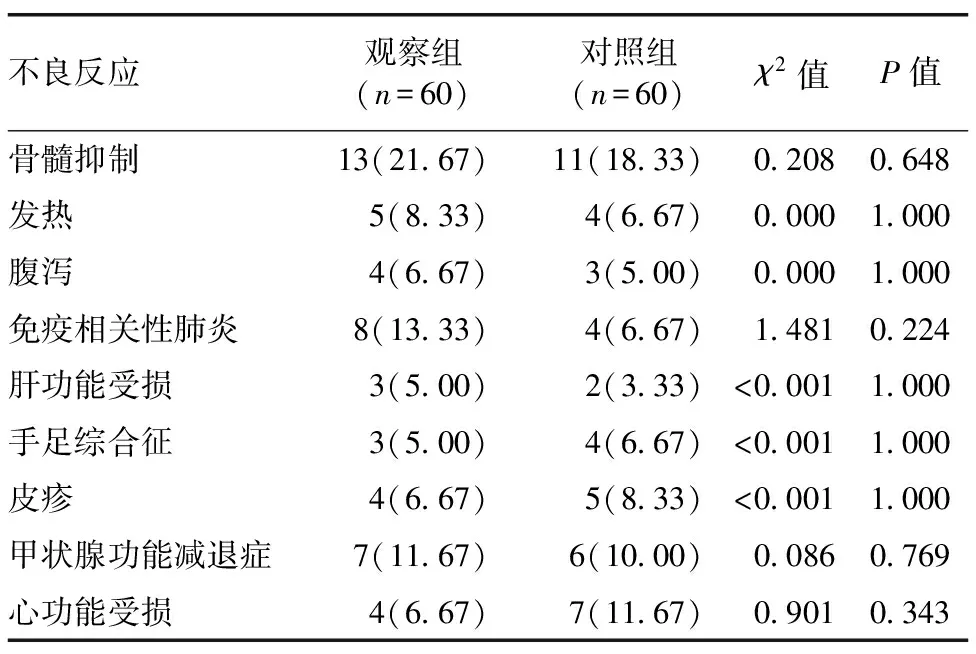
表4 观察组和对照组不良反应比较 [例(%)]
2.4 两组近期疗效比较 观察组ORR高于对照组(P<0.05);观察组和对照组DCR比较差异无统计学意义(P>0.05)。见表5。

表5 观察组和对照组近期疗效比较 [例(%)]
2.5 两组中位无进展生存时间比较 随访截至2022年12月,观察组中位无进展生存时间(95%CI:10.60~13.40)长于对照组的(95%CI:7.90~10.10),差异比较有统计学意义(χ2=10.593,P=0.001),见图1。
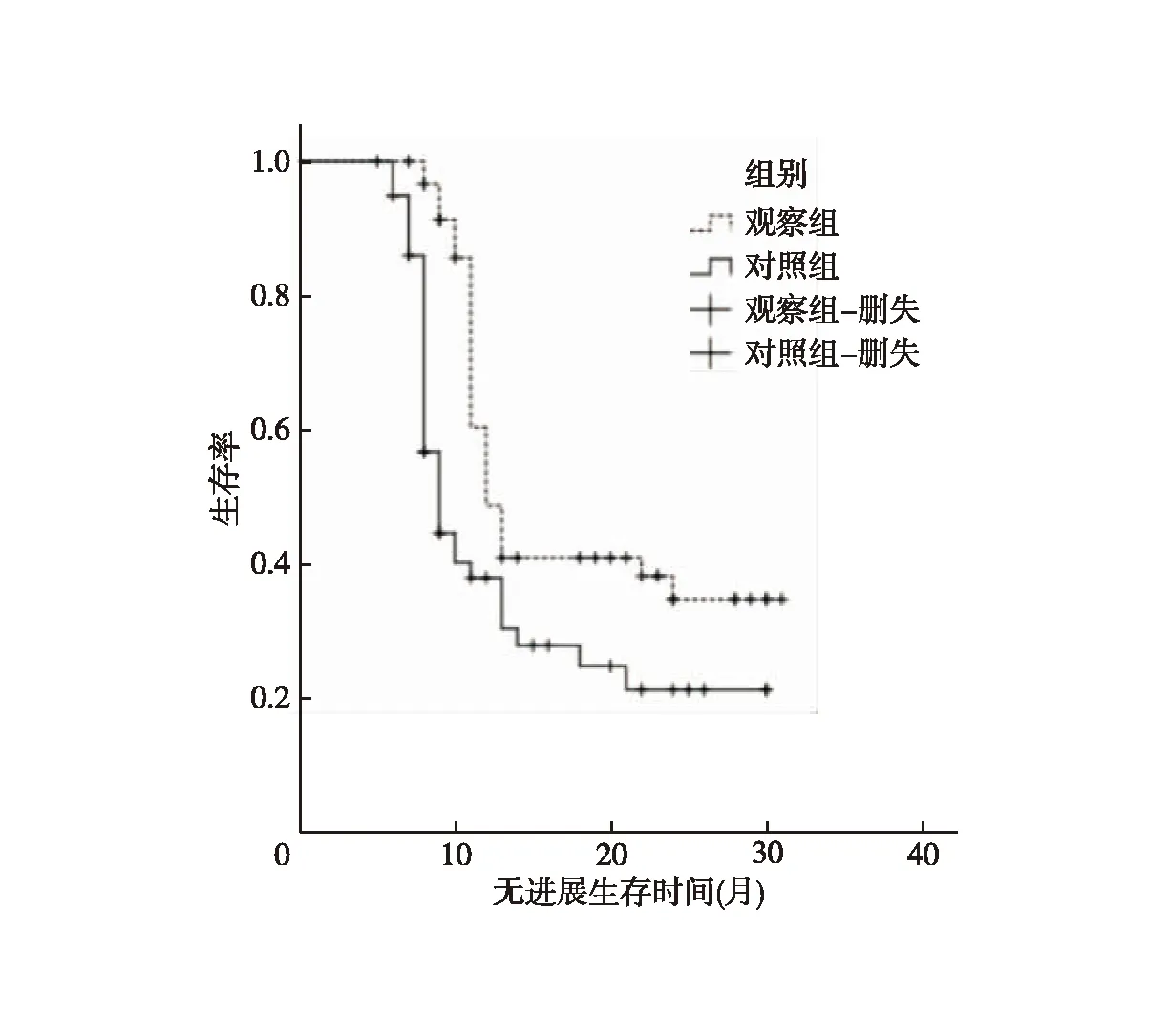
图1 观察组和对照组无进展生存时间曲线
3 讨论
紫杉醇联合顺铂方案是目前临床治疗NSCLC的一线化疗方案,其中紫杉醇属于细胞周期特异性抗肿瘤药物,可促进微管蛋白聚合、抑制解聚而阻止肿瘤细胞增殖。顺铂属于细胞周期非特异性抗肿瘤药物,可抑制肿瘤DNA合成、修复而抑制肿瘤细胞分裂。两种化疗药物联合应用时可起到协同增效作用[6]。但仍有部分患者疗效欠佳,且该化疗方案引起的毒副反应严重,会对患者的免疫功能造成严重的打击,导致患者的预后较差[7]。
免疫治疗2013年逐步应用于恶性肿瘤的临床治疗,晚期NSCLC的临床治疗也开始进入免疫时代。免疫疗法是借助机体自身免疫系统来发挥抗肿瘤作用[8]。帕博利珠单抗是目前临床治疗NSCLC的常用免疫药物,王立民等[9]研究发现,帕博利珠单抗联合化疗在晚期NSCLC治疗中的疗效更好,与单纯采用紫杉醇-顺铂化疗方案相比,采用帕博利珠单抗辅助治疗时可延长患者生命,提高其生活质量。本研究发现,两组不良反应发生率比较差异无统计学意义;采用帕博利珠单抗辅助治疗者中位无进展生存时间长于单用化疗者。这一结果提示,PD-1抑制剂联合化疗在NSCLC中有较好的治疗效果,有助于延长患者的生存时间,同时不会增加不良反应。这是由于PD-1是CD28/CTLA4家族中T细胞调节因子成员,存在于成熟T细胞,其配体PD-L1存在于肿瘤细胞。PD-1与PD-L1结合后可增强患者体内T淋巴细胞的杀伤能力,从而增强自身抗肿瘤能力,阻止病情进展,延长生存时间[10]。本研究中两组患者的DCR比较差异无统计学意义,这可能与本研究样本量较少引起的偏倚有关,今后应积累大样本研究进一步探讨采用帕博利珠单抗辅助治疗是否能提高临床疗效。
血清肿瘤标志物在恶性肿瘤患者体内升高,因此临床上常将其作为恶性肿瘤诊断和病情评估的辅助指标[11]。CA125是一种黏蛋白样糖蛋白,在卵巢癌、肝癌、肺癌等恶性肿瘤患者体内升高[12]。Cyfra21-1是细胞角蛋白的可溶性片段,在肺癌中具有特异性的诊断价值[13]。CEA是一种肿瘤相关抗原,在消化道恶性肿瘤、肺癌、卵巢癌患者体内升高[14]。CA199是一种糖类抗原,在肝胆恶性肿瘤、胃癌、肠癌、肝癌、肺癌患者体内可能升高[15]。本研究发现,采用帕博利珠单抗辅助治疗者化疗后血清CA125、Cyfra21-1、CEA、CA19-9低于单用化疗者。这一结果提示,PD-1抑制剂联合化疗在NSCLC中有较好的治疗效果,可在一定程度上抑制肿瘤细胞的增殖活性,阻止病程进展。
NSCLC患者自身免疫功能不仅会影响其对化疗的耐受性和依从性,还会影响机体自身抗肿瘤能力,引起肿瘤逃逸而致复发和转移。NSCLC患者体内的肿瘤细胞可引起免疫紊乱,化疗药物的毒副作用会抑制患者CD3+、CD4+和CD8+T细胞增殖,导致肿瘤微环境中T淋巴细胞杀伤功能降低[16]。本研究发现,采用帕博利珠单抗辅助治疗者化疗后CD3+、CD4+和CD8+高于单用化疗者。这一结果提示,PD-1抑制剂联合化疗治疗非小细胞肺癌可增强患者免疫功能,提高患者自身抗肿瘤能力,防止发生肿瘤免疫逃逸。这是其延长患者生存时间的重要机制之一。
综上所述,PD-1抑制剂联合化疗在非小细胞肺癌中有较好的治疗效果,可降低血清肿瘤标志物水平,对患者免疫功能影响小,可提高近期化疗效果,改善患者预后。
