CD133+结肠癌细胞区域变异位点在结肠癌免疫逃逸中的作用研究
2023-09-15李一鹤钱树坤刘建华
李一鹤,钱树坤,刘建华
2018年全球癌症统计数据显示,结直肠癌发病率和死亡率分别位居癌症总发病率和死亡率的第三位和第二位[1]。尽管综合治疗模式的应用提高了结直肠癌的疗效,但患者5年生存率仅50%左右[2]。近年来多项研究证实,结直肠癌的发生发展与免疫逃逸密切相关,可通过抗原丢失或出现新抗原逃脱免疫系统的识别,致使免疫细胞的抗肿瘤作用降低或丧失,从而发展为肿瘤的免疫逃逸[3-4]。全方位分析肿瘤免疫逃逸机制探寻克服结直肠癌患者免疫治疗抵抗的方法及理论依据十分必要。近年来有研究指出,CD133作为跨膜糖蛋白家族成员之一,具有5次跨膜结构,其阳性表达的细胞具有自我分化更新、高致瘤性、高药物抗性、高DNA损伤修复能力等特性,对肿瘤发展起到促进作用[5],且与淋巴结转移等过程密切相关,是判断结肠癌预后的参考指标,也是结肠癌靶向治疗的新靶点[6]。相关研究显示,位于CD133+肿瘤细胞基因3-UTR区域中rs2240688位点上的单核苷酸的多态性(singlenucleotide polymorphisms,SNPs)与肿瘤的发生发展密切相关,可能会通过与miRNA的相互作用而影响肿瘤基因的表达调控,进而参与肿瘤细胞的免疫逃逸[7]。自然杀伤细胞(natural killer cells,NK)作为机体内固有免疫系统中的一种效应细胞,无需抗原刺激,不受主要组织相容复合物限制,不依赖抗体与补体即可发挥免疫功能,是机体免疫的重要屏障,而NK-92细胞作为一种永生细胞系,可以大量扩增,能够通过规范性生产获得,是比较理想的NK细胞杀伤活性试验的效应细胞[8]。基于此,本研究观察了3-UTR区域中rs2240688位点不同基因型CD133+结肠癌细胞的侵袭迁移能力以及NK-92细胞对不同基因型CD133+结肠癌细胞的细胞毒力,以期为结直肠癌的靶向治疗提供参考。
1 资料与方法
1.1 主要材料与设备 NK-92细胞购自赛业生物科技有限公司;RPMI1640培养液、DMEM/F12培养基、RPMI 1640培养基、TRIzol试剂、DNA提取试剂盒、磷酸盐缓冲液(phosphate buffered saline,PBS)、DNase Ⅰ溶液等购自美国Gibco公司;胰蛋白酶、青霉素和链霉素双抗、Ⅳ型胶原酶、胎牛血清、TrypLE、RIPA 蛋白裂解液等购自美国Genview公司;蛋白核酸微量检测仪购自Applied Biosystems公司;CO2恒温细胞培养箱购自上海新苗医疗器械制造有限公司生产;酶标仪购自美国Molecular Devices 公司;CD133磁珠抗体、4 ℃低温高速离心机、磁珠分选装置、CD133流式鉴定抗体、流式检测试剂盒等购自德国Beckman公司。
1.2 CDl33+人结肠癌细胞的筛选及培养 取20例结肠癌患者新鲜肿瘤组织,无菌生理盐水冲洗,剔除周围脂肪、结缔组织等,PBS缓冲液洗涤3次;无菌眼科手术剪剪成1 mm3大小碎块,PBS缓冲液洗涤3次;加入肿瘤组织消化液(500 μL Ⅳ型胶原酶溶液+750 μL DNase Ⅰ溶液+3.75 mL RPMI 1640培养基,充分混匀并预热至15~25 ℃),37 ℃消化40 min,每5 min轻轻振荡1次或吸管吹打1次;加入2~5 mL含血清培养基或胰酶抑制剂,终止胰酶消化;静置2~3 min,取悬液用200/300目尼龙网过滤2次;过滤后悬液1 000 rpm离心5~10 min,弃上清液,PBS缓冲液5 mL冲散,再次离心,弃上清液;加入l~2 mL培养液,将细胞调整到5×105个/mL,转移至25 mL细胞培养瓶(含100 μg/mL链霉素、100 U/mL青霉素、10%胎牛血清的完全培养基),37 ℃、5% C02条件下培养。
取对数生长期细胞,Tryp LE成单细胞悬液,加入20 μL密度为1×107个/mL的CD133 MicroBeads细胞(德国美天旎生物技术公司,批号130-097-239)和20 μL细胞密度为1×l07个/mL的FCR Blocking Agent,4 ℃孵育15 min,PBS缓冲液洗涤3次;加入10 μL细胞密度为1×107个/mL的Labeling Check Reagent-PE,缓冲液洗涤3次;重悬细胞,并置于磁珠分选架的分选柱内,快速加压挤出分选柱CD133+及CD133-肿瘤细胞,混合染色30 min,洗脱后加入7AAD(BD Biosciences)排除死细胞对结果影响;PBS缓冲液洗涤1次后,DMEM/F12培养基内培养5 d,收集干细胞;加入胰酶重悬,静置5 min;吸管吹打至单个细胞,PBS缓冲液洗涤1次后离心;去除上清,将细胞重悬于DMEM/F12培养基,1∶2传代,观察细胞生长情况,至第3代后,流式细胞仪检测CD133+细胞增殖情况。
1.3 CDl33+肿瘤细胞rs2240688位点基因多态性检测 取对数生长期CD133+肿瘤细胞,胰酶消化成单细胞悬液,严格按照DNA提取试剂盒说明书提取DNA,并采用琼脂糖凝胶电泳法对DNA完整性进行检测,采用蛋白核酸微量检测仪对DNA浓度进行测定,OD260/280值在1.6~1.8之间视为合格。查询SNPs所在基因位置,根据其所在序列,设计引物并进行扩增,测序CD133+细胞rs2240688位点增引物序列为5′-ACTTCTTGGTGCTGTTGAA-3′,长度为682 bp;测序引物序列为5′-ACTTCTTGGTGCTGTTGAA-3′[生工生物工程(上海)股份有限公司进行]。分别采用TaqMan基因分型法和Massarray SNP基因分型法对CD133+细胞rs2240688位点基因分型进行检测,对比测序结果和分型结果判断结果准确性。最终得到CD133+细胞rs2240688位点的等位基因有G和T,基因型分别为G/G、T/T和G/T。
1.4 Transwell细胞迁移实验检测不同基因型CDl33+细胞侵袭迁移情况 取对数生长期各组细胞,采用胰蛋白酶进行消化,继而形成单细胞悬液后,分别接种于24孔板中培养48 h(每组设定5个复孔);每个Transwell小室的下室加入含10%胎牛血清的DMEM/F12培养基600 μL,上室加入各组细胞悬液200 μL,细胞浓度均为25×104个/mL,进行侵袭实验时提前在小室内铺Matrigel基质胶;将Transwell小室置于37 ℃含5% CO2的培养箱中培养,其中侵袭实验培养48 h,迁移实验培养16 h;培养后,PBS洗涤3次,4%多聚甲醛固定,0.1%结晶紫染色,拭去内层未迁移细胞后倒置于载玻片上,显微镜(正置)观察侵袭迁移情况,随机选4个视野计算穿膜细胞数。
在6孔板背后用记号笔间隔0.5 cm划2条横线,6孔板内加入6×104个细胞,每组设定5个复孔,培养24 h后,无菌枪头以背部标线为标准垂直划线,PBS洗涤3次,加入无血清培养基继续培养24 h后,显微镜下观察迁移率。迁移率=(0 h划痕宽度-24 h划痕宽度)/0 h划痕宽度×100%,选4点计算取平均值。
1.5 CDl33+细胞毒力检测 取对数生长期G/G、G/T和T/T型CD133+肿瘤靶细胞,经胰蛋白酶消化重新形成单细胞悬液后,调节细胞浓度为1×105个/mL,按照每孔1×104个靶细胞接种于96孔板中,分别设置实验组、自然释放组、最大释放组(仅含有培养基),每组设定5个复孔,37 ℃含5% CO2的培养箱中过夜培养;弃去培养上清,无血清培养基清洗靶细胞2次,同时无血清培养基清洗NK-92效应细胞2次;调整效应细胞比例,按照效靶比(即NK-92细胞比CD133+肿瘤细胞)为5∶1、10∶1、20∶1,将NK-92效应细胞接种至实验组,37 ℃含5% CO2的培养箱中培养;培养3 h后,最大释放组加入20 μL LDH释放液,吹打混匀,再次放回培养箱继续培养;培养1 h后,多孔板离心机1 000 rpm离心5 min,移液枪将细胞转移至新孔,快速加入反应液(乳酸溶液20 μL+INT溶液20 μL+酶溶液20 μL)60 μL孵育30 min,最后用酶标仪测定OD值(490 nm)。细胞毒力(%)=(实验组OD值-自然释放组OD值)/(最大释放组OD值-自然释放组OD值)×100%。效应细胞为NK-92,靶细胞为CD133+肿瘤细胞。实验重复3次取均值。
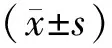
2 结果
2.1 CD133+细胞生长情况 分选后CD133+细胞、CD133-细胞分别进行培养,CD133+细胞增殖明显,培养4 d后CD133+细胞呈典型球形生长,3~6 d增长最为迅速,随时间推移,细胞球体积持续增大、数量持续增加,培养期间始终处于增长状态;而CD133-细胞不能形成细胞球,培养1~3 d生长迅速,3 d后基本无增长,第12天后细胞数量明显下降,与CD133+细胞相比,其体外增殖能力明显较弱。培养至第3代时流式细胞检测结果显示,CD133+细胞增值率为90.14%(图1~2)。
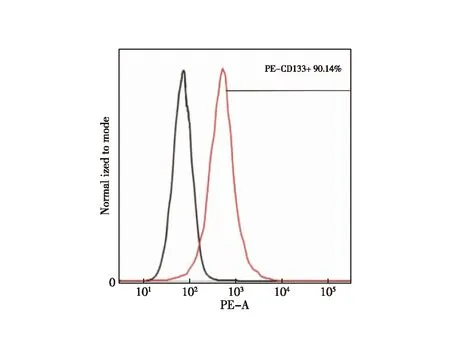
图1 流式细胞仪检测CD133+结肠癌增殖情况直方图
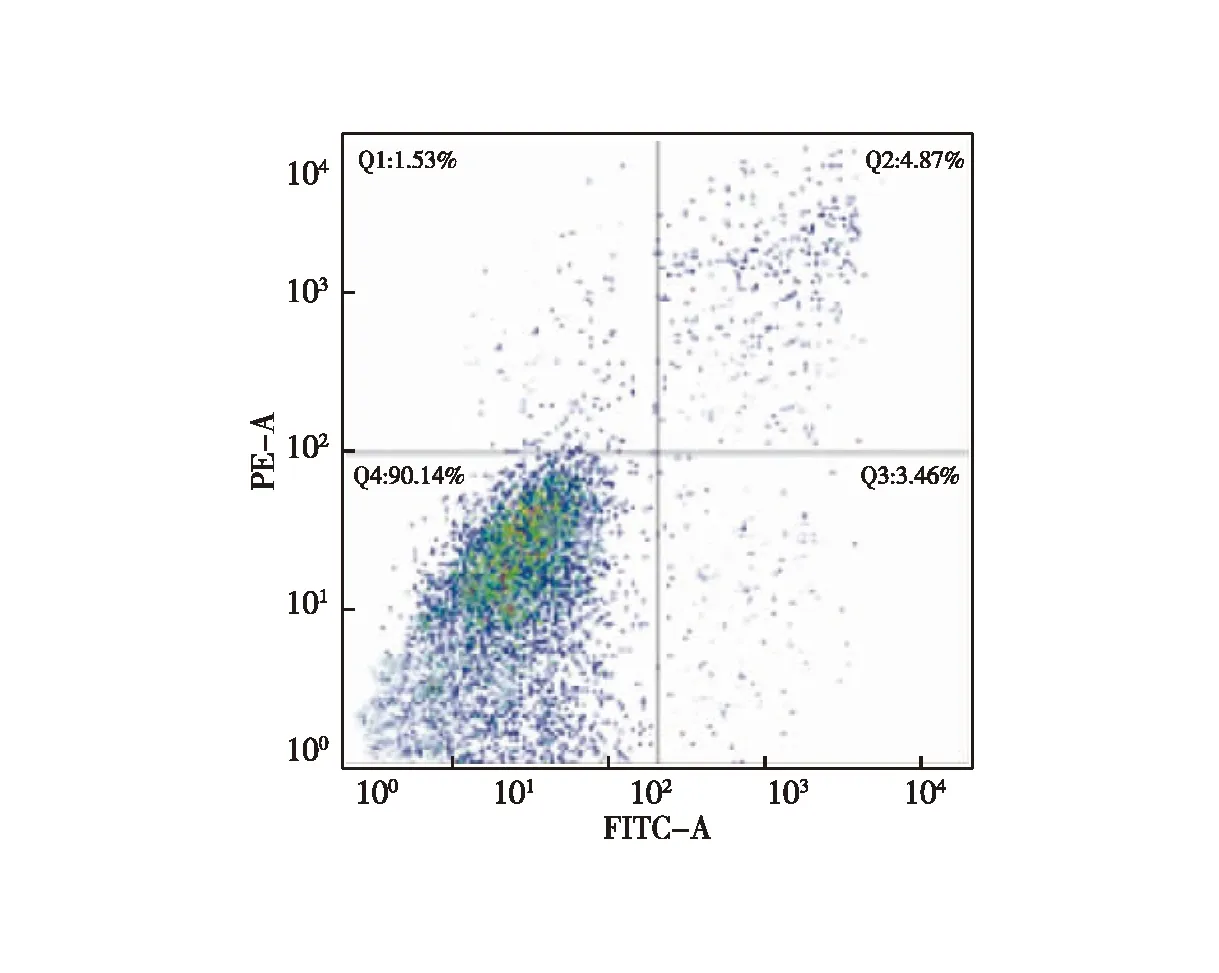
图2 流式细胞仪检测CD133+结肠癌增殖情况散点图
2.2 CD133+细胞rs2240688位点基因 CD133+细胞rs2240688位点的等位基因有G和T,基因型分别为G/T、T/T和G/G,图3~4。

图3 rs2240688位点不同基因型序列图

注:红色为G/G基因型、蓝色为T/T基因型、绿色为G/T基因型图4 rs2 240 688位点基因散点图
2.3 细胞侵袭迁移情况对比 基因型为G/G的CD133+结肠癌细胞侵袭迁移能力最强,而基因型为T/T的CD133+结肠癌细胞侵袭迁移能力最弱(P均<0.05),见图5~7,表1。

表1 不同基因型CD133+结肠癌细胞侵袭迁移情况对比
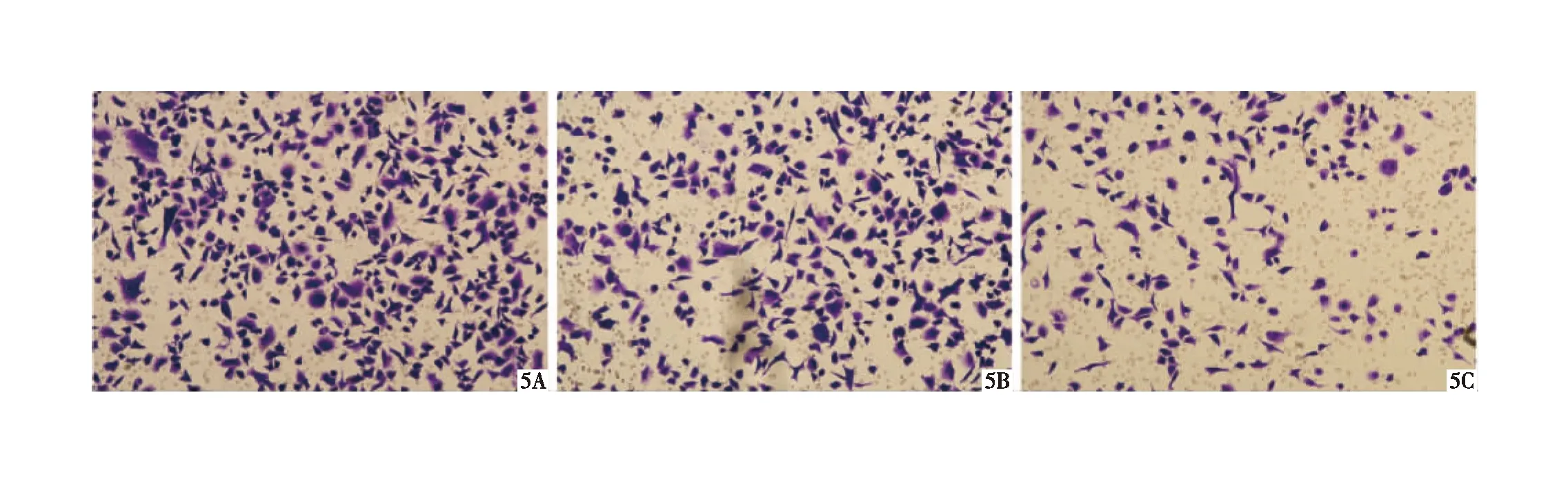
图5 基因型G/G(A)、基因型G/T(5B)及基因型T/T(5C)的CD133+结肠癌细胞侵袭情况(HE ×100)
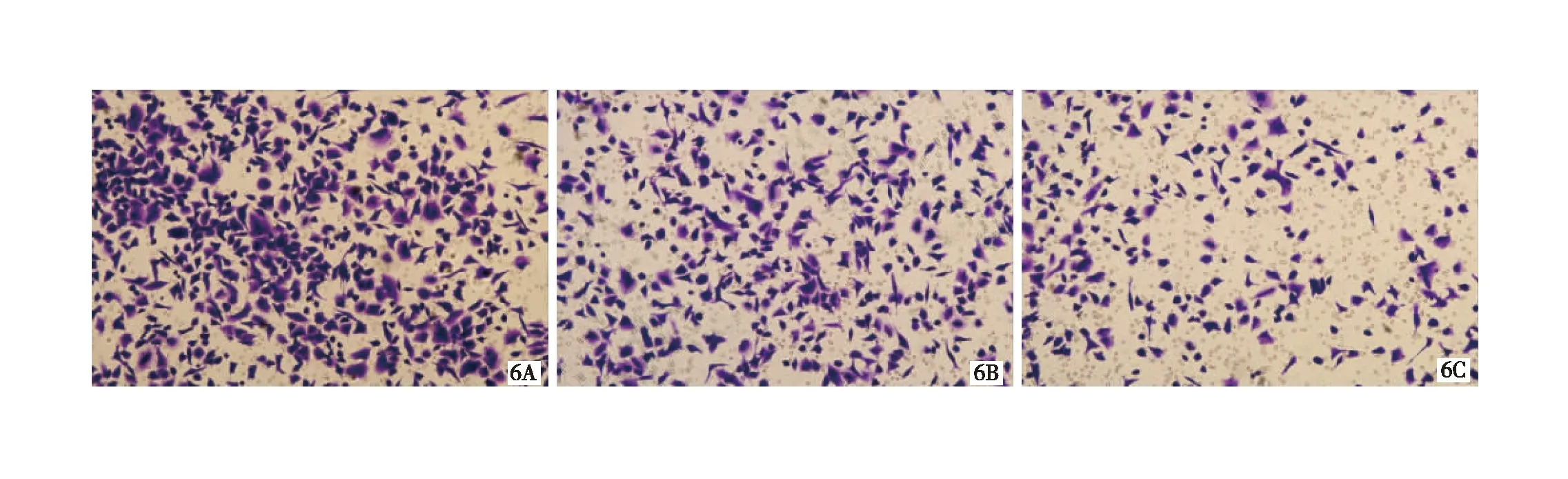
图6 基因型G/G(6A)、基因型G/T(6B)及基因型T/T(6C)的CD133+结肠癌细胞迁移情况(HE ×100)

图7 基因型G/G(7A)、基因型G/T(7B)及基因型为T/T(7C)的CD133+结肠癌细胞迁移划痕情况
2.4 细胞毒力对比 NK-92细胞对基因型为G/G的CD133+结肠癌细胞细胞毒力最弱,而对基因型为T/T的CD133+结肠癌细胞细胞毒力最强(P<0.05),见表2。

表2 NK-92细胞对不同基因型CD133+结肠癌细胞毒力对比
3 讨论
结直肠癌的发生发展是一个动态连续而复杂的过程,转移、复发是临床治疗失败和患者死亡的重要原因。目前对恶性肿瘤发病机制尚不完全明确,但有研究证实,恶性肿瘤组织内具有干细胞特性的细胞能够在自我更新及分化的同时,逃避机体免疫、抵抗常规放疗化疗等治疗措施,是致使恶性肿瘤治疗不彻底甚至出现复发及转移的主要原因之一[9]。为更好地控制恶性肿瘤的生长、提高恶性肿瘤的治疗效果,越来越多的研究学者指出应将基因组数据和免疫表型相结合,研究全身和局部抗肿瘤免疫特性,充分利用基因、免疫转化医学,根据患者具体基因类型及免疫表型设计个体化靶向抗血管生成、免疫等治疗方案,提高结直肠癌患者的整体生存率[10-11]。
正常的肠组织由交替排列的分化成熟的微绒毛组织和具有活化、分裂能力的隐窝组织组成,隐窝内干细胞接受活化信号后由隐窝基底部逐渐向顶部迁移,并分化为成熟的肠上皮细胞,在此期间一旦肠上皮细胞出现过度增殖或分化障碍即会导致肿瘤的发生[12]。肿瘤的免疫逃逸受机体内NK细胞、调节性T细胞(regulatory t cells,Treg)、肿瘤相关巨噬细胞(tumor associated macrophages,TAMs)、树突状细胞(dendritic cells,DC)等多种免疫细胞影响,最终使肿瘤细胞逃脱机体免疫监视及杀伤[13]。随着研究的不断深入,研究学者发现CD133除表达于多种正常上皮、内皮干/祖细胞外,还表达于胶质瘤干细胞、肝癌干细胞、前列腺癌干细胞、肺癌干细胞、结肠癌干细胞等多种组织来源的肿瘤细胞,且其表达水平与肿瘤细胞的放化疗抵抗性以及复发、转移等预后密切相关[14]。贾王强等[15]的研究显示[15],结直肠癌组织内CD133的表达水平显著高于正常组织,并且与CD133-肿瘤细胞相比,CD133+肿瘤细胞具有更强的肿瘤形成能力;与CD133-肿瘤细胞相比,CD133+肿瘤细胞内上皮-间质转化及侵袭相关基因的表达水平明显升高,且位于CD133基因3-UTR区域的单核苷酸多态性位点可能会通过影响与miRNA的相互作用而影响基因的表达调控,参与肿瘤细胞的免疫逃逸[16];3-UTR区域单核苷酸多态性位点rs2240688等位基因G是多种恶性肿瘤发生的风险因素[17-18]。
研究结直肠癌组织中CD133的多态性及其在肿瘤逃逸机制中的作用可能有助于为单克隆抗体靶向治疗等免疫治疗对恶性肿瘤疗效不佳提供新的解释,为提高免疫治疗的疗效提供新的研究思路。相关研究发现,肿瘤细胞可通过分泌免疫抑制因子、共刺激分子表达缺失、通过Fas/FasL途径诱导淋巴细胞凋亡等多种方式逃避免疫监视及攻击[19-20]。CD133编码基因位于人类染色体4p15上,被认为是与癌症易感性密切相关的区域,其编码蛋白CD133与细胞增殖、分化、凋亡等密切相关[21]。本研究结果显示,基因型为G/G的CD133+结肠癌细胞侵袭迁移能力最强,而基因型为T/T的CD133+结肠癌细胞侵袭迁移能力最弱;NK-92细胞对基因型为G/G的CD133+结肠癌细胞的细胞毒力最弱,而对基因型为T/T的CD133+结肠癌细胞的细胞毒力最强。研究再次证实了等位基因G是结肠癌发生及发展的危险因素,其高表达能够提高机体的免疫逃逸能力,可作为靶向治疗的新靶点进行深入研究,且G/G基因型CD133+结肠癌细胞对NK-92细胞毒力耐受性更强,考虑与miRNA序列改变导致的脱靶有关,具体作用机制有待后续深入研究探讨。
综上所述,CD133+结肠癌细胞3-UTR区域单核苷酸多态性位点基因多态性能够参与机体的免疫逃逸,对CD133+肿瘤干细胞进行深入研究,有望成为结直肠癌临床治疗的新靶点,为结直肠癌的治疗提供更彻底的方案。另外,CD133-结肠癌细胞rs2240688位点不同基因型是否也同样参与了机体的免疫逃逸,与CD133+结肠癌细胞在表型方面及对免疫逃逸的影响是否存在本质不同也需后续研究继续探讨。
