结肠炎相关性结直肠癌药物预防及机制的研究进展
2023-09-15郑正江滨
郑正, 江滨
结直肠癌(colorectal cancer,CRC)发病率占全球肿瘤发病率的第三位,死亡率是恶性肿瘤死亡原因的第二位[1]。根据炎性反应与结直肠癌的关系差异,将结直肠癌分为两类,即散发性结直肠癌(sporadic colorectal cancer,SCRC)与结肠炎相关性结直肠癌(colitis-associated colorectal cancer,CAC),两者在基因表达的频度和时间上均存在差异,包括APC,KRAS和TP2等[2]。结肠炎相关性结直肠癌的发生通常与炎症性肠病(inflammatory bowel disease,IBD)有关,其中以溃疡性结肠炎(ulcerative colitis,UC)为主[3],疾病危险程度与炎症严重程度、病变持续时间、病变累及范围等有关,发病机制涉及“炎症-增生-癌变”,涵盖Wnt/β-catenin、COX-2/PGE2、NF-κB、IL-6/STAT3等信号通路。1990年至2019年,中国女性与男性IBD标准化发病率分别增加约1.14倍和0.99倍,病例数增加了约3倍[4]。同时中国溃疡性结肠炎患者结肠癌和直肠癌的风险分别增加了12.12倍和4.81倍,远高于西方国家Meta分析所报告的标准化发病率2.39[5]。目前,CAC除手术外没有其他有效手段,而CAC患者存在肠道慢性炎症与全身性免疫功能紊乱,手术风险更大,术后恢复相较于CRC患者存在更多问题,预后较差。越来越多的学者正通过对CAC发生机制的不断探索,寻找对CAC有预防作用的药物以减少其发生。本文就CAC的药物预防及预防机制进展做一综述。
1 水杨酸类
水杨酸类药物是非甾体类抗炎药(nonsteroidal antiinflammatory drugs,NSAID)的一种,包括5-氨基水杨酸(5-aminosalicylic acid,5-ASA)、阿司匹林等具有解热镇痛作用的药物。5-ASA可以通过降低氧化应激、抑制细胞增殖、调控β-catenin和促进细胞凋亡等作用来抑制CAC发生[6],2017年ECCO指南指出使用5-ASA对UC引起的CAC进行化学预防是合理的[7]。虽然5-ASA对CAC的临床研究已接近30年,但对CAC的预防作用仍存在分歧(见表1)。这可能与以下问题相关:①IBD的类型:虽然克罗恩病(crohn’s disease,CD)与UC均属于IBD,但在肠道表现及严重程度方面存在明显差异。②病情的严重程度:CAC的发生与炎症性肠病的严重程度相关,大多持续使用5-ASA的患者病情往往更为严重,也更可能出现癌变的倾向。③发现CAC前药物的使用时间:文献中报道患者罹患CAC前使用5-ASA的时间长短不一,从6个月至2年不等。④研究的方法:在进行病例对照时,有些研究者关注使用5-ASA的患者是否出现CAC,也有研究者关注CAC患者是否在发现前使用5-ASA。而对AOM/DSS诱导的CAC模型小鼠作用的研究最早开始于横滨市立大学,在2007年的一份报告中提到5-ASA可以抑制AOM/DSS诱导的小鼠CAC[8],次年美国的一项研究也证明低剂量5-ASA可以有效预防小鼠结肠炎相关异型增生[9]。而阿司匹林作为最常用的水杨酸类药物,在降低结直肠癌的发病风险方面已经得到了许多研究的证实[10-11],但临床研究中阿司匹林对CAC的预防作用仍存有疑问。动物实验证明阿司匹林干预对CAC模型小鼠有保护作用。De Matteis等[12]通过予AOM/DSS模型小鼠阿司匹林灌胃,证明阿司匹林对于CAC模型小鼠的保护作用可能通过调节结直肠组织中巨噬细胞的募集和表型,并减少巨噬细胞和CD8+ T细胞中程序性死亡受体1的表达来实现。日本铃鹿医科大学在一项研究中发现,阿司匹林可能通过降低环氧合酶2和活性氧的水平,进而减少Yes关联蛋白1及DNA损伤等诱发的CAC[13]。此外,Feng等[14]发现阿司匹林可以通过抑制Wnt信号通路从而减少AOM/DSS诱导的CAC模型小鼠的肿瘤数量。但阿司匹林预防CAC的发生仍存在问题,阿司匹林对CAC作用的临床研究较少,而动物实验的文章均未提及动物肠道症状的改变,考虑到阿司匹林等NSAID可能会引起IBD疾病活动度的增加[15],未来的研究应当关注肠道症状的变化。通过进一步研究阿司匹林对CAC的保护机制,更多的下游产物可能会被发现对CAC起保护作用,且具有更少的不良反应。
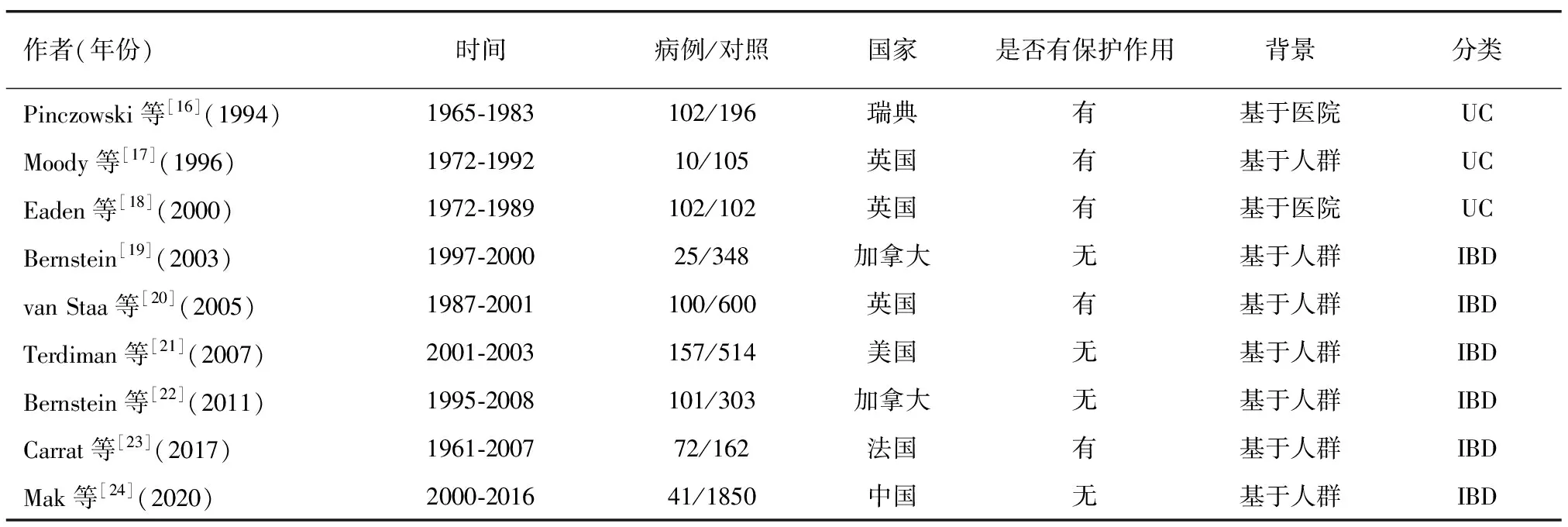
表1 5-氨基水杨酸对结肠炎相关性结直肠癌保护作用的相关研究
2 免疫抑制剂
常见的免疫抑制剂包括硫唑嘌呤、6-巯基嘌呤等,主要在次黄嘌呤磷酸核糖基转移酶(hypoxanthine phosphoribosyl transferase,HPRT)的作用下生成硫代肌苷酸,继而通过次黄嘌呤核苷酸脱氢酶生成硫鸟嘌呤核苷酸三磷酸(thioguanosine-triphosphate,TGTP)发挥作用。但因存在骨髓抑制等不良反应而不作为IBD的首选药物,常用于激素依赖性或5-ASA治疗无效的UC患者的临床缓解[25]。硫嘌呤类药物对CAC的影响仍存在争议,Zhu等[26]的一项Meta分析表明硫嘌呤类药物可以降低IBD患者结直肠肿瘤的风险,而法国的一项病例对照研究[23]则否认了硫嘌呤类药物的影响,这可能与使用硫嘌呤的患者病情严重程度有关。而在动物实验中,Sheng等[27]报道使用硫鸟嘌呤(tioguanine,TG)灌肠处理CAC模型小鼠完全阻止了CAC的发生。与硫唑嘌呤不同,TG仅在HPRT的作用下就可生成TGTP,TG的局部给药通过抑制经典β-catenin信号传导,降低CAC发生与发展的风险,同时局部给药的方式没有出现显著的全身毒性。总之,目前还没有足够的临床证据推荐免疫抑制剂作为CAC化学预防药物[7],但TG的使用为免疫抑制剂在预防CAC的用法上提供了新的思路。
3 益生菌
近几年,肠道菌群一直是研究的热点,益生菌可以通过改善肠道微生物群、调节代谢、减少NF-κB的过度激活等方式发挥抗癌作用[28]。VSL#3是由8种菌株组成的商业复合益生菌,Bassaganya-Riera等[29]认为VSL#3可以通过调节肠系膜淋巴结与结肠固有淋巴细胞中的Th27和Treg比例从而预防小鼠CAC的发生。此外,VSL#3还可能通过下调IL-6、TNF-α等炎性因子以及调节Wnt/β-catenin通路等方式对AOM/DSS诱导的小鼠CAC起保护作用[30-31]。除了口服益生菌混合物,单一益生菌的肠道定植也被证明有效。Zegarra Ruiz等[32]在小鼠造模的第一个DSS周期前予小鼠大肠杆菌541-15定植,实验结束时发现干预小鼠结肠内肿瘤数量及大小较对照组明显减少,这可能是因为大肠杆菌541-15通过诱导CX3CR1+巨噬细胞产生IL-10,触发上皮修复功能。总之,益生菌可以通过改善肠道菌群、调控淋巴细胞比例、抑制炎症因子、调节细胞增殖等方式预防CAC的发生,但微生物群种类复杂且在肠道中的比例多变,对于肠道菌群在预防CAC中的作用与机制仍需更深入的探索。
4 中药方剂及中药提取物
中药方剂具有多成分、多靶点的特征,可以通过调节细胞凋亡[33]、改善肠道菌群[34]、抑制炎症[35]等方式预防CAC。同时,通过对于预防CAC有效中药方剂的进一步解析,可以发现相较于中药方剂,更加稳定和成分明确的中药提取物,对进一步明确中医药预防CAC的机制及疗效有重要作用。黄芩汤有清热止痢之效,动物试验证明对DSS诱导的小鼠结肠炎有治疗效果[36-37]。Ma等[38]的研究发现,将高剂量的黄芩汤给AOM/DSS诱导的小鼠灌胃,小鼠DAI评分明显降低,肠道组织炎症较对照组也有明显改善,蛋白质组学分析表明黄芩汤可以抑制细胞周期蛋白D依赖性激酶活性,进而抑制小鼠CAC的发生。Pan等[39]也报道,黄芩汤可以通过控制肽基精氨酸脱氨酶4依赖性中性粒细胞胞外杀菌网络,来抑制小鼠CAC的进展。而黄芩作为黄芩汤的君药,其主要成分包括黄芩苷等[40]。黄芩苷被证明可以通过调控NF-κB、Wnt等与肿瘤相关的信号通路,预防AOM/DSS模型小鼠CAC的发生[41-42]。随着研究者们对中医药的重视,许多其他传统中药方剂及中药提取物,诸如藿香正气散[43]、芍药汤[44]、三七皂苷[45]、羊蹄萃取物[46]等均被证明对CAC小鼠有保护作用,表明中药方剂及提取物作为CAC预防手段有广阔应用前景。中药方剂及中药提取物在临床应用的研究相对有限,而动物模型尚不能完全模拟中医临床的证型和疾病的变化发展,大多研究没有建立干预药物与对照药物的浓度梯度,无法显示中药方剂的疗效和量效关系,因此向临床推广应用的过程中仍需更加深入的研究。
5 间充质干细胞
间充质干细胞(mesenchymal stem cell,MSC)是起源于中胚层具有自我更新和多向分化潜能的细胞群,因具有独特的免疫调节功能而被用于克罗恩病肛瘘等免疫系统疾病的治疗,但MSC对肿瘤的影响存在争议[47]。大多数研究者认为,MSC的干预促进结直肠肿瘤的生长与转移[48-50],然而在AOM/DSS诱导的CAC实验动物身上并非如此(见表2),所有的相关实验均发现使用MSC的CAC动物相较于对照组体重下降减少,结肠长度增加,肠道内CAC数量减少。MSC对CAC的预防及保护机制可能包括减少促炎细胞因子释放和STAT3活化[51]、促进β连环蛋白的磷酸化[52]、介导Smad2诱导的Treg分化[53]、增加肠道有益菌的丰度等[54]。另一方面,MSC的修饰也是未来发展的方向,CAC模型小鼠肠道炎症组织中基质细胞衍生因子1表达增加,通过慢病毒转导,使MSC表面过表达趋化因子受体4,可以增强MSC对基质细胞衍生因子1的趋化性和侵袭性,进而提升其对CAC的保护作用[55]。但相关实验在MSC的使用剂量方面存在差异,也缺乏对药物浓度梯度的研究。此外,MSC来源的外泌体也具有与MSC相同的治疗作用,研究发现人脐带来源的MSC外泌体通过抑制SUMO1蛋白的表达,减少SUMO1蛋白与β-catenin的结合,从而预防模型小鼠CAC的发生[56],但仍缺乏更多的证据证明MSC来源的外泌体对AOM/DSS诱导的动物模型的作用。近年来随着MSC商品化进程的加快与细胞的制备技术方面的日益成熟,越来越多的研究者开始投入MSC的研究中,但在使用的途径、方式、剂量等方面仍需深入探索,同时MSC对CAC模型动物长期生存的影响也缺乏必要的研究。
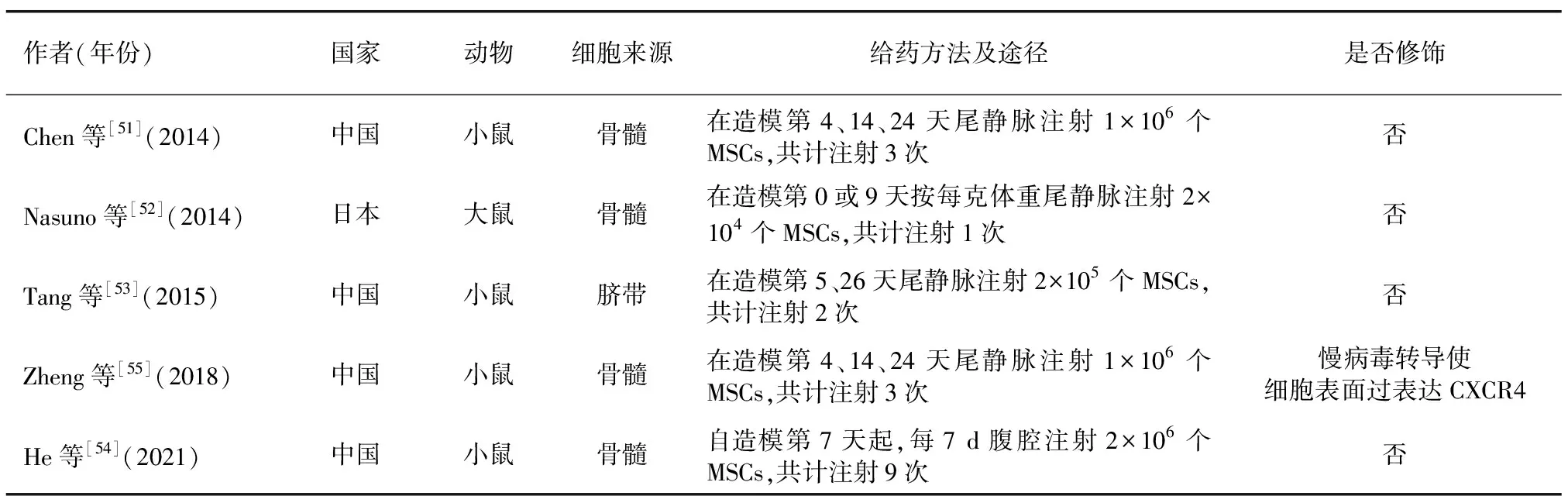
表2 间充质干细胞对结肠炎相关性结直肠癌动物模型的保护作用相关研究
6 其他
除了上述治疗之外,Irrazabal等[57]发现N乙酰半胱氨酸等抗氧化剂可以减少炎症小鼠8-氧鸟嘌呤DNA损伤,从而减少CAC的发生。日本国立癌症研究中心的一项实验显示,环丙沙星等抗生素可以通过抑制异常DNA甲基化从而对AOM/DSS诱导的小鼠CAC起保护作用[58],但抗生素的长期使用可能会引起CRC发生风险的增加[59]。
7 总结与展望
综上所述,CAC是近年来的研究焦点,通过临床病例对照研究及对动物模型采取不同的干预措施,已发现多种药物对CAC可能存在预防作用。在本文提到的药物中,中药及MSC都具有巨大的挖掘潜力,尤其是两者的联合应用,已有研究证明人参皂苷Rg1联合脂肪间充质干细胞可以增强抗DSS诱导的小鼠结肠炎的作用[60]。此外,MSC来源的外泌体相较于MSC更加稳定和安全,降低了致瘤的可能[61],是CAC预防及治疗的新方向。但上述所有药物除了5-氨基水杨酸、免疫抑制剂等用于IBD治疗的药物已用于临床研究,大多数药物仍仅处于动物实验阶段,对于药物的使用剂量、方法及量效关系尚没有明确的标准。今后需将动物实验的成果向临床推进,同时应当继续对现有药物对CAC的保护机制及使用剂量做更深入的研究,并开发更多疗效确切的药物。
