羟基化多壁碳纳米管吸附硼的研究
2023-09-15崔香梅郭祖鹏马磊
崔香梅,郭祖鹏,马磊
(青海大学 化工学院,青海 西宁 810016)
硼化合物,具有诸多优异性能,在国防、航空、医药、制造等多领域用途广泛[1-3]。但过量硼的存在或摄入却会对人、水体、动植物等带来危害。盐湖卤水中提取高纯锂盐也需深度除硼。因此,溶液中硼的分离具有重要意义。吸附法是依托吸附剂的含羟基基团与硼酸或硼氧配阴离子络合而分离硼的有效手段[4-5]。以活性炭、氧化石墨烯或碳纳米管为基体的碳基吸硼剂是其中一类[6-7]。碳纳米管的高比表面积与高热稳定性[8],使其在吸附领域具有良好应用潜力。本文探究了羟基化碳纳米管对水中硼的吸附性能。
1 实验部分
1.1 试剂与仪器
羟基化多壁碳纳米管(98%),由中国科学院成都有机化学有限公司提供;硼酸,分析纯。
SHA-B双功能水浴恒温振荡器;GZX-9030 MBE数显鼓风干燥箱;PHS-3C pH计;JEM-2100F 高分辨透射电子显微镜系统;D/max2500PC X射线衍射仪;Nicolet 6700傅里叶红外光谱仪;ICAP6300电感耦合等离子发射光谱仪。
1.2 实验方法
量取适量CNTs-OH和1 000 mg/L的H3BO3溶液于离心管中混合后以相同频率在恒温振荡器中振荡一定时间。吸附结束后,用一次性针筒过滤器(孔径0.45 μm)过滤混合溶液,再用ICP测定吸附后清液中硼元素浓度。依次研究溶液pH和初始硼浓度、吸附时间、温度、CNTs-OH投加量等因素对羟基化多壁碳纳米管吸附硼的影响。
吸附剂对硼的吸附容量qe和硼吸附率计算公式如下[9]:
(1)
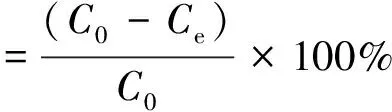
(2)
式中,C0为初始硼浓度,mg/L;Ce为吸附平衡时的硼浓度,mg/L;V为溶液体积,L;m为吸附剂的投加量,g;qe为平衡吸附容量,mg/g。
2 结果与讨论
2.1 CNTs-OH对不同浓度硼的吸附
在50 mL离心管中加入0.1 g CNTs-OH,并加入20 mL不同浓度H3BO3溶液,室温下恒温振荡20 h,后移取上清液用ICP测定硼浓度,结果见图1。
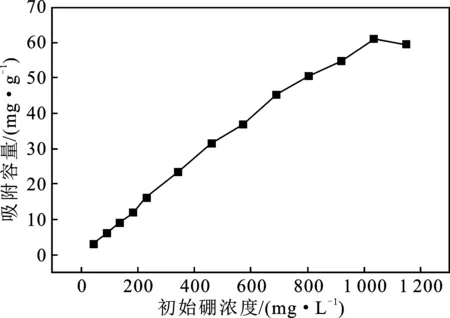
图1 CNTs-OH对不同浓度硼的吸附规律Fig.1 Adsorption law of CNTs-OH on boron in different concentration solutions

Langmuir模型和Freundlich模型的拟合分析(表1、图2)的R2分别为0.948 24和0.996 45,说明Freundlich模型更适于描述CNTs-OH与溶液中硼的吸附作用。同时,吸附强度异质性因子为1.066,说明该吸附作用介于易吸附和难吸附之间,具有中等吸附能力[10]。

表1 吸附等温线模型的拟合数据Table 1 Fitting data of adsorption isotherm model

图2 Langmuir模型(a)和Freundlich(b)模型拟合结果Fig.2 Fitting results of Langmuir model (a) and Freundlich model (b)
2.2 CNTs-OH对不同pH下硼的吸附
用稀HCl溶液和NaOH溶液调节含1 038.5 mg/L 硼溶液的酸度,加入吸附剂0.1 g,密封, 25 ℃下振荡吸附20 h,结果见图3。
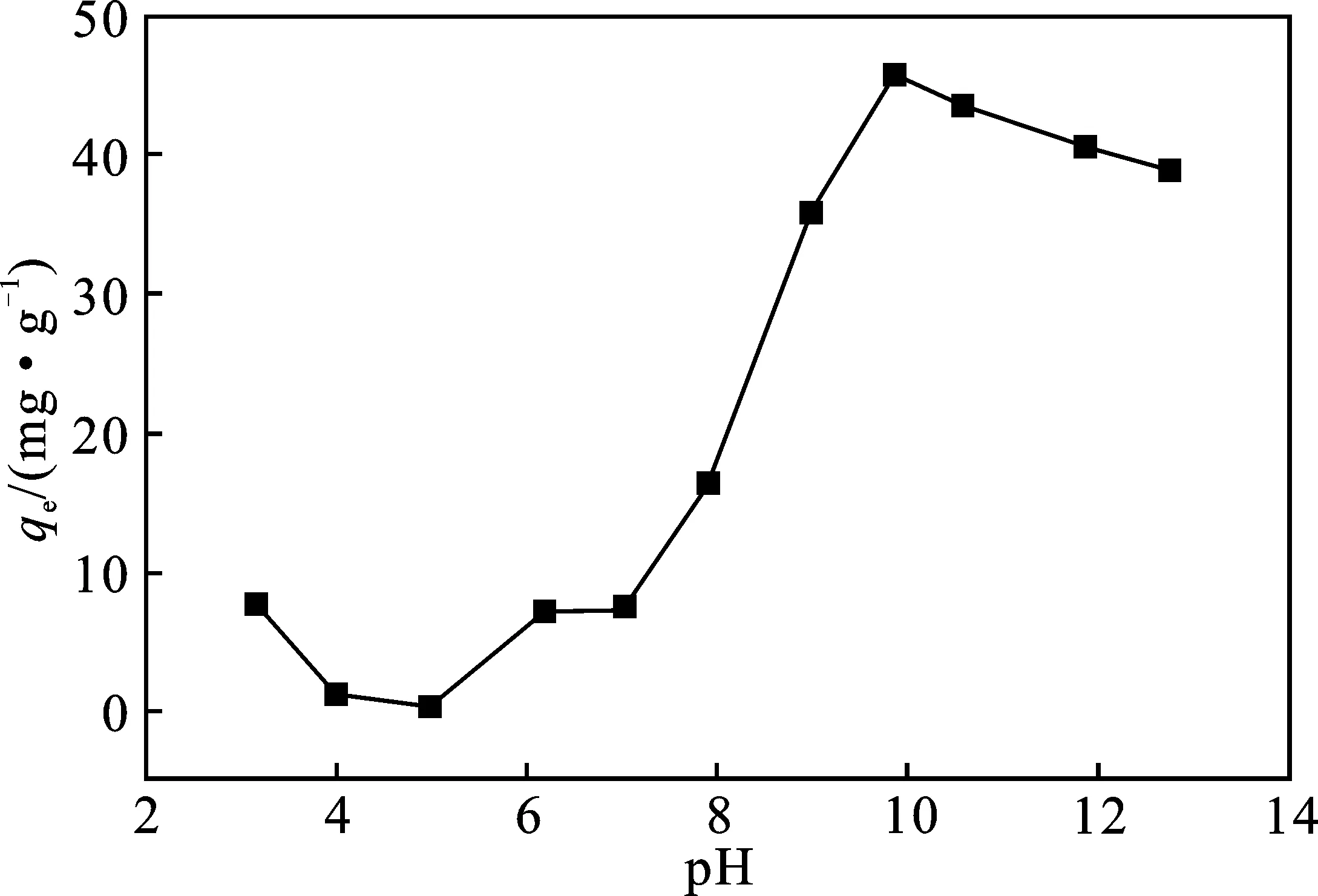
图3 pH对CNTs-OH吸附硼的影响Fig.3 Effect of pH on the adsorption of boron on CNTs-OH
受到硼浓度和溶液pH 等多种因素影响,硼在水溶液中存在形式复杂[11]。由图3可知,pH对CNTs-OH吸附硼影响显著。随着pH逐渐增大,CNTs-OH对硼的吸附量大体趋势为先增加再减小,碱性条件更有利于CNTs-OH吸附溶液中的硼,pH=9.83时吸附量达到最高,为45.82 mg/g。
2.3 不同时间内CNTs-OH对溶液中硼的吸附
在硼浓度为1 140.25 mg/L、pH值为10.09的溶液中加入0.1 g CNTs-OH进行吸附,结果见图4。

图4 不同时间内CNTs-OH对溶液中硼吸附效果Fig.4 Effect of time on the adsorption of boron on CNTs-OH
由图4可知,吸附量qe随着时间延长呈现先显著增加、后平稳不变的趋势:0~30 min内吸附量qe呈指数型增加至17 mg/g左右,之后基本保持不变。这是由于吸附剂上的有效吸附位点在短时间内与硼相结合达到饱满,从而吸附量迅速增加至极值后保持恒定。
2.4 CNTs-OH用量对溶液中硼吸附的影响
在20 mL pH为10.02、硼浓度为1 038.5 mg/L的若干个平行溶液中加入不同质量的CNTs-OH进行吸附,结果见图5。

图5 CNTs-OH投加量对硼吸附的影响Fig.5 Effect of CNTs-OH dosage on boron adsorption
由图5可知, CNTs-OH用量不断增加,吸附量qe不断减小,但硼吸附率呈现基本不变趋势,稳定在14.0%左右。因此,CNTs-OH加入量对其吸附硼的效果并没有增强作用。相同浓度硼溶液中加入0.039 7 g和0.300 7 g CNTs-OH,从硼吸附率角度来看其吸附效果基本一致。然而,加入0.039 7 g CNTs-OH的平衡吸附量却是加入0.300 7 g CNTs-OH的约8倍。由此可以认为,加入相对较少量的CNTs-OH不仅能够保证吸附效果,且更为经济。
2.5 温度对CNTs-OH吸附硼的影响
在20 mL pH为10.09、硼初始浓度为1 140.25 mg/L 的溶液中加入0.1 g CNTs-OH,在不同温度下吸附180 min,结果见图6。

图6 温度对CNTs-OH吸附硼的影响Fig.6 Effect of temperature on boron adsorption by CNTs-OH
由图6可知,随着温度的升高CNTs-OH对硼的吸附量有所提高,但提高程度并不明显。温度从290.65 K提高到308.15 K,平衡吸附量从18.321 7 mg/g 增加到20.287 7 mg/g,温度提高17.5 K平衡吸附量仅增加了1.966 mg/g,增幅为10.73%。温度达到323.15 K时CNTs-OH对硼的吸附量基本保持恒定。因此,为降低能耗,宜采用室温吸附。
2.6 吸附前后CNTs-OH的表征结果

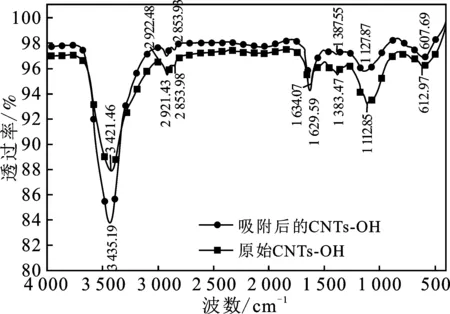
图7 CNTs-OH吸附硼前后的红外光谱Fig.7 FTIR of CNTs-OH before and after boron adsorption
2.6.2 X 射线光电子能谱分析(XPS) 吸附前后的CNTS-OH吸附剂待干燥研磨后用XPS做元素分析,结果见图8。
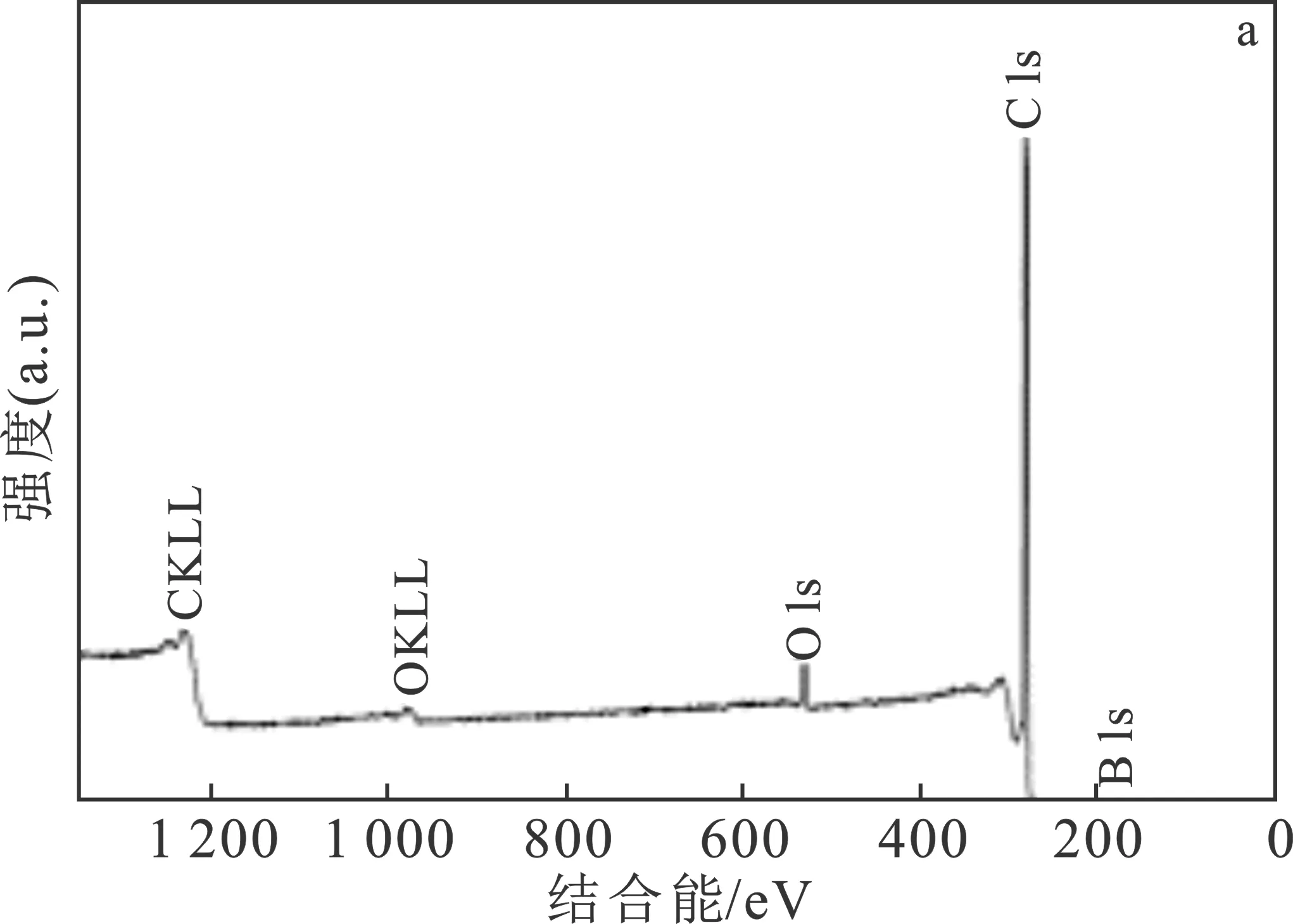
图8 吸附硼后CNTs-OH吸附剂的 XPS 图谱Fig.8 XPS spectra of CNTs-OH adsorbent after boron adsorption
图8a为XPS全谱。其中,结合能约为190,284,533 eV附近的峰分别对应B 1s,C 1s和O 1s (10.1002/ange.201310260)。此外,在977 eV和1 226 eV 附近的峰分别对应O KLL和C KLL的俄歇峰 (10.1039/B617697F;10.1021/acssuschemeng.9b00135)。

2.6.3 透射电镜分析(TEM) 图9为CNTs-OH吸附硼前后的透射电镜照片。

图9 吸附前(a,b)后(c,d)CNTs-OH的 TEM 照片Fig.9 TEM images of CNTs-OH before (a,b) and after (c,d) boron adsorption
由图9可知,吸附前后羟基化多壁碳纳米管微观形貌基本未发生改变,呈现为中空管状结构,端口呈封闭状态,相互缠结形成复杂的网状结构,这是因为CNTs-OH管长较长,碳纳米管束间存在较强的范德华作用力。与XPS结果联合分析,认为吸附后碳纳米管外壁突出部分应为吸附的硼。
3 结论
(1)XPS、FTIR、TEM等测试结果表明,羟基化多壁碳纳米管对水溶液中的硼具有一定的吸附作用,可作为潜在的硼吸附剂。
(2)单因素静态吸附实验结果表明,温度升高有利于吸附,吸附剂投加量并不会增加吸附量,溶液硼浓度1 000 mg/L、pH 10、吸附30 min 时吸附效果较好。
(3)XPS分析和热力学模拟结合,羟基化多壁碳纳米管对水溶液硼吸附属于化学吸附,吸附作用符合Freundlich模型,理论吸附量可达206.61 mg/g。
