氯盐型融雪剂用高效复合缓蚀剂的性能研究
2023-09-15胡超鹤杭智军王媛
胡超鹤,杭智军,王媛
(煤炭科学技术研究院有限公司 矿用材料分院,北京 100013)
融雪剂是最有效的融雪除冰措施之一。据统计,我国每年的融雪剂使用量就高达60万吨[1],其中绝大多数是以氯化钠、氯化钙为主要成分的氯盐型融雪剂。氯盐型融雪剂具有布施简便、除冰速度快、成本低、易获得等优势,但它的大量使用同时也带来了一系列负面问题。融雪剂中的氯盐会在与雪水混合后渗入公路、桥梁等内部,对其中的钢铁结构造成严重的腐蚀破坏,大大降低了公路、桥梁的使用寿命。针对此类问题,近年来各国研究人员已陆续开发出多种新型非氯融雪剂[2-3],但由于其成本较高,融雪化冰能力也相对不足,仍无法替代传统的氯盐型融雪剂。
目前最实用、有效的方法是使用缓蚀剂以抑制金属在高氯离子环境下的腐蚀[4-5]。钼酸盐[6]、亚硝酸盐[7]、硼酸盐[8]等已经被实验证明可在一定程度上减缓金属的腐蚀,作为缓蚀剂被应用于相关产品中,但其单一使用效果不佳,往往需要大量添加才能起到缓蚀效果,这也直接导致了综合成本的升高。基于此,本研究针对氯盐对金属的腐蚀特点,开发了一种高效的复合缓蚀剂。相比于其他单一缓蚀剂,该缓蚀剂在低添加量下即能有效抑制高浓度盐水环境中的碳钢锈蚀。并通过对腐蚀实验中碳钢试片的表面形貌、接触角及电化学行为的分析,推测了该缓蚀剂的作用机理。
1 实验部分
1.1 材料与试剂
原盐(NaCl)、亚硝酸钠(NaNO2)、二水钼酸钠(Na2MoO4·2H2O)、六偏磷酸钠((NaPO3)6)、六次甲基四胺(C6H12N4)、盐酸(36.0%~38.0%)、氢氧化钠(NaOH),无水乙醇(C2H5OH),自制复合缓蚀剂。
冷却水化学处理标准腐蚀试片(20#碳钢,I型,50.0 mm×25.0 mm×2.5 mm),由江苏省高邮市摩天电子仪器有限公司提供。
实验所用去离子水为实验室自制(18.60 MΩ·cm-1,298 K)。
1.2 腐蚀介质溶液的配制
平行称取6份原盐(396 g)于烧杯中,向每份样品中加入1804 g去离子水,质量浓度为18%,分别向其中加入不同的缓蚀剂1.82g(亚硝酸钠、六偏磷酸钠、钼酸钠、六次甲基四胺、自制复合缓蚀剂),最后1份样品中加入等质量的去离子水作为空白对照。
1.3 碳钢腐蚀速率的测定
碳钢腐蚀实验依据国家标准GB/T 118175—2014及GB/T 23851—2017中相关规定进行。
将20#冷却水化学处理标准腐蚀试片以无水乙醇清洗、干燥、精确称量后,悬挂于旋转挂片腐蚀试验仪(RCC-III,江苏省高邮市摩天电子仪器有限公司)。调节水浴温度为40oC,挂片旋转速度83 rad·min-1,降下样品台,使碳钢试片完全浸没于预先配制的腐蚀介质中。48 h后取出试片,依次以1∶1盐酸溶液(含8 g·L-1六次甲基四胺)和NaOH溶液(浓度60 g·L-1)洗涤试片30 s,以除去表面腐蚀产物。以去离子水和无水乙醇冲洗,干燥后进行精确称量。每组实验平行测定3次。
碳钢试片在腐蚀介质中的碳钢腐蚀率(v,mm·a-1)定义为单位时间内试样的腐蚀深度,由式(1)表示,缓蚀率(η,%)定义为添加缓蚀剂的体系在一定时间内相比于空白对照组腐蚀速率减少的百分数,可由式(2)计算得出。
其中:m为试片的质量损失(g);m0为试片空白酸洗实验的平均质量损失(g);s为试片的表面积(cm2);ρ为试片的密度(g·cm-3);t为腐蚀实验的时间(h);v0为空白试验的试片腐蚀速率(mm·a-1);v1为试片的腐蚀速率(mm·a-1)。
1.4 表面形貌与元素分析
碳钢试片在添加与未添加自制复合缓蚀剂的18%盐水中浸泡48 h,洗涤干燥后,通过扫描电子显微镜(SEM,Gemini 300,ZEISS)对其表面形貌进行观察分析,通过能量色散谱仪(EDS,XPLORE30,OXFORD)对试片的表面元素组成进行分析。使用未经腐蚀的碳钢试片原片作为对照组。
1.5 接触角的测定
碳钢试片在添加与未将碳钢试片在含有自制复合缓蚀剂的18%盐水中浸泡48 h,洗涤干燥后,使用液像法界面张力仪(SL250,KINO)测量其表面的水接触角。未经腐蚀的碳钢试片原片作为对照组。
1.6 电化学分析
分别以添加与未添加自制复合缓蚀剂的18%盐水为腐蚀介质,使用电化学工作站(AUT90484,Metrohm Autolab)对碳钢在其中的极化曲线和电化学阻抗谱(EIS)进行测试。电化学测试采用三电极体系进行,其中碳钢试片为工作电极,电极面积为1 cm2,Ag/AgCl(饱和氯化钾溶液)为参比电极,石墨为辅助电极。在进行电化学测试前,预先将电极在腐蚀介质中浸泡30 min,以达到电化学平衡状态和稳定的开路电位(Eocp)。极化曲线扫描范围为Eocp~Eocp-400 mV(阴极极化曲线)和Eocp~Eocp+400 mV(阳极极化曲线),扫描速度1 mV·s-1。EIS测试在体系的Eocp下进行,激励电压振幅为10 mV,测试频率范围为10-1~105Hz。
2 结果与讨论
2.1 碳钢腐蚀实验分析
图1展示了碳钢试片在含有820 mg·L-1不同缓蚀剂的18%盐水中浸泡48 h后的锈蚀状况。可以看到,含有自制复合缓蚀剂的试片表面仍保持光亮,无明显锈蚀痕迹外,说明该缓蚀剂的添加能有效抑制高浓度盐水对金属的腐蚀。

图1 碳钢试片在含有不同缓蚀剂的盐水中的腐蚀状况Fig.1 Corrosion state of carbon steel in NaCl solution with different corrosion inhibitor
而其余试片表面均可观察到红褐色锈斑,表明缓蚀性能较差,无法对碳钢表面起到保护作用。其中,含有亚硝酸钠和钼酸钠的试片表面锈斑相较于无缓蚀剂的空白试样更多,这主要是由于亚硝酸盐和钼酸盐属于阳极型缓蚀剂,在较低的添加量下,钝化层无法完整地覆盖金属表面,而局部形成微小原电池,导致新的电化学腐蚀,加剧腐蚀介质对金属的破坏[9]。
为了进一步评价缓蚀剂的缓蚀性能,采用旋转挂片法腐蚀失重实验的结果来计算不同缓蚀剂的碳钢腐蚀速率和缓蚀率,结果如图2所示。碳钢腐蚀速率和缓蚀率的变化趋势与浸泡腐蚀实验中碳钢片的锈蚀程度一致,其缓蚀性由高至低依次为自制复合缓蚀剂、六偏磷酸钠、六次甲基四胺、亚硝酸钠、钼酸钠。值得注意的是碳钢试片在含有复合缓蚀剂的腐蚀介质中的腐蚀速率相比于未添加缓蚀剂的样品大幅降低,仅为0.0031 mm·a-1,其缓蚀率高达98.2%,充分表明了其显著的缓蚀性能。

图2 碳钢在含不同缓蚀剂的盐水中的腐蚀速率和缓蚀率Fig.2 Corrosion rate and corrosion inhibition efficiency of the carbon steel in the NaCl solution with different corrosion inhibitor
2.2 表面形貌与元素分析
图3为原始碳钢试片和在不同腐蚀介质中浸泡后的碳钢试片的SEM表面形貌图。可以清晰地观察到无处理的原始碳钢试片表面(图3(a))因机械加工而产生的规则沟痕,但经过在盐水中48 h的浸泡和清洗后(图3(b)),其表面的加工痕迹不可辨认。这主要是由于在腐蚀实验中,试片表面被严重腐蚀,而产生铁锈在清洗过程中被除去,因此其表面形貌被破坏。而相比之下,浸泡在含有复合缓蚀剂的腐蚀介质中的碳钢试片(图3(c))其表面抛光划痕维持较好,形貌无明显变化,这表明复合缓蚀剂在碳钢表面形成了均匀的保护层,能有效防止腐蚀的发生。
通过EDS可以对碳钢表面的元素组成进行分析,结果如图4所示。相比于原始碳钢试片(图4(a)),经过缓蚀剂处理的试片(图4(b))表面出现了少量P元素,这说明了含P钝化保护层的产生,进一步证明了复合缓蚀剂对碳钢表面的有效保护作用。

图4 在不同条件下处理的碳钢试片的EDS谱图Fig.4 EDS analysis of the carbon steel with different treatments
2.3 接触角的测定
图5展示了经过复合缓蚀剂处理前后,碳钢试片的表面水接触角的变化情况。其结果表明,在含有复合缓蚀剂的盐水中浸泡48 h后,碳钢试片的水接触角由93.15o显著降低至27.12o,说明其表面组成发生了较大变化,产生了亲水性更强的表面层。此结果与EDS表面元素分析的结果相符,进一步佐证了在复合缓蚀剂存在的环境中,致密惰性物质在金属表面沉积以隔绝腐蚀介质的缓蚀机理。
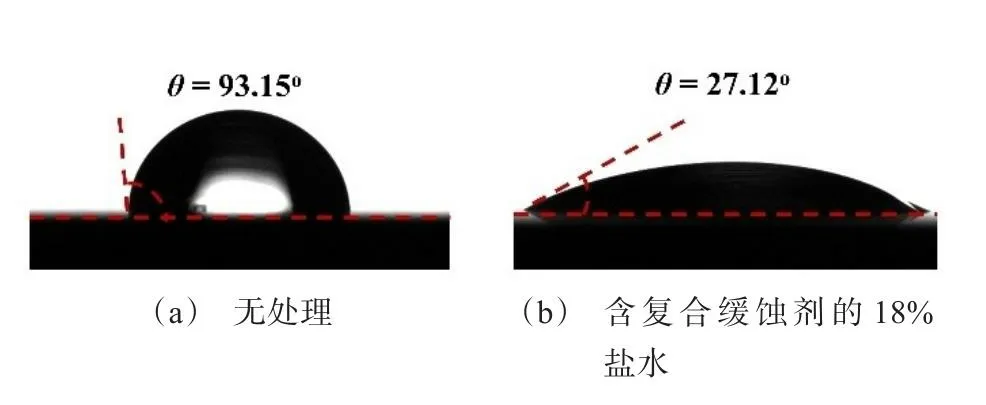
图5 在不同条件下处理的碳钢试片的表面水接触角Fig.5 Water contact angle of the carbon steel surface with different treatments
2.4 电化学分析
室温下碳钢在盐水腐蚀介质中的电化学极化曲线如图6所示。随着复合缓蚀剂的加入,极化曲线的阴极部分没有明显变化,说明其对腐蚀过程中的阴极反应影响有限。但极化曲线的阳极区向低电流区域移动,体系的腐蚀电流密度显著降低,这表明复合缓蚀剂对于腐蚀过程中的阳极反应有较强的抑制作用。而出现-0.494 mV至-0.385 mV的钝化区间说明了碳钢表面出现了致密的钝化膜,可以承受一定范围内的电压而不被击穿,这是复合缓蚀剂缓蚀性能良好的主要原因[10]。
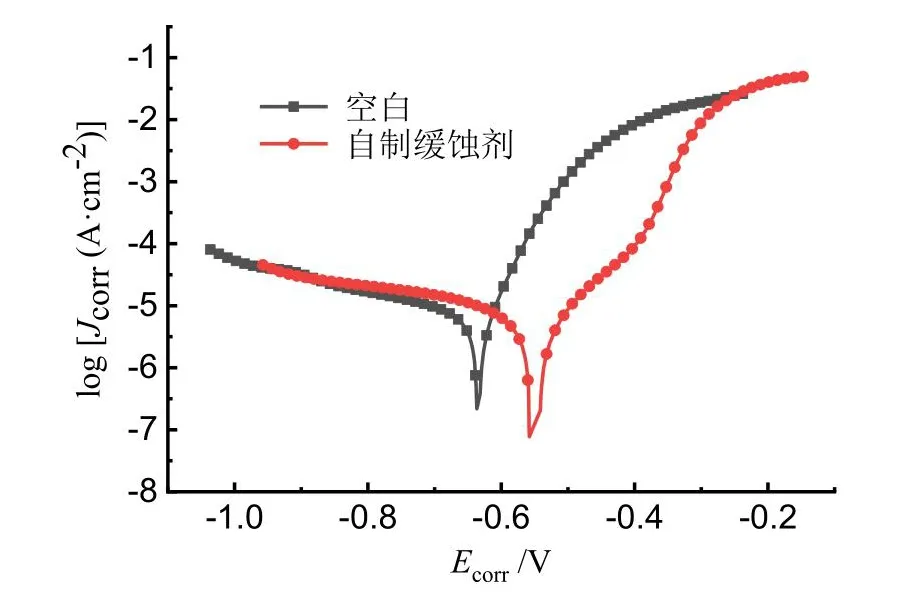
图6 室温下碳钢在盐水中的极化曲线Fig.6 Electrochemistry polarization curves of carbon steel in NaCl solution at room temperature
通过对极化曲线进行拟合可以获得相关的极化参数,如表1所示。其中:Ecorr表示体系的自腐蚀电位;Jcorr表示体系的自腐蚀电流密度;|βa|和|βc|分别为阴极和阳极的Tafel斜率。由表1可知,在体系中加入复合缓蚀剂后,自腐蚀电位正移约80.6 mV,这意味着钝化膜的产生使阳极区的氧化反应阻力增大,金属更难因失去电子而产生锈蚀[11]。而自腐蚀电流密度下降了约70%,仅为0.94 μA·cm-2,这也说明了复合缓蚀剂对碳钢在盐水体系中具有显著的腐蚀抑制作用。

表1 极化曲线拟合参数Tab.1 Fitting parameters of electrochemistry polarization curves
为了进一步阐释复合缓蚀剂的缓蚀机理,对含有和未含有复合缓蚀剂的盐水/碳钢体系的EIS进行测试,其结果如图7所示。两体系的Nyquist图(图7(a))并不是标准半圆,这可能是由于碳钢电极表面不完全平滑[12]。而其均表现为单一容抗弧特征,这表明电荷转移是碳钢在盐水中腐蚀的主要控制因素[13],而复合缓蚀剂不会影响电化学腐蚀反应的机理。随着复合缓蚀剂的加入,Nyquist图中容抗弧的直径在高频区显著增大,这表明在碳钢电极表面产生了钝化层,抑制了电化学腐蚀种的电荷转移,表现出缓蚀活性。从图7(b)中可以发现,加入复合缓蚀剂后体系的相角没有显著变化,这主要是由于所产生的钝化层厚度较小,没有明显改变碳钢的表面形貌[14],这与扫描电镜观察的结果(图3(a)和(c))相一致。从图7(c)可以看到,在复合缓蚀剂存在时体系在低频区的阻抗模量增加,这也说明了复合缓蚀剂的对金属的保护增强。
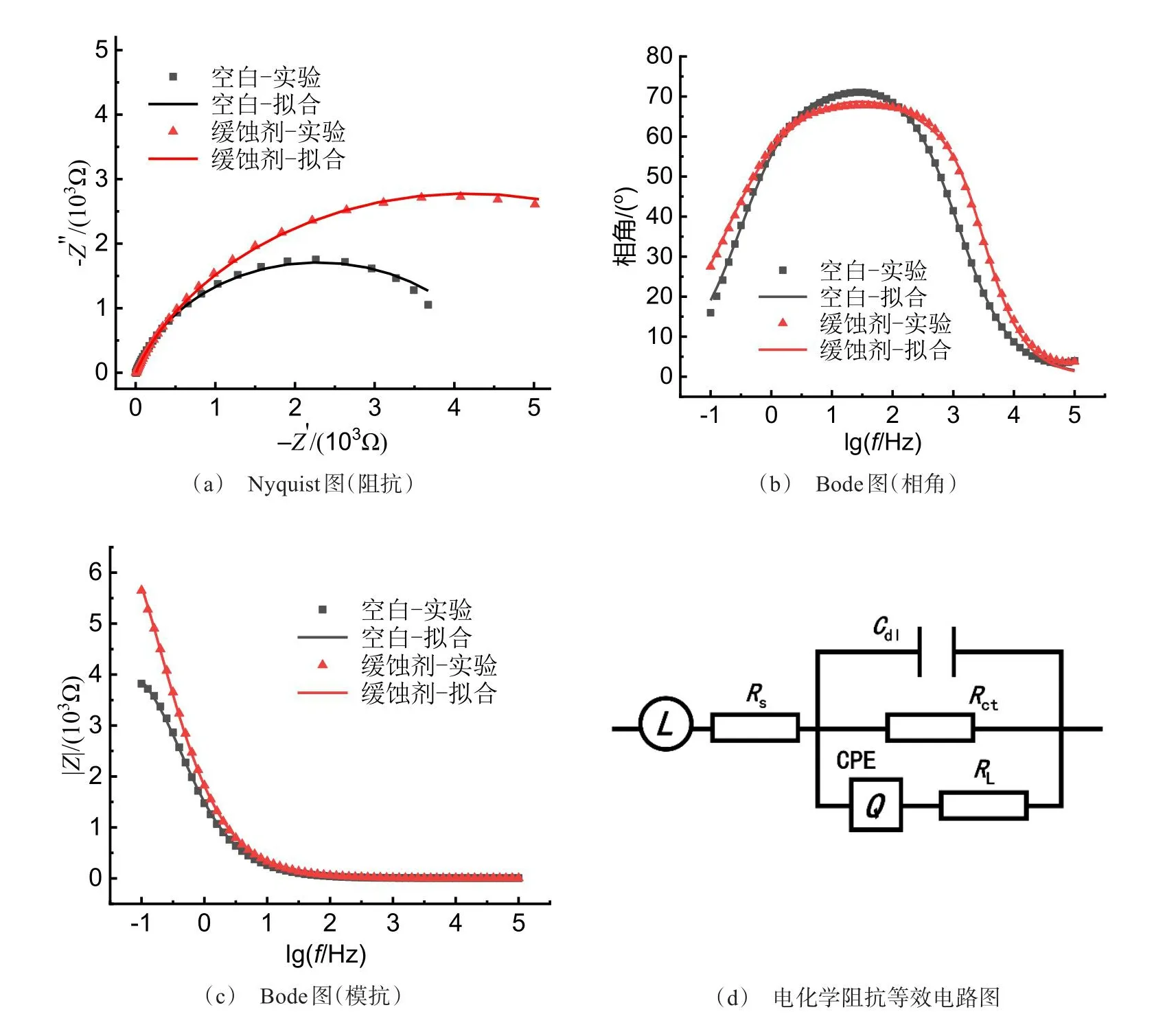
图7 室温下碳钢在盐水中的电化学阻抗谱Fig.7 EIS measurement and fitting results of carbon steel in NaCl solution at room temperature
根据盐水/碳钢体系的电化学阻抗谱特征,将碳钢的腐蚀简化为一个仅受电荷转移控制的过程,以(LR(CR(QR)))等效电路对EIS结果进行拟合,其相关拟合参数如表2所示,拟合结果与实验测试数据较为吻合。其等效电路图如图7(d)所示,其中:Rs为腐蚀介质溶液的电阻;Rct为碳钢被腐蚀时氧化还原反应的界面电荷转移电阻;CPE为常相位角元件;Q为腐蚀反应产物的电容;n为弥散效应系数[15]。从拟合结果中可以发现,随着复合缓蚀剂的加入,Rs由4.74 Ω降低至4.16 Ω,Rct由4590 Ω增大至8481 Ω,这意味着腐蚀反应中的电荷转移受阻,电化学腐蚀速率受到抑制,而CPE的减小的可能是由于碳钢表面缓蚀剂吸附产生的局部介电常数降低及钝化膜的产生而导致的双电层厚度增加[16],有利于抑制金属的锈蚀。弥散效应系数n的减小也侧面证明了碳钢在含有复合缓蚀剂的体系中的表面异质性[15,17],即钝化膜的产生。
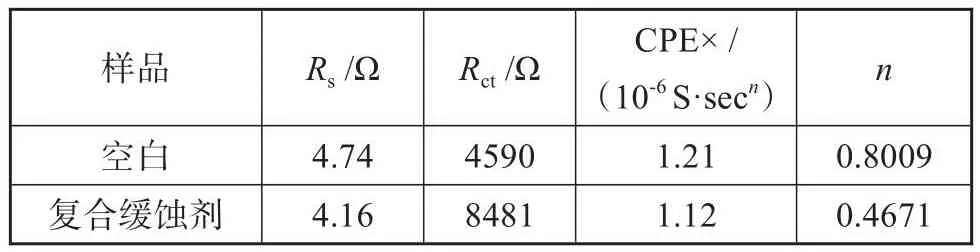
表2 电化学阻抗谱拟合参数Tab.2 Fitting parameters of EIS
3 缓蚀过程分析
根据以上对碳钢在盐水体系中腐蚀实验的综合表征结果推测,复合缓蚀剂的缓蚀机理可能是在金属表面形成隔离层阻断电化学腐蚀的阳极反应,其示意图如图8所示。碳钢在盐水中的腐蚀主要以吸氧腐蚀为主,其阳极反应发生时,铁失去电子进入液相。当复合缓蚀剂存在时,其中的络合剂与铁离子形成稳定络合物,减缓金属的进一步腐蚀。与此同时,复合缓蚀剂中的磷酸根通过与盐水中氯离子的竞争而优先吸附于固液界面[18],并与铁络合物反应,在金属表面形成不溶性的磷酸铁钝化层[19-21]。络合剂的存在使该沉积反应能够有序进行,并有效阻隔高浓度氯离子溶液与碳钢表面的直接接触。通过复合缓蚀剂的作用而形成的钝化层结构更加致密,改善了单一磷酸盐缓蚀剂成膜慢、成膜不均匀等缺点。
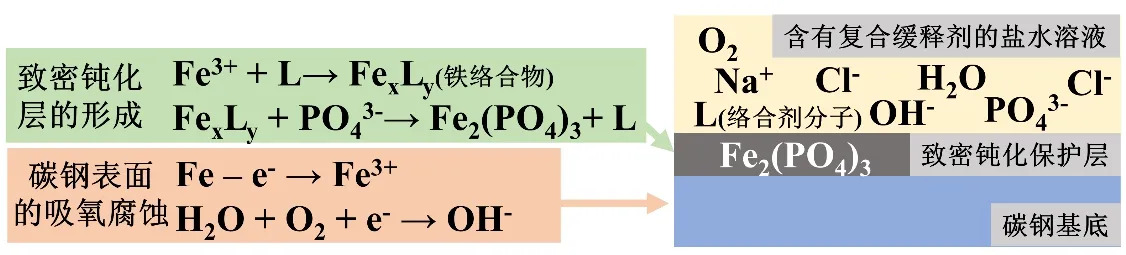
图8 复合缓蚀剂对碳钢在盐水中的腐蚀抑制机理示意图Fig.8 Schematic of corrosion inhibition mechanism of composite corrosion inhibitor to carbon steel in NaCl solution
4 结 论
研究对比了几种常用缓蚀剂在高浓度盐水环境中对碳钢的缓蚀性能,证明了自制缓蚀剂相比于单一缓蚀剂具有较大优势,对碳钢的缓蚀效果最佳,在820 mg·L-1的较低添加量下,缓蚀率可达98.2%。通过对腐蚀试验后碳钢的表面形貌、接触角及元素分析,证明了在复合缓蚀剂作用下钝化保护层的形成。电化学测试结果表明了该复合缓蚀剂主要通过抑制阳极反应的电荷转移来保护金属不被腐蚀,其主要机理为磷酸盐在络合剂的存在下与铁形成惰性的均匀致密沉积层,从而实现对碳钢的协同缓蚀作用。
