不同禁带宽度催化剂协同低温等离子体氧化NOx
2023-09-14郭子妮屈吉艳罗建洪
郭子妮,屈吉艳,罗建洪
(四川大学化学工程学院,四川成都 610065)
随着社会发展,氮氧化物的排放导致臭氧层的破坏、引起光化学烟雾和酸雨、加剧温室效应等环境问题[1],控制氮氧化物的排放属于当务之急。国内外采用改进燃烧技术和用特定的物理化学方法控制NOx排放[2-3]。其中氧化吸收法中的气相催化氧化法已非常成熟,催化氧化法包括金属氧化物催化氧化[4]、光催化氧化[5]和Fenton体系催化氧化[6]等。
金属氧化物是在NO 催化氧化领域研究较早、发展较快的一种催化剂,传统金属氧化物催化氧化法是以烟气中多余的氧气作为氧化剂,以负载在活性炭、Al2O3和SiO2上的V、W、Ti 及稀土金属氧化物为催化剂。金属氧化物催化氧化法已广泛应用于烟气净化工艺,脱氮效率可达90%以上[4]。WANG等[7]通过水热法合成了不同价态的锰氧化物,在48 000 mL/(g·h)的空速条件下,以氧气为氧化剂时,NO 的最大转化率可以达到91.4%。MA 等[8]通过可调控水热法合成了纳米颗粒状SmMn2O5单晶;其中,类纳米颗粒SmMn2O5在300 ℃条件下能实现90%以上的NO 转化率。等离子体技术设备简单、操作便捷。LIU 等[9]通过非热等离子体技术制备了Mn-O-Ce催化剂,并且在催化剂中形成了Mn-O-Ce缺陷相,发现非热等离子体处理后的催化剂表现出活性显著增强、比表面积增加、孔体积增大,此外还改变了催化剂表面活性粒子的相对表面浓度及其氧化态。ZHANG 等[10]在合成过程中用等离子体法处理得到吸附性质较好的NiO-TiO2-Al2O3材料,处理后的催化剂比表面积增加,样品中的Ni颗粒的分散性也明显改善,所以复合物具备较强的NOx吸附能力,从而促使NOx的处理效率进一步得以提高。等离子体协同催化是等离子体和催化剂结合之后在反应系统中发挥协同作用。LI 等[11]研究了等离子体活化与4 种铜基催化剂混合体系对NO 和CH4的脱除,阐明了12%CuO/10%CeO2/15%TiO2/γ-Al2O3催化剂具有较低的NO解吸温度、较大的峰面积,导致其对NO+CH4脱除反应的催化活性比其他催化剂更好。通过使催化剂与低温等离子体协同,反应全程温度变化不大且接近室温,更换不同的催化剂可同时净化多种污染物。
但是在常见催化剂协同低温等离子体的相关报道中,不同催化剂在此过程中产生影响的对比分析,并没有做过多深入的阐述。本研究采用溶剂热法、煅烧法、沉积法等制备了WO3、ZnO、NiO、CdS 和Cu2O 共5 种禁带宽度不同的半导体催化剂,对比了催化剂协同低温等离子体催化氧化NO 与NOx的性能,说明各自对反应过程的具体影响,以及等离子体与各催化剂之间的耦合作用。并且本文结合已非常成熟的碱液吸收形成闭环,降低二次污染,将催化后的尾气再通过碱液吸收达到国家标准,结晶得到的硝酸盐比直接还原有更高的商业价值。经过放电催化后的样品,借助离子色谱测定其表面的NO3-与NO2-的含量以及稳定性测试等,有利于进一步阐释二者的协同机制。
1 实验部分
1.1 试剂和仪器
试剂:二氧化钛、钨酸铵、无水乙醇、硝酸钾、十六烷基三甲基溴化铵(CTAB)、氧化铝、N,N-二甲基甲酰胺、硅溶胶、一氧化氮、氨水、六水合硝酸锌、尿素、硫脲、硫化镉、乙酸镍、三乙醇胺、乙二醇、醋酸铜,均为分析纯;高纯氮气、高纯氧气。
仪器:LM-50-200ML型均相反应器;DZF-1ASB型真空干燥箱;CTP-2000K 型等离子体发生电源;KM9206 型便携式烟气分析仪;TS-100B 型恒温振荡器。
1.2 不同禁带宽度催化剂的制备
WO3的制备:采用水热法和高温煅烧法相结合制备WO3。称取8.528 0 g CTAB于70 mL蒸馏水中,在磁力搅拌下将1.921 4 g 钨酸铵溶解于混合溶液中,在室温下用氨水将其pH 调至8.5 左右。转移到150 mL 高压反应釜中,于140 ℃下反应24 h。得到白色固相,用去离子水清洗3次,在105 ℃干燥12 h,得到白色块状样品。将样品研磨为粉末状放入600 ℃高温节能箱式炉中煅烧10 h,升温速率为5 ℃/min。
ZnO 的制备:采用溶剂热法合成 ZnO 催化剂。称取六水合硝酸锌7.600 0 g,溶解于150 mL 乙醇-水溶液,其中无水乙醇与去离子水的体积比为1∶2,磁力搅拌20 min 至溶液呈无色透明,向溶液中加入3.500 0 g尿素后继续搅拌1 h,转入250 mL聚四氟乙烯反应釜中,在150 ℃下反应16 h。自然冷却,经无水乙醇和去离子水的多次洗涤,高速离心分离后获得白色固体沉淀物,在105 ℃干燥12 h,最后将其放入550 ℃高温箱式炉中煅烧5 h。
CdS 的制备:采用溶剂热法合成 CdS 催化剂。将8 mmol 硫脲和2 mmol CdCl2分散在60 mL 由乙醇和N,N-二甲基甲酰胺(体积比为3∶1)组成的混合溶液中,磁力搅拌1 h。将前驱物溶液转移到100 mL内衬特氟隆的高压釜中,在 150 ℃下加热反应12 h。自然冷却,用大量的去离子水和无水乙醇多次洗涤,于60 ℃下真空干燥24 h。
NiO 的制备:采用均匀沉淀法制备NiO。将2.366 5 g四水合乙酸镍和2.411 7 g尿素分别溶解于200 mL 去离子水中,将两种溶液混合在一起,向其中逐滴加入氨水以调节pH 至10 左右,随后在80 ℃下保持6 h,经过3 次清洗后干燥,放在箱式炉中400 ℃下煅烧3 h,得到黑色NiO样品。
Cu2O 的制备:采用溶剂热法合成Cu2O。量取15 mL 三乙醇胺逐滴加入到45 mL 乙二醇中,加入1.800 0 g 醋酸铜,磁力搅拌1 h,将混合液转移到150 mL 高压反应釜中于160 ℃下反应1 h。自然冷却,用无水乙醇和去离子水洗涤3遍,离心分离出沉淀物,将其放入80 ℃干燥箱内烘干12 h,得到Cu2O样品。
1.3 催化剂与载体的混合
称取1.500 0 g 各催化剂样品,将其分别与15.000 0 g 近似球形颗粒(直径约为2.0 mm)的γ-Al2O3混合,在25 ℃下以350 r/min 的转速振荡15 min,使催化剂紧密附着在γ-Al2O3颗粒表面上。选用不锈钢筛子对其依次筛选,得到附着均匀且牢 固 的WO3/γ-Al2O3、ZnO/γ-Al2O3、CdS/γ-Al2O3、NiO/γ-Al2O3和Cu2O/γ-Al2O3混合物待测试。
1.4 实验流程
实验室自行搭建的低温等离子体氧化NOx的实验装置如图1所示。

图1 等离子体脱硝的实验装置示意图Fig.1 Schematic diagram of experimental setup for plasma(co-catalyzed) denitration
1)进气部分:充分混合后的N2、O2和NO通入双介质阻挡等离子体反应器内。设定气体总流速为1.5 L/min 左右,混合气中的NO 体积分数为(500±10)×10-6、O2为6%±0.1%(体积分数)。
2)电源部分:反应体系中由CTP-2000K 型低温等离子体发生电源进行调控,采用0~30 kV 的脉冲调制电源,其调制脉冲频率范围在1~1 000 Hz;脉冲占空比为1%~99%。本研究中,设定脉冲频率为75 Hz,固定脉冲占空比为70%。放电反应产生的电压和电流由TBS-1000B 型数字示波器通过高压探头和电流探头测定记录放电时的波形图像。
3)等离子体协同催化氧化NOx部分:等离子体放电反应器内的放电过程由脉冲调制电源控制。采用双介质同轴DBD 反应器,通过不同种类的催化剂与低温等离子体的协同作用使得NOx高效氧化。附着后的催化剂均匀填充在放电区间的石英管中。
4)尾气分析部分:采用KM 9206 型便携式烟气分析仪检测尾气的NO含量、NOx含量以及氧含量。
2 结果与讨论
2.1 材料表征
2.1.1 XRD分析
采用X 射线衍射分别对WO3、ZnO、NiO、CdS 和Cu2O进行分析,如图2所示。图2a中根据JCPDS 数据库的标准卡片(JCPDS 43-1035)得知,WO3粉末样品在23.1°、23.6°和24.3°处出现特征峰分别对应晶面(002)(020)(200),这说明通过此煅烧法制备获得的是单斜相WO3。由图2b 可知,ZnO 粉末样品依次在31.7°、34.4°、36.2°、47.5°、56.5°、62.8°、67.9°、69.0°处出现明显特征峰分别对应ZnO 的(100)(002)(101)(102)(110)(103)(200)(112)晶面,发 现这与ZnO 的XRD 标准卡片(PDF 36-1451)一致,证实了所制得样品是六方纤矿型ZnO。由图2c 的NiO 的XRD谱图可以知,处于37.3°、43.3°、62.9°、75.4°位置处的峰,分别与标准卡片(JCPDS File No.89-5881)上出现的(222)(400)(440)(622)这4 个晶面对应,与NiO 的立方结构实现吻合。由图2d 可以看到在2θ为 24.8°、26.5°、28.2°、36.7°处有与(100)(002)(101)(102)晶面对应的衍射峰,这与JCPDS No:41-1049 标准峰的位置对应,证明合成的CdS 样品属于CdS 六方纤锌矿相。催化剂Cu2O 的XRD 谱图见图2e,明显得知在29.6°、36.4°、42.3°、61.4°、73.6°处都有相对弱一些的衍射峰,分别对应于晶面(110)(111)(200)(220)(311),并没有发现有单质铜的对应峰出现,这样所得到的Cu2O 样品纯度相对较高。

图2 WO3(a)、ZnO(b)、NiO(c)、CdS(d)和Cu2O(e)的XRD谱图Fig.2 XRD patterns of WO3(a),ZnO(b),NiO(c),CdS(d) and Cu2O(e)
2.1.2 XPS分析
图3 为WO3、ZnO、CdS、NiO 和Cu2O 的XPS 谱图。由图3a 可知,结合能为35.85 eV 和38.00 eV 的WO3双峰分别对应于W 4f7/2和W 4f5/2态。这可能归因于来自+6价氧化态的W原子的光电子,在WO3氧化态附近存在氧空位和表面缺陷。WO3的O 1s光谱在530.70、530.90、532.00 eV 处具有单个不对称峰,如图3b 所示。530.70 eV 的峰对应于WO3中的氧原子,530.90 eV 的峰归因于WO3晶体结构中的缺陷氧O2-,532.00 eV 的峰与吸附在样品表面上的氧或者水分子有关[12],清楚地表明样品中都存在缺陷和氧空位。图3c显示了Zn特征峰位于1 022.35 eV和1 045.55 eV,分别与Zn 2p3/2和Zn 2p1/2对应。此外,图3d 显示了在531.15 eV 的O 1s 对应峰,这是由于催化剂ZnO内的缺氧区域中存在松散结合的氧。图3e显示了 Cd 3d5/2和Cd 3d3/2在402.70 eV和409.45 eV处的两个特征峰。以159.15 eV和160.25 eV为中心的峰拟合到图3f中,分别是S 2p3/2和S 2p1/2。图3g描绘了Ni 2p在870.4 eV和851.5 eV处表现出的双峰,分别对应于Ni 2p3/2和Ni 2p1/2,这是由于自旋轨道耦合效应而形成[13]。由图3i 可知,在931.1 eV 和950.0 eV处显示两个主要峰,可以归因于Cu+的分峰Cu 2p3/2和Cu 2p1/2[14]。图2e的XRD谱图充分证明了Cu2O 的纯度较高,图3i 的XPS 谱图证明了金属Cu存在价态为+1价。
2.1.3 UV-Vis分析
图4显示了5种不同样品的UV-Vis谱图。从图4a 中观察到样品的光吸收起始位置都不同,WO3、ZnO、NiO、CdS 和Cu2O 分别约为450、390、350、550、450 nm,其中ZnO 的吸光度表现最强,Cu2O 最弱。由图4b 可知,5 种样品的禁带宽度分别约是2.81、3.34、3.63、2.40、2.21 eV,这个光学带隙值与多篇报道内容[15-16]是相对一致的。
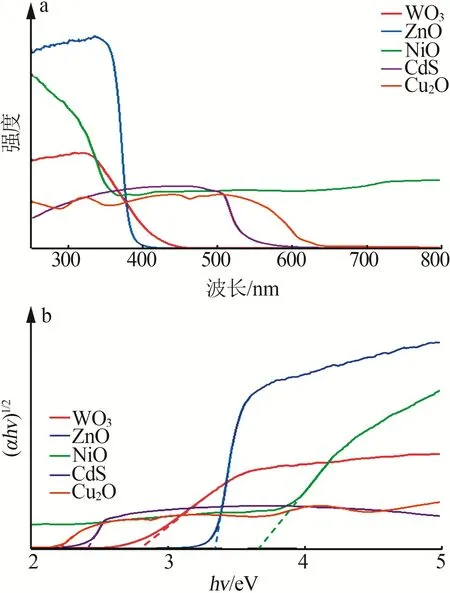
图4 WO3、ZnO、NiO、CdS、Cu2O紫外可见光谱Fig.4 UV-Vis spectra of WO3,ZnO,NiO,CdS,Cu2O
2.2 催化剂与等离子体之间的相互作用
2.2.1 催化剂对等离子体放电的影响
空管放电过程中,大量均匀分布的亮丝线意味着在这个输入功率下,等离子体系统的放电强度充分。CdS/γ-Al2O3填充在反应器后,放电亮度下降,是由于放电间隙中存在介质,缩短了放电间隙,细丝线放电模式被改变为粒子表面放电模式和间隙穿线放电模式的组合[17]。WO3/γ-Al2O3、ZnO/γ-Al2O3、CdS/γ-Al2O3的放电现象没有明显区别,放电亮度较低的原因仍然是放电模式的转变。而NiO/γ-Al2O3、Cu2O/γ-Al2O3填充在反应器中未被激活,没有放电现象,因而没有显现出催化性。
2.2.2 等离子体放电对催化剂的影响
为了探究等离子体放电后的各半导体催化剂晶相是否稳定,对反应后的WO3、ZnO和CdS的晶型进行了表征,发现与反应前无差别,说明在等离子体场中制备的半导体的晶型结构是稳定的,经过放电后仍保持较高的结晶度。催化剂的形貌颜色是初步判断其光响应特性的依据,对反应后催化剂的表观进行了比对,发现WO3、ZnO和CdS三者的颜色在反应前后均没有明显变化。
2.3 不同禁带宽度催化剂协同低温等离子体氧化NOx性能的考察
2.3.1 电源电压对协同催化氧化NOx的影响
等离子体反应过程中,衡量反应器输出能量的必要指标之一就是能量密度(SIE)。图5 阐明了DBD反应器中(脉冲)电源电压的峰值与SIE之间的相互影响,电压与SIE 的相互关联是正相关。因为电源电压的增大,放电强度增强,气体在受到外加的强电场时其电离、激活的可能性及活化程度也均会提高。体系最主要的能量是来自于质量较轻的、被激活后的带电粒子自身所带有的能量,SIE 的大小自然会增大。

图5 脉冲调制电源放电中的峰值电压对能量密度的影响Fig.5 Effect of peak voltage on SIE in pulse-modulated power supply discharge
图6a、b 是催化剂协同等离子体对NO 与NOx脱除效率在不同电源电压下的变化。首先,通过对比图6a、b可知,γ-Al2O3对NO与NOx的氧化效果最差,在电源电压为40 kV、能量密度为660.46 J/L 时,γ-Al2O3对二者的氧化率为55.7%和36.7%。这是由于γ-Al2O3对氮氧化物的吸附和γ-Al2O3较高的介电常数导致的电场强度增加所致。

图6 不同电源电压对催化剂协同等离子体对NO(a)、NOx(b)氧化脱除率的影响Fig.6 Effect of different power supply voltages on NO(a),NOx(b)oxidation removal efficiency of catalysts in synergistic plasma
在同一电压下,各催化剂的氧化脱硝效果由强到弱的顺序依次为CdS/γ-Al2O3、WO3/γ-Al2O3、ZnO/γ-Al2O3、γ-Al2O3、NiO/γ-Al2O3与Cu2O/γ-Al2O3,后两者相差不大。CdS催化氧化效率更高可能是较低的禁带宽使其对激发更敏感,吸收更广泛的紫外线和可见光波长,为NOx的氧化创造更多“电子-空穴对”。对N型半导体(自由电子浓度远大于空穴浓度的杂质半导体)来讲,同一条件下其氧化脱硝效率与其自身的带隙能呈负相关,是因为带隙能小,激活需要的能量少,被活化的几率就更大,氧化脱硝性能较好。
当输入SIE 由660.46 J/L 提高至843.62 J/L(即电压从40 kV 上升到50 kV)时,WO3、ZnO 和CdS 去除NO和NOx的性能没有得到较大提升,首先是反应器中的气体处于高能量密度氛围中,获取了更高的电子能量,引发了更复杂的N2与O2的反应,其次是在更高的放电功率下,反应区域自然会出现热量释放出来的情形,温度大致为80~100 ℃,这就导致了催化剂从球状载体γ-Al2O3的表面附着不牢固而引起滑落。
但 对 于P 型 半 导 体,NiO/γ-Al2O3和Cu2O/γ-Al2O3的氧化脱硝能力与单一γ-Al2O3几乎无差别,NO脱除率依次为56.1%、56.5%;NOx去除率分别为36.9%、37.3%。在同一条件下,其氧化脱硝效率的高低与其带隙能没有关联,在此环境完全得不到激活。P 型半导体(以带正电的空穴导电为主的半导体)中自由移动、带电荷的是空穴居多一些,而N型半导体中大多是电子。在等离子体的电场中,这样的附加能量可以到达电子上而后碰撞转移能量,进一步促进化学反应进行,所以能够断定是电子在此环境下更容易被激活。
综上所述,脉冲电源提供的电压越高,获得的氧化脱硝性能越好,但当电压上升到一定值后,氧化NO以及NOx效果的提升幅度变慢。图7为脉冲调制电源放电中的峰值电压对能量效率η的影响。从图7也可看出电压上升到40 kV 之后,整个等离子体放电催化系统的能量效率η出现下降的趋势,这是因为电源所给予的能量足够,同时体系中电子也带有较大的能量,但是反应过程中有大部分能量没有被利用而以热能的形式释放,能量利用效率降低。

图7 脉冲调制电源放电中的峰值电压对能量效率η的影响Fig.7 Effect of peak voltage on energy efficiency in pulse-modulated power supply discharge
2.3.2 离子色谱分析
在低温等离子体协同半导体催化剂对NOx氧化过程中,气体将会被氧化为更高价态的物质累积在催化剂表面,长时间反应后催化剂的氧化效果会有下降趋势,这也是NOx氧化效率呈现出递减的首要原因。采用离子色谱分析(IC)测定累积在催化剂表层的产物。图8 为催化剂在40 kV 电压下放电后表面附着的NO3-与NO2-的量。如图8 所示,在电源电压为40 kV 下,不同种类催化剂表面的NO2-与NO3-附着量由大到小的顺序为CdS/γ-Al2O3、WO3/γ-Al2O3、ZnO/γ-Al2O3、γ-Al2O3、NiO/γ-Al2O3与Cu2O/γ-Al2O3,后两者接近,其协同等离子体共同对NOx的氧化效果与上述顺序一致,因此,等离子体催化氧化脱硝效率越高,累积在相应催化剂表面的NO2-与NO3-的量就越高。

图8 催化剂在40 kV电压下放电后表面附着的NO3-与NO2-的量Fig.8 Dosage of NO3- and NO2- attached to surface of catalysts after discharge at 40 kV
单独的γ-Al2O3填入放电区间,反应后表面的NO2-与NO3-较少,说明该载体催化效果不好。将NiO 和Cu2O 两类P 型催化剂样品附着于γ-Al2O3颗粒,反应后表面的NO3-量极低,同时检测出其表面NO2-的量与未附着催化剂的γ-Al2O3颗粒表面NO2-的量相当,论证了催化剂NiO和Cu2O的催化效果较差。相反,3 种N 型半导体WO3、ZnO 和 CdS 附着在γ-Al2O3颗粒外层,通过放电氧化NOx后其表面的NO2-和NO3-比仅填充γ-Al2O3时的量高很多倍。同时证实了CdS、ZnO 和WO3等N 型半导体催化剂在等离子体场中被激发,实现了NOx的深度氧化。此外,NO3-与NO2-在3 种N 型催化剂表面累积量由大到小依次为CdS、WO3、ZnO,表明CdS比WO3和ZnO对等离子体发生器场的激发更敏感,这是由于CdS 的禁带宽较窄。由于等离子体放电时产生的紫外光强度基本上不足以激发传统的光催化过程,因此认为,等离子体协同半导体催化的关键因素之一是催化剂是否对等离子体场产生的高能电子的激发更加敏感,而这种现象的产生是因为CdS 的带隙能比WO3和ZnO低。
2.3.3 等离子体协同半导体催化氧化NOx的稳定性测试
图9 为协同双介质阻挡放电氧化NOx的性能测试。由图9 可知,协同CdS 的双介质阻挡放电实验(SIE=660.46 J/L)中,长时间氧化氮氧化物的效果稳定性良好,说明CdS 在长期放电过程中氧化脱硝性能保持良好。图10 为低温等离子体协同CdS 催化氧化NOx的性能分析。从图10a可以看出,在120 min的连续实验中60 min 时CdS 的平均NO 和NOx氧化率分别为96.8%和82.2%;由图10b 可知,经过两次洗涤再生,60 min时CdS分别氧化了93.5%和78.2%的NO 和NOx,与同一时间时的氧化率对比,出现下降趋势可能的原因是纳米CdS受到了放电时伴随的紫外可见光的腐蚀影响,这为DBD 驱动的CdS催化氧化NOx的工业应用提供了良好基础,有较好的经济效益。图10中空缺处为分析设备自清洁。

图9 γ-Al2O3、WO3、ZnO、NiO、CdS和Cu2O协同双介质阻挡放电氧化NO、NOx的性能测试Fig.9 Performance test of long-term NO,NOx oxidation by γ-Al2O3,WO3,ZnO,NiO,CdS and Cu2O with dual dielectric barrier discharge

图10 低温等离子体协同CdS催化氧化NOx、NO性能分析Fig.10 Performance analysis of low temperature plasma synergistic CdS catalytic oxidation of NOxand NO
3 反应机理
等离子体协同CdS催化氧化NOx可能的反应机理如图11所示。首先,等离子体提供大量的高能电子激发CdS产生电子-空穴对(e--h+),电子与空穴分别与吸附在CdS表面的H2O与O2反应生成大量·OH和·O2-。其次,吸附在CdS 表面的NO 被产生的·OH氧化成NO2,然后进一步深度氧化成NO2-与NO3-,吸附在CdS 表面的NO2则直接被产生的·OH 氧化为NO2-与NO3-。最后,在放电激发过程中,同时也产生了一定浓度的O3,进一步促进NOx的氧化,与YANG等[18]的研究相一致。在实验过程中没有引入水,反应装置气密性好,催化剂全部干燥。笔者认为反应过程中的水可能是催化剂或反应器表面吸附的水。图3的XPS谱图也支持了催化剂表面存在吸附水的可能性。在等离子体协同催化的过程中,CdS 的引入在一定程度上提高了等离子体放电的电场强度与能量密度从而提高了平均电子能量,使得CdS 更易受激发。
4 结论
在填充了γ-Al2O3载体的放电区域中引入了具有不同带隙能的5 种催化剂,通过等离子体场中协同催化的综合作用,提高了NO 和NOx的氧化效率,主要结论如下:1)N 型半导体催化剂WO3、ZnO、CdS的电子在电场中能够被激活、选择性获取能量以参与协同催化反应,对于去除烟气中的NOx表现出一定的能力;但P 型催化剂NiO 和Cu2O 的大部分载流子为空穴,在电场中被激活的几率较小,获得放电能量的机会较低,对协同催化过程影响小,氧化脱硝性能不理想;同一能量密度下,N型催化剂的带隙能大小与氧化脱硝能力大小呈负相关。2)在40 kV放电电压条件下,带隙能最低的N 型催化剂CdS/γ-Al2O3对NO 与NOx的氧化率最高,与IC 检测结果相吻合。
