盐湖卤水提锂技术研究进展
2023-09-14黄冬根万金保
付 煜,邓 觅,黄冬根,万金保
(1.南昌大学资源与环境学院,鄱阳湖环境与资源利用教育部重点实验室,江西南昌 330031;2.江西省科学院,江西南昌 330096)
锂原子半径小,具有电化学活性强、氧化还原电位高和比热容高等优异特性,因而锂及其化合物在电池、特种玻璃、陶瓷、润滑油和生物医药等领域得到了广泛的应用[1-4]。随着电动汽车、信息技术和电网储能产业的迅速扩展,其对锂原料的需求急剧增加[5]。锂资源主要来源于蒙脱石、透锂长石、锂辉石等矿石,陆地卤水、地热卤水、油田卤水等盐湖卤水及海水等[6]。这些来源中锂矿石开采已有百余年的历史,因资源储量不足、开采难度大,开矿过程还会造成严重的生态破坏,后续需要巨额的生态修复费用[7]。这些因素显著地增加了开采成本,导致矿石提锂已无法满足当前的市场需求。海水中锂资源储量很大,但锂离子质量浓度很低,约为0.17 mg/L,并且海水存在高浓度的钾、钠、镁等碱金属,对锂的分离产生严重的干扰[8],这些不利因素导致海水提锂难度大,因此提锂技术还不成熟。与前两者相比,盐湖卤水中锂储量占全球陆地锂储量的69%,在具有经济价值的富锂盐湖中锂离子质量浓度为200~4 000 mg/L[6]。盐湖卤水因具有丰富的锂储量、锂离子浓度高、开采工艺简单等优点,成为当前锂盐生产和研究的热点[9]。鉴于盐湖卤水更具有实际开发前景,本文综述了全球盐湖卤水锂资源的分布、水质特性和主流工艺,深入探讨了盐湖卤水提锂方法的研究进展,并提出了后续工艺的优化思路和建议。
1 盐湖锂资源的分布、水质特性及提锂方法
1.1 盐湖卤水锂资源的分布特性
根据美国地质调查局的统计数据[10],截至2021年12 月底,全球已探明的锂资源量约为8 900 万t,其中南美地区的玻利维亚、阿根廷和智利的储量占比分别为24%、21%和11%,三者的储量总和占世界已探明锂储量的56%,获得“南美锂三角洲”的美称。美国和澳大利亚的储量占比分别为10%和8%,中国锂资源量约为510 万t,储量排名世界第6 位。在全球已探明的锂矿中,约70%的锂资源赋存于盐湖卤水。与矿石提锂相比,盐湖卤水提锂具有成本低、能耗小、污染少等优势,已成为全球锂盐生产的主流趋势。图1为全球已探明的锂资源分布,图2为全球锂资源最终用途市场分布。

图1 全球已探明锂资源分布[10]Fig.1 Global proven distribution of lithium resources[10]

图2 全球锂资源最终用途市场分布[10]Fig.2 Global end-use market distribution of lithium resources[10]
1.2 盐湖卤水锂矿水质特性
盐湖卤水含有大量钠、钾、硼、钙、镁等元素的氯化物、硫酸盐、碳酸盐及硼酸盐,化学组分复杂。全球各大盐湖的组分差异明显,因而各盐湖提锂工艺也不同[11]。表1 为全球主要富锂盐湖的化学组成[12]。卤水中常含有大量的镁离子,其化学性质与锂极为相似,会严重干扰锂盐的分离提纯。因此,降低镁锂比(镁离子与锂离子的质量比,下同)对卤水提锂有着至关重要的作用。与国外的盐湖水质相比,中国大多数盐湖卤水锂资源具有镁锂比高、锂浓度较高等特点,这进一步增加了盐湖卤水提锂生产的难度。
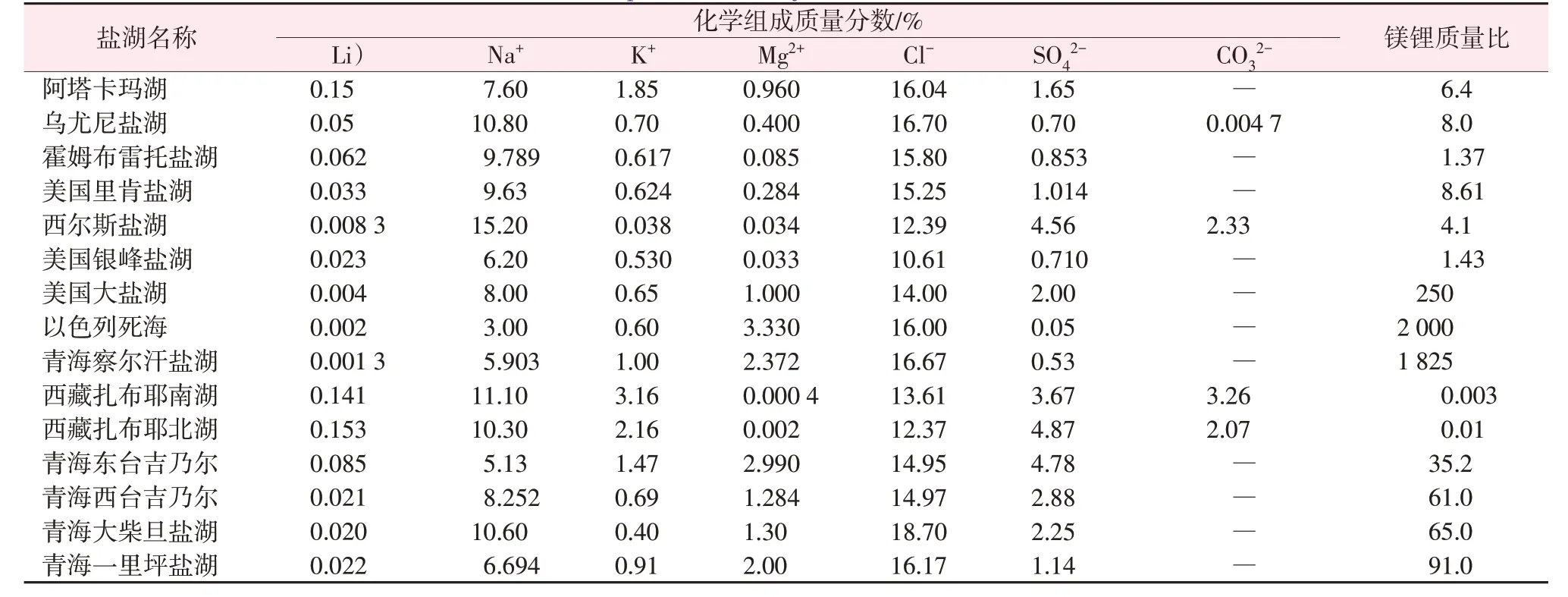
表1 全球主要富锂盐湖的化学组成Table 1 Chemical compositions of major lithium-rich salt lakes in the world
1.3 盐湖卤水主要提锂方法
根据世界各地盐湖水质中锂含量和镁锂比特性,工业应用的提锂工艺方法主要有沉淀法、萃取法、吸附法等。对于低镁锂比的卤水锂资源常用碳酸盐沉淀法提锂,通过投加石灰去除卤水中的Mg2+和Ca2+干扰离子得到富锂溶液,并进一步提纯从而获得碳酸锂产品,如智利阿塔卡玛盐湖和美国银峰盐湖等。对于高镁锂比的盐湖卤水,如中国青海和西藏的大部分盐湖及死海卤水,则常用铝酸盐沉淀法、吸附法和萃取法等。表2 为全球典型富锂盐湖提锂方法[13-15]。
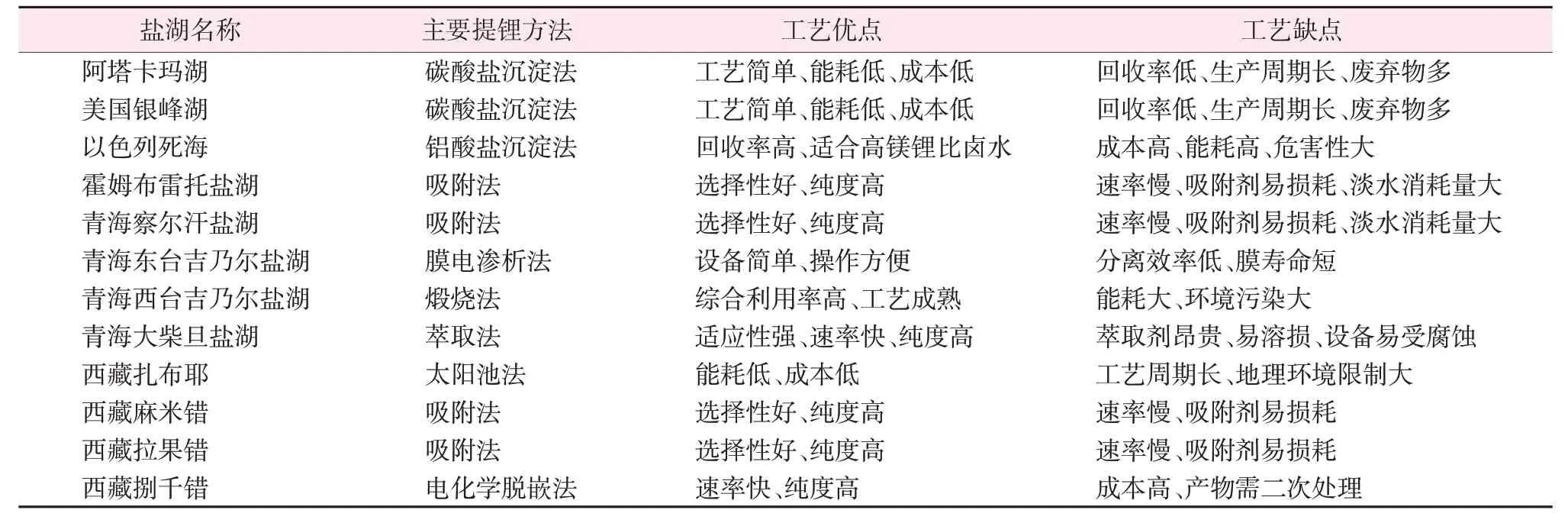
表2 全球典型富锂盐湖提锂方法[13-15]Table 2 Typical lithium-rich salt lake lithium extraction methods in the world[13-15]
2 盐湖卤水提锂方法研究进展
2.1 化学沉淀法
化学沉淀法是指向盐湖卤水中加入某种化学药剂,通过药剂与卤水中大量存在的镁、钙、硼等离子反应形成化学沉淀物,从而实现目标元素的分离和提纯的方法。
2.1.1 铝酸盐沉淀法
铝酸盐沉淀法是通过控制合理的铝锂比(质量比,下同),形成铝锂共沉淀物。沉淀物依次经过滤、高温煅烧、水浸等操作后可使铝锂分离。向分离后的含锂溶液中加入沉淀剂除去Mg2+、Ca2+等干扰离子后进行蒸发浓缩操作,向浓缩液中投加碳酸钠进行沉锂反应,最后获得工业级纯度的碳酸锂产品。HEIDARI 等[16]采用铝酸盐沉淀法进行盐湖卤水提锂实验,结果表明在温度为30 ℃、铝锂比为5、pH为7、密度为1.31 g/cm3条件下,锂沉淀率为76.4%。
2.1.2 碳酸盐沉淀法
碳酸盐沉淀法是向蒸发、浓缩后的盐湖卤水中投加CaO 或Ca(OH)2作为沉淀剂,去除卤水中的Mg2+和Ca2+干扰离子,得到高纯度LiCl 溶液,继续投加碳酸钠便可获得工业级Li2CO3。AN 等[17]利用两步沉淀法对乌尤尼盐湖卤水进行沉淀提锂实验,通过投加石灰,使其与卤水中高浓度的钙、镁、硫酸盐和硼离子形成沉淀,继续投加草酸钠去除剩余的钙镁离子,过滤后去除沉淀物;对滤液进行蒸发浓缩,获得富锂溶液,继续投加碳酸钠,可获得纯度为99%的碳酸锂。
2.2 溶剂萃取法
溶剂萃取法提锂是利用Li+在有机相中溶解度或分配系数的不同,使Li+转移到有机相形成萃合物,进而实现锂与杂质离子分离。对萃合物进行酸洗或水洗,便可获得富锂溶液。目前最热门的萃取剂是中性含磷萃取剂和β-双酮类萃取剂。常见的萃取工艺流程为通过向盐湖卤水投加萃取剂,锂离子被萃取进入有机相中,而杂质离子留在水相;对含锂有机相进行酸洗反萃操作,获得含锂溶液;脱锂再生后的有机相继续作为萃取剂返回萃取阶段;含锂溶液经过蒸发、过滤等纯化操作去除固体杂质颗粒获得富锂溶液,最后投加碳酸钠后获得Li2CO3产品。图3是典型的萃取工艺流程[18-19]。

图3 典型的萃取提锂工艺流程[18-19]Fig.3 Typical lithium extraction process[18-19]
2.2.1 中性含磷萃取剂
中性含磷萃取剂主要包括磷酸三丁酯(TBP)、二丁基膦酸酯(BDBP)和三正辛基氧化膦(TOPO)等,在不同的协萃剂或稀释剂作用下,可以对锂表现出优良的选择性提取效果。ZHOU等[20]研究了TBP作为萃取剂与不同稀释剂和不同共萃取剂组合条件下对锂萃取的影响;研究发现,萃取容量由小到大顺序依次为TBP/2-辛醇、TBP/煤油、TBP/甲基异丁基酮,共萃取剂的容量由大到小依次为FeCl3、ZnCl2、CrCl3。SHI 等[21]采 用TBP/(C4mim)(NTf2)[1-丁基-3-甲基咪唑双(三氟甲基磺酰)亚胺盐]作为萃取体系对盐湖卤水进行提锂实验,在最优条件下,萃取体系单次提锂效率为92.37%,显示出良好的分离提锂效果。
2.2.2 β-双酮类萃取剂
β-双酮类萃取剂通过分子链上的羟基或羰基与Li+形成稳定的螯合结构,在协萃剂的作用下形成相应萃合物,使Li+与其他杂质离子进行分离。QIAO等[22]以TPB-苯甲酸乙酯-FeCl3为萃取体系对盐湖卤水进行了萃取提锂实验。结果表明:最佳的铁锂原子数比和O/A相比分别为1.2和3.0。经过13次循环萃取后,洗脱液含锂量为38.87 g/L,其中K+、Na+、Ca2+的质量分数均小于10%,提锂效率为96%以上,实现了分离提纯锂离子的目的。
2.3 吸附法
吸附法是利用具有选择性吸附功能的吸附剂直接从盐湖卤水中吸附Li+,然后在洗脱剂的作用下获得富锂溶液,从而实现锂的分离提纯。吸附剂分为有机离子交换吸附剂和无机离子交换吸附剂,其中有机离子交换树脂制造工艺复杂、价格昂贵,缺乏应用价值。无机离子交换吸附剂对Li+的选择性强并有特定的记忆效应,可有效从稀溶液中选择性提锂。无机离子交换吸附剂可分为铝基吸附剂和离子筛型吸附剂等。
常用的吸附提锂工艺流程为向盐湖卤水中投加制备好的吸附剂,使其与卤水进行充分的接触和反应。达到吸附饱和时间后对固相吸附剂进行水洗,洗脱液为含锂溶液,剩余溶液返回盐湖中进行循环提锂。脱锂再生后的吸附剂返回吸附阶段进行循环吸附。对含锂溶液进行蒸发、过滤等纯化操作后获得富锂溶液。最后向富锂液中投加碳酸钠,获得Li2CO3产品。图4是其工艺流程图[23-24]。

图4 典型的吸附提锂工艺流程[23-24]Fig.4 Typical adsorption lithium extraction process[23-24]
2.3.1 铝基吸附剂
铝基吸附剂主要有无定型Al(OH)3吸附剂和铝盐吸附剂两大类。无定型Al(OH)3吸附剂由于其表面存在较大的自由酸性羟基,可促使表面产生含羟基配合物。羟基配合物与Li+相结合生成的铝酸盐为难溶沉淀物,其携带锂离子从液相中脱离。铝盐吸附 剂是指利用无定型Al(OH)3吸附LiCl 形成Li[Al(OH)3]2OH·2H2O 化合物,用水或酸对此化合物中的Li+进行洗脱,获得空位结构规则的铝盐吸附剂,空位结构选择性吸附Li+,实现锂与其他杂质金属的分离。PARANTHAMAN 等[25]制备锂铝层状双氢氧化物氯化物(LDH)作为吸附剂,使用三级台式色谱柱萃取工艺对地热卤水进行提锂实验。结果表明,当 LDH 的锂铝原子数比为1∶1.25 时,锂的回收率为91%,与钠、钾离子相比,LDH 对锂离子具有高度的选择吸附性。
2.3.2 离子筛型吸附剂
离子筛型吸附剂是指预先在无机化合物中导入锂离子,其与无机化合物加热反应生成复合氧化物,即锂盐前驱体。在不改变前驱体结晶结构的前提下,对其进行酸洗,洗脱出Li+,从而获得具有规则孔隙结构的金属氧化物即为锂离子筛吸附剂。主流锂离子筛主要包括锂锰氧化物(LMO)和锂钛氧化物(LTO)。LMO离子筛对Li+的吸附容量较高、循环寿命长、制备难度大;LTO 离子筛吸附速率大、选择吸附性强、化学稳定性好、机械强度大,更具有工业应用价值。XIAO等[26]研究了锂离子的迁移扩散规律,结果表明,锰原子形成阳离子环充当了大门,可供锂离子在迁移过程中通过,锂过剩构型可提供2种通道使锂离子快速转移,从而提高扩散速率,图5 为LiMn2O4晶体结构和锂离子扩散示意图。HE等[27]使用H2TiO3-Li吸附剂,在最优条件下锂离子吸附容量为57.8 mg/g,经过5次循环后吸附容量为25~30 mg/g,显示出良好的吸附性能,图6 所示为Li2TiO3晶体结构和吸脱附结构图。由图5~6 可知,锰系离子筛LiMn2O4为尖晶石结构,属于立方Fd3m空间群,锂占据四面体的位置,Mn3+和Mn4+一起占据八面体的位置,氧占据面心立方的位置。钛系离子筛Li2TiO3为层状晶体结构,上层为Li层,占有75%的锂原子;下层为LiTi2层,占有25%的锂原子。经过酸洗后,H原子逐渐替代锂原子,在没有改变晶体框架的前提下形成了H2TiO3离子筛。经过吸附提锂后形成层状的Li2TiO3,该结构与最初的前驱体结构相比,锂原子排列密度较小。

图5 尖晶石LiMn2O4的晶体结构示意图(a)、锂扩散通道示意图(b)、Li8Mn16O32 的晶体结构示意图(c)及Li9Mn15O32的晶体结构示意图(d)[26]Fig.5 Crystal structure diagram of spinel LiMn2O4(a),schematic diagram of lithium diffusion channel(b),schematic diagram of crystal structure of Li8Mn16O32(c) and schematic diagram of crystal structure of Li9Mn15O32(d)[26]
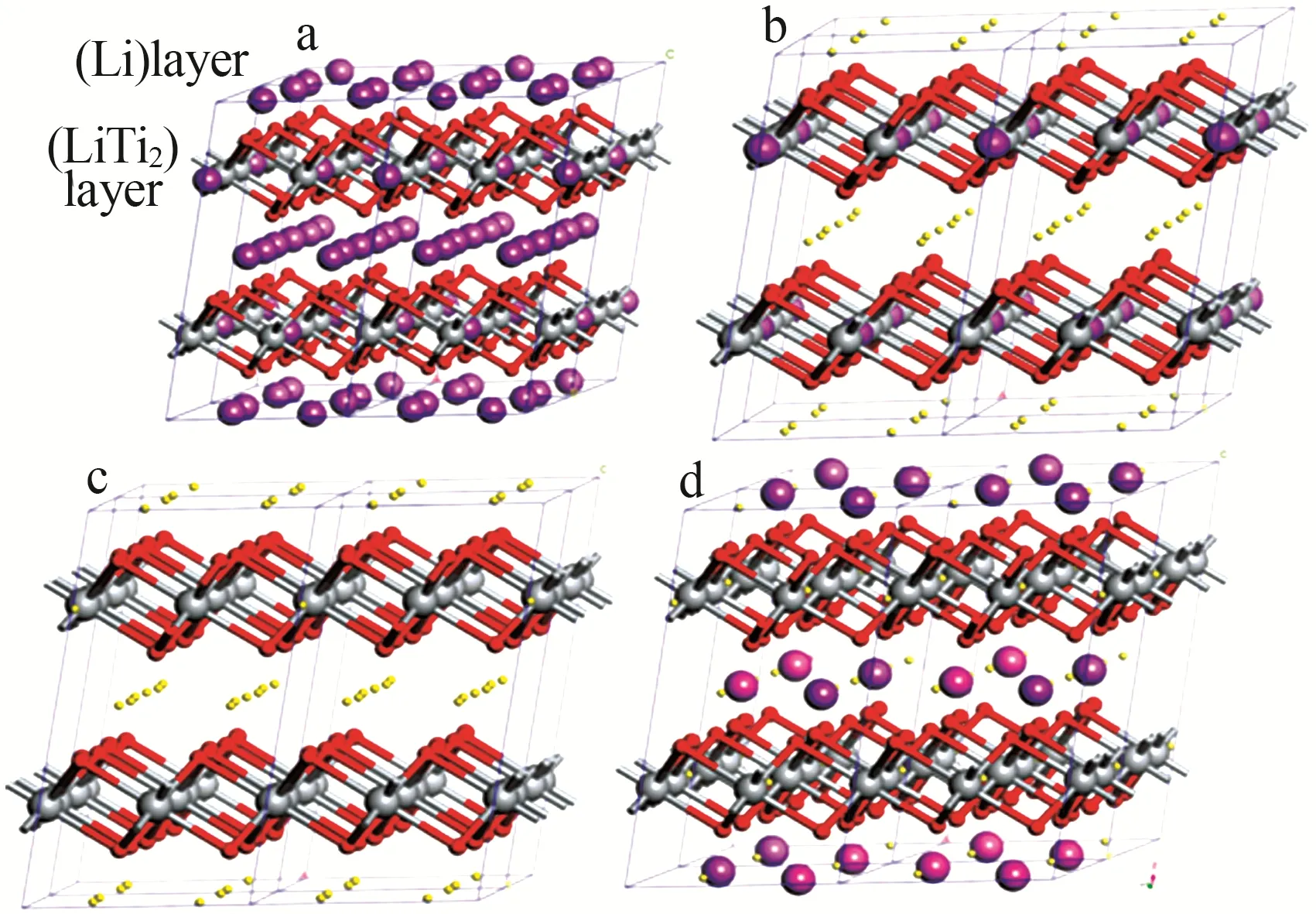
图6 层状Li2TiO3的晶体结构图(a)、酸洗后的结构图(b、c)及吸附锂后的结构图(d)[27]Fig.6 Crystal structure diagram of layered Li2TiO3(a)、structure diagram after pickling(b,c) and structure diagram after adsorption of lithium(d)[27]
2.4 膜分离法
膜分离法是通过在功能膜两侧施加驱动力,利用膜的选择透过性使得盐湖卤水中的不同组分得以分离的方法。按照分离的驱动力可分为压力驱动的纳滤法和电势驱动的电渗析等方法。
2.4.1 纳滤法
纳滤法是一种压力驱动的膜分离技术,能够允许小于膜孔径的组分通过,阻挡大于膜孔径的组分;纳滤膜所含官能团会产生静电排斥作用,阻挡二价和多价离子而透过单价离子,实现物质分离。由于盐湖卤水矿化度高、含盐量高、浓度大,直接进行纳滤易导致膜堵塞而降低膜通量,所以实际提锂操作中需要将卤水稀释,降低其浓度。SOMRANI等[28]使用NF90 纳滤膜处理稀释了10 倍的盐湖卤水,结果显示,该膜对Mg2+截留率为100%,镁锂分离效率为85%,膜对Li+和Na+的分离效率在15%以下;过滤操作6 h 后,由于膜污染的影响,产锂率下降50%。SUN 等[29]用DL-2540 纳滤膜对盐湖卤水进行了分离实验,结果表明:增加操作压力及降低进液温度、pH 和镁锂比有助于实现镁锂分离,共存离子(钾和钠离子)会降低锂离子的分离效果,而钙离子的影响较小。
2.4.2 电渗析法
电渗析法是以电势为驱动力,以离子交换膜为媒介,采用电化学反应与渗析扩散相结合的膜分离方法。通过在阴阳两极施加电场迫使阴阳离子穿越离子交换膜向电极处富集,从而实现物质分离。NIE 等[30]利用电渗析系统对镁锂比为150 的盐湖卤水进行提锂实验,结果显示,适当的低温、高流速和高电流密度有助于提高镁锂分离效率;在最佳条件下,锂回收率高达95.3%,镁锂比降低至8.0。JI等[31]利用电渗析法处理盐湖卤水,研究了电压、进液速率、镁锂比和pH 等因素对系统提锂效果的影响;得出在最佳实验条件下,镁锂比由60降为7,锂回收效率为72.46%,分离系数为12.48。
2.4.3 膜电容去离子法
膜电容去离子技术(MCDI)是在阴、阳电极两侧覆盖离子交换膜,在电极两侧施加电场使得溶液中的阴、阳离子分别被两侧电极吸附,达到提取目标离子的目的。SHI 等[32]使用MCDI 装置对模拟盐湖卤水进行提锂实验,结果表明:在最佳条件下,锂的选择系数为2.95;在大型实验装置中,当镁锂比为60时,锂离子选择系数为1.50,能耗仅为0.001 8 kW·h/mol,分离效果良好。RYU等[33]使用LiMn2O4作为电极材料构建了MCDI 装置,对LiOH 溶液进行提锂实验,结果显示MCDI达到吸附平衡时间较传统吸附装置而言大大缩短,并且MCDI 装置仅依靠电场作用就能完成脱附,不需要使用酸洗脱锂。
2.5 电化学法
电化学提锂是基于磷酸铁锂电池工作原理建立起来的新兴提锂技术,具有选择性强、吸附效率高和绿色环保等优点,是学术界研究的热点之一。这种方法通过控制电位,使Li+在电极材料、电解液和盐湖卤水中产生嵌入、脱出和转移等反应,并通过循环富集过程,达到盐湖卤水提锂的目的。电化学提锂体系中对电极主要的功能包括吸附阴离子、保持溶液的电化学中性和形成一个闭合回路。在锂离子插入工作电极的同时,对电极可能发生捕获阴离子的反应、释放阳离子的反应或其他的化学反应。按照对电极的表现,可将电化学系统分为捕获阴离子型、释放阳离子型和“摇椅式”三大类。
2.5.1 捕获阴离子型电化学体系
当Li+插入工作电极时,对电极会从溶液中捕获Cl-或其他阴离子,这类体系的对电极主要有银、活性炭和电活性聚合物(PPy)电极等。LEE 等[34]采用λ-MnO2/Ag化学系统处理含多种阳离子的模拟盐湖卤水,结果显示该系统每回收1 mol 锂离子,系统能耗仅为1.0 W·h,实现了高效、节能提锂。SHANG等[35]使用LiNi0.5Mn1.5O4/AC 电化学体系对模拟盐湖卤水进行提锂实验,结果显示该体系对锂离子具有强烈的选择吸附性能,吸附容量可达260 µmol/g。MISSONI 等[36]采用LixMn2O4/PPy 电化学系统对盐湖卤水进行提锂实验,结果表明:当电压在0.6~1.1 V时,可实现循环吸附200 次,离子交换率可达50%,能耗为5~10 W·h/mol,分离效果良好、电极循环稳定性强。
2.5.2 释放阳离子型电化学体系
在释放阳离子对电极体系中,Li+插入工作电极时,对电极会释放等量电荷的阳离子来维持溶液的电中性。常用的工作电极为普鲁士蓝(PB)类配合物和锌(Zn)电极等。如FePO4/PB 体系在充电脱锂过程中,锂离子会从橄榄石结构的磷酸铁锂氧化物中脱出,但PB 对电极会吸附K+,从而获得富锂溶液。在放电吸锂过程中,工作电极FePO4会吸附锂离子,PB 对电极会释放K+,从而保持溶液电中性。HAN 等[37]采用K2NiFe(CN)6/LiFePO4电化学体系对地热水进行提锂操作,采用多壁碳纳米管修饰FePO4电极,脱锂效率达到80%,嵌锂容量达到14.88 mg/g,经过5轮循环提锂后电极仍然具有良好的循环稳定性。KIM等[38]采用LiMn2O4/Zn电化学体系处理含锂卤水,通过对 LMO/Zn 电极体系进行100次充放电的稳定性测试,结果表明:在不损失锌的情况下保留了初始容量的73%,能耗为6.3 W·h/mol。
2.5.3 “摇椅式”电化学体系
“摇椅式”电化学体系是指在外加电场作用下,以阴离子交换膜作为分隔膜,将可相互转化的氧化物材料作为阴阳电极,使富锂阳极向回收溶液中释放锂离子,同时贫锂阴极从盐湖卤水中吸附锂离子,两者达到平衡时调换阴阳电极的位置进行循环富锂实验的方法。常用的“摇椅式”电化学体系有LiFePO4/FePO4体系、LiMn2O4/Li1-xMn2O4体系等。HE等[24]构建了LiFePO4/FePO4电化学系统对盐湖卤水开展提锂实验,图7为装置示意图,结果表明处理镁锂比为134.1的卤水时锂回收率为83%,镁锂比下降为1.2;处理镁锂比为48.4 的卤水时,镁锂比下降为0.5,锂离子浓度提高了6 倍,吸附容量为25 mg/g。ZHAO 等[39]使用LiMn2O4/Li1-xMn2O4电化学体系对盐湖卤水进行提锂实验,系统性研究了电压、温度、共存离子等因素对提锂效果的影响,研究表明在电压为1.2 V、温度为25 ℃时,电极对LiCl 溶液的吸附容量可达34.31 mg/L;在实际处理盐湖卤水时,单次吸附容量为22 mg/g,电流效率为89%,能耗为18 W·h/mol,分离效果良好。
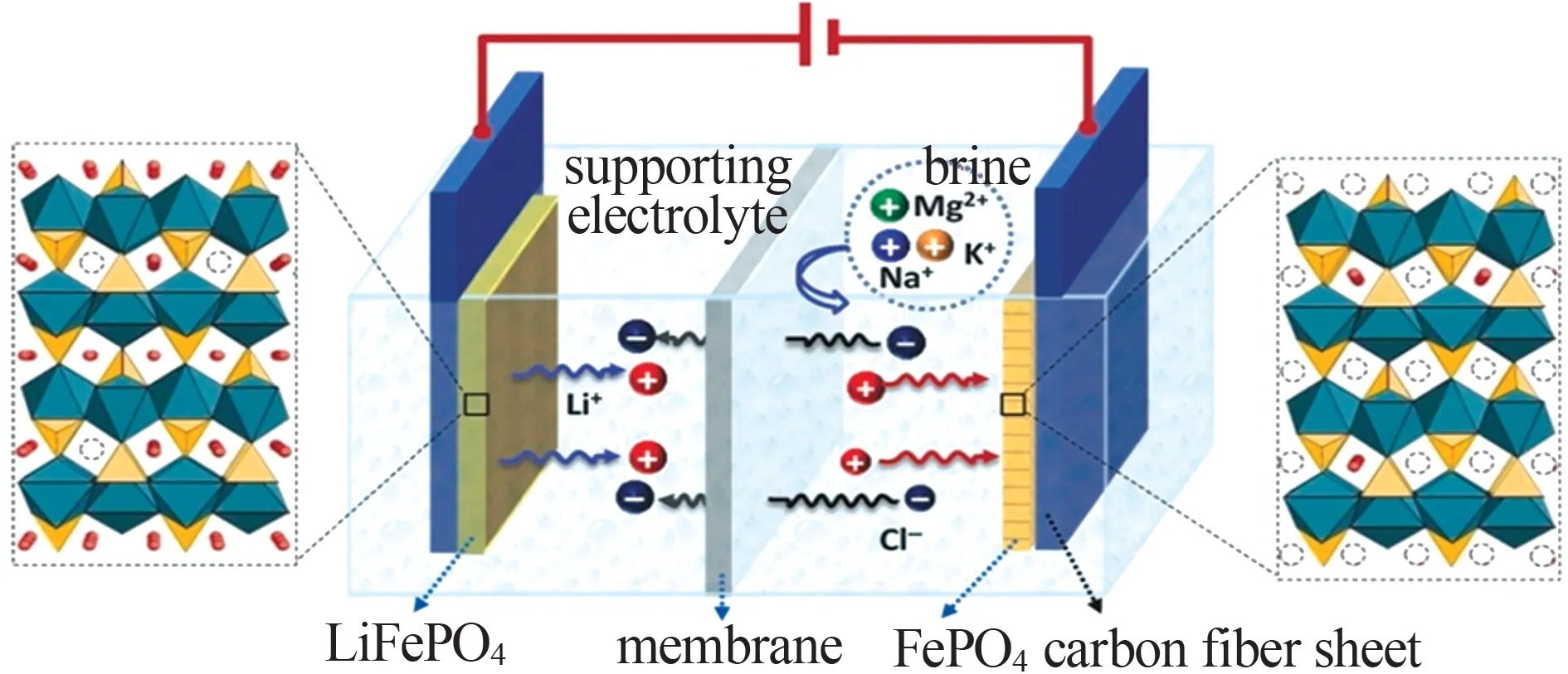
图7 LiFePO4/FePO4电池装置示意图[24]Fig.7 Schematic diagram of LiFePO4/FePO4 battery device[24]
3 结语与展望
盐湖卤水是锂资源的重要来源之一,深刻影响着锂电池等产业的发展和壮大。由于盐湖卤水中存在钙、镁、钠等多种干扰离子,尤其高镁锂比会严重制约分离效果,使大规模提锂生产面临着很大的挑战。在目前主流的盐湖卤水提锂技术中,实现应用提锂方法的主要有化学沉淀法、萃取法、吸附法、膜分离法和电化学法等。
化学沉淀法提锂在工业上应用较早,该方法普遍具有操作简单、可靠性高、成本较低等优点,但也存在前处理复杂、沉淀剂消耗量大、化学污泥产量大等不足。在铝酸盐沉淀法中,由于铝酸盐并不与Mg2+发生反应,因而更适合高镁锂比的盐湖卤水提锂,但在生产过程中,反应温度、pH和铝锂比对提锂效果有较大影响。由于碳酸盐沉淀法需要预先投加大量的沉淀剂去除钙镁等干扰离子,故该法更适合低镁锂比型盐湖卤水提锂,碳酸盐法锂回收率较高。溶剂萃取法应用较早,工艺成熟、操作简单、分离效率高,但萃取剂的价格高、有机溶剂的结构不稳定、易溶损;在洗脱过程中,需要使用大量的酸进行反萃,对设备会造成腐蚀和损坏;未来有待研发绿色、高效和廉价的萃取剂,并逐步取代用酸作为稀释剂,防止二次环境污染。吸附法普遍具有选择性强、分离效率高,但存在吸附剂易溶损和吸附过程缓慢等缺点,其中,铝基吸附剂由于不与杂质离子发生反应,特别适合高镁锂比的盐湖卤水提锂,但其在吸附洗脱过程中溶损较大,需要进一步造粒;锂离子筛吸附剂具有机械强度高、稳定性好、吸附速率较大等优点,但其制造和再生过程需要消耗大量的强酸,会产生严重的环境污染;这些不利因素有待研究人员开发更加环保、高效的分离技术,提高吸附剂的吸附性能。
膜分离法具有分离效果好、操作简便、环境适应性强、无二次污染等优点,可有效实现卤水中高镁锂比的分离,具有广阔的应用前景;纳滤法虽然不能完全分离镁锂,但可以显著降低卤水中的镁锂比,降低后续提锂的难度,故常与其他技术结合提高分离效率;电渗析法具有设备简单、操作方便和提锂产物纯度高等优点,但存在产物需要二次处理、电渗析膜需要经常更换清洗等不足;MCDI 法具有分离效率高、能耗低、循环稳定性好等优势,电极系统具有稳定性好、再生性强的优点,这使MCDI具有较高的经济效益和环境友好性,但依然存在分离膜成本高、膜清洗难、膜孔易堵塞等不足;膜分离法今后的研究重点领域主要包括开发高效抗污染性能的分离膜,提高使用寿命、降低生产成本等。电化学系统中工作电极对锂离子选择性强、吸附容量高、能耗低、循环性能好、工艺简单,因此成为了高镁锂比盐湖卤水提锂领域的研究热点,并有望成为未来的主流提锂工艺之一;电化学体系中,捕获阴离子型、释放阳离子型和“摇椅式”三大类系统均表现出较好的提锂效果,在捕获阴离子型系统中,Ag 对电极存在电极成本高、在高卤化物环境中会出现电极溶损的问题;活性炭对电极存在对阴离子吸附容量较小等不足;而电活性聚合物对电极则可以弥补前两者的缺点,具有广泛的应用前景;在释放阳离子型系统中,由于不需要对电极材料进行反冲洗,故可大幅减少对淡水的需求,但需控制溶液中阳离子的浓度,才能获得富锂溶液;“摇椅式”电化学体系具有能耗低、成本低、污染少、选择性强、分离效率高等优势,适用于低品位、复杂盐湖卤水体系。电极材料的性能对电化学提锂效果有较大的影响,因此开发选择性更强、循环稳定性更高、成本更低的电极活性材料,是未来的主要研发方向之一。
