FAERS 数据库建设与应用启示*
2023-09-14吴文宇唐碧雨吴建茹魏芬芳李丽敏
吴文宇,唐碧雨,吴建茹,魏芬芳,李丽敏,肖 霄
(广东省深圳市药物警戒和风险管理研究院,广东 深圳 518024)
药物警戒活动贯穿药品的全生命周期,包括研发、生产、销售、使用、监管等阶段,上市后监测到的电子健康数据已成为药品监管新模式的一个关键要素[1]。国外的药品不良反应(ADR)自发呈报数据库有世界卫生组织(WHO)个案安全性病例报告数据库(VigiBase)、美国食品和药物管理局(FDA)不良事件报告系统(FAERS)、欧洲药品管理局不良反应数据库(EudraVigilance)等[2]。本研究中分析了FAERS 数据库的数据来源、建设结构、应用及优缺点,为我国药物警戒相关工作提供参考。现报道如下。
1 数据库管理机构
FDA药物审评与研究中心(CDER)下设的监测与流行病学办公室(OSE)在药物的整个生命周期内使用各种工具和规则来监测和评估美国消费者所用药物的安全性,同时负责所有上市药品和治疗性生物制品上市后的安全性监测,每年评价FDA 安全性信息和不良事件报告系统(MedWatch)不良事件报告超过200 万份。其中,药物警戒和流行病学办公室(OPE)的安全评估人员和卫生官员负责检测药物安全信号及评估所有上市药品和治疗性生物制品的安全问题,通过各种监测工具(不良事件报告数据库、已发表的科学文献及产品的临床前、临床的药物知识)提供科学和临床方面的评价,从而为上市后产品的安全使用提出多种监管和沟通措施;流行病学部使用“哨点”系统进行主动监测,开展流行病学研究,并审查因上市后要求(PMRs)和上市后承诺要求(PMCs)制造商提供的药物安全相关流行病学研究方案和研究报告。
2 FAERS 数据库的发展
2.1 特点与适用性
美国的不良事件数据库根据监测模式分为2种,一种是根据企业强制报告(95%)和MedWatch(5%)生成的FAERS 数据库,一种是基于主动监测模式的分布式数据库。
FAERS 数据库涵盖了美国所有上市后的药品和治疗性生物制品,涉及老人、儿童、孕妇和有其他合并疾病的患者,数据量较大且来源广泛,包括美国以外的数据,适合发生率极低的不良事件的研究挖掘,以及突发事件发生时辅助药物安全的研究。吕强等[3]利用FAERS 数据库分析磷酸氯喹的安全性,结果表明,临床长期使用磷酸氯喹可致严重ADR,应谨慎用于有心脏和神经系统基础疾病的患者,着重关注磷酸氯喹用法用量及其心脏毒性。朱正怡等[4]利用FAERS 数据库分析托珠单抗的不良事件,结果表明,托珠单抗常见报告为药物无效、药物不耐受、疼痛、疲劳、皮疹等,临床应用时应重点关注肺纤维化、间质性肺疾病、胰腺毒性、脱髓鞘病变等药品说明书未提及的ADR。但FAERS 数据库不适用于发生率较高的不良事件的挖掘研究,也不能排除原有疾病及其恶化对不良事件的影响。同时,由于其数据来源的特殊性,也无法计算发生率,无法进行同一类药物间药效及ADR严重程度的比较等。
2.2 发展历程
FAERS 数据库的发展历经2 个阶段。第一阶段,称作Adverse Event Reporting System(AERS),包括1968 年至2012 年第3 季度的数据。20 世纪60 年代“反应停”事件后,许多国家引入了药物警戒(phamacovigilance)系统对上市后药品进行监测。FDA 药物不良事件报告系统(AERS)数据库主要用于发现在临床试验阶段由于出现频次低而未被识别的罕见严重不良事件,或新的不良事件,即安全性信号[5]。第二阶段,更名为FAERS,并于2012 年9 月10 日起开始运行。FAERS 是FDA 用于发现上市后产品相关的新安全问题等的工具,如发现产品潜在安全问题,则使用其他大型数据库(如“哨点”系统数据库)进行进一步评估。
3 FAERS 数据库的应用
3.1 数据库在线查询方法
FAERS公众数据面板(FAERS Public Dashboard)是一种基于网络的高度交互式的工具,允许以用户友好的方式查询FAERS 的数据,并以可视化的形式呈现,亦可下载。该工具的目的是扩大公众对FAERS 数据的访问,以搜索与制药行业、医疗保健提供者和消费者向FDA报告的人类不良事件相关的信息。公众数据面板的检索结果包括怀疑药物、合并用药、不良事件名称、不良事件是否严重、患者年龄和性别、报告来源6个字段,但药物用量、患者病史和不良事件描述字段无法获取[6]。获取的检索结果可按报告类别、上报人、上报地区、报告是否严重、年龄分组和性别分别进行可视化展示。
此外,检索页面还可按产品名称(通用名、商品名和品牌名)和不良事件名称检索,每种检索方式最多可添加5 个检索条件,可按FDA 报告接收年份、所选不良事件名称、产品名称(通用名、商品名和品牌名)、年龄分组、性别、上报人分类。在“Listing of Cases”中可根据左侧字段对检索结果进行筛选预览或导出,但在线预览检索或导出数据量均不可超出100 000 条,否则不可预览或导出。
公众数据面板向社会开放FAERS 数据,在推动药物警戒工作发展和相关概念普及公众的同时,也对患者的依从性产生了影响。开放的不良事件数据可能会导致概率忽略现象发生,即一个人关注结果的严重性而不是结果的可能性,在看到严重不良事件和死亡报告后,患者可能会决定不服药,或尝试用非药物治疗或草药和膳食补充剂来替代药物[6],对医护人员的患者教育工作提出了挑战。
3.2 数据库结构、使用和常用风险信号检测方法
FAERS 数据库为季度数据压缩文件,其中包括季度数据和说明文件,数据格式分为纯文本格式(XML)和美国信息交换标准代码(ASCII)编码的文本格式,每种格式均分成7 个.txt 文件,分别是患者的人口统计学信息及管理信息(DEMOyyQq,其中,“yy”为年份,“Q”为季度英文单词的首字母Q,“q”为该年第几个季度,如DEMO19Q3),药品/ 生物制品信息(DRUGyyQq),不良事件/ 用药错误信息[REACyyQq,国际医学用语词典(MedDRA)编码],不良事件转归(OUTCyyQq),报告来源(RPSRyyQq),药品/ 生物制品开始使用和结束使用时间(THERyyQq),药品/生物制品的适应证(可理解为原患疾病,INDIyyQq/MedDRA 编码)。
FAERS 季度数据的完整应用包括数据清洗和风险信号检测两部分。数据清洗需使用关系型数据库和标准化工具,具体步骤:1)应用关系型数据库(如MySQL)和药品名称标准化工具MedEx[7]对数据进行置重和标准化,将所有季度的人口统计学信息及管理信息(即所有季度的DEMO)文件合并后根据文件中字段CaseID和CaseVersion置重,即提取每个案例的最新信息作为待处理数据;2)根据字段PrimaryID和药品/生物制品信息(即DRUG)文件映射,映射完毕后用MedEx进行药品名称标准化(因为有部分季度数据是公众通过MedWatch上报的,药品名称不规范),用标准化后得到的数据和其他5 个文件通过PrimaryID 映射;3)应用关系型数据库和MedDRA 对第一步获得数据的原患疾病和不良事件/用药错误信息进行汉化,根据MedDRA 最新中文版本和英文版本编码将不良反应术语汉化,即可设定检索条件,检索研究目标有关数据,如需进一步提取更高级别的术语,可用MedDRA桌面浏览器选择性导出数据。
FAERS 常用的风险信号检测方法为多项伽马-泊松分布缩减算法(MGPS)[8-9]。该算法基于比例失衡测量法四格表(表1),核心是对经验贝叶斯几何均数(EBGM)进行计算,计算公式为EBGM=a(a+b+c+d)/(a+b)(a+c)。MGPS 假设EBGM的期望值(E)中存在5 个服从伽吗分布的超参数。故算出目标药品-不良事件组合的EBGM值后,需进一步计算得到5 个超参数的极大似然估计,进而算出EBGM的先验分布值。根据贝叶斯统计原理,综合样本中药品-不良事件组合的信息与先验分布信息,对EBGM进行进一步校正,获得EBGM的最终值,当EB05(EBGM的95%置信区间下限)≥2时,提示ADR信号[8]。MGPS属贝叶斯类算法,能在小数值的情况下进行ADR 信号挖掘,可对年龄、性别等人群特征混杂因素进行单一分层处理,但无法同时对多个人群特征因素进行分层管理,易产生“信号泄露”的现象[8]。
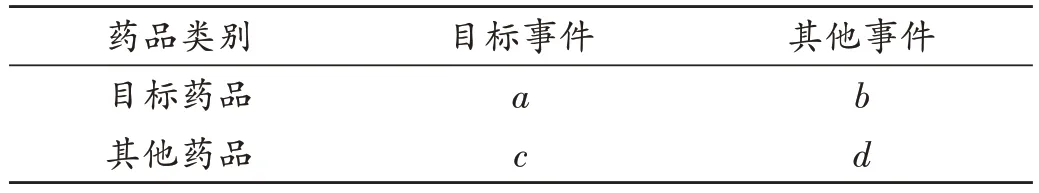
表1 药品-事件比例失衡测量法四格表Tab.1 Drug-events fourfold table by proportional imbalance method
4 启示
4.1 强化药品上市许可持有人(MAH)药物警戒主体责任
2019 年新修订的《药品管理法》制定了MAH 上报疑似ADR的法律责任,2021年发布的《药物警戒质量管理规范》更详细地规定了MAH 进行药物警戒活动所需的人机料法环因素和相关风险评估控制措施。从数据来源看,FAERS 数据库中不良事件报告的来源主要为药品生产企业,极大地体现了药品生产企业在药品不良事件监测中的主体责任。由于我国大多数企业的药物警戒体系建设还处于初级阶段,所报告的ADR存在专业术语不规范、信息缺失、数据的可溯源性差等问题[10]。以2020 年FAERS 上报数据为例,共收到221.8 万份报告,其中MAH上报数据占96.46%,医疗保健人员和消费者上报数据占3.54%。我国2020 年全国ADR 监测网络收到ADR 报告167.6 万份,其中医疗机构来源占85.4%,经营企业来源占10.6%,MAH 来源占3.9%,个人及其他来源占0.1%。与《国家药品监督管理局关于药品上市许可持有人直接报告不良反应事宜的公告(2018 年第66 号)》中MAH 不良反应报告主体责任不符。因此,我国药品生产企业应尽快强化企业药品安全的主体责任,提高企业不良事件报告数量和质量。
建议:1)可结合国家药物警戒相关文件和法律责任,提高企业参与培训的人数及培训内容的深度,使药物警戒不再是掌握在少数人手里的“冷知识”;2)增加对企业药物警戒相关活动的飞行检查频率,以督促企业完善自身的基本药物警戒体系,为药物警戒工作的开展奠定基础;3)根据国内外文献研究和专家建议,结合企业自身的品种生产、销售情况,科学、合理制订不良事件上报指标及风险控制措施,每年定期组织专家进行评价,根据评价结果开展后续培训。
4.2 强化药店药物警戒相关能力
随着社会经济的进步和人民群众对健康要求的提高,连锁药店和单体药店急剧增多。以深圳市为例,截至2021 年,连锁/ 单体药店已达6 798 家。随着自我药疗的迅速发展,药店从业人员成为居民自我药疗的引导者。李迎春等[11]的一项问卷调查分析结果显示,93.67%的零售药店配备了1~2 名执业药师,药店从业人员的学历以大学专科为主(46.59%),专业知识相对薄弱,非常了解药学专业知识的仅占30%。连锁药店作为营利性机构,其药物警戒工作多仅涉及不良事件上报,据2020 年ADR 监测年度报告数据显示,MAH 和经营企业不良事件上报仅占14.5%。
建议:1)提高药店从业人员准入标准,将药械不良事件上报作为考核标准,定期组织药物警戒培训;2)提高药物警戒在执业药师年度继续教育工作内容中的占比;3)政府可给予药店扶持,促进药店开展社区宣传工作,激励药店积极收集自我药疗人群不良事件。
4.3 开展公众不良事件上报工作
我国每年的ADR 监测年度报告中个人上报仅占小部分,可能与公众对药物安全缺乏正确认知和我国目前尚未建立成熟的公众上报平台有关。魏芬芳等[12]对公众药品安全认知度和满意度的现状调查表明,被调查者对药品安全知识的认知程度存在差异,青少年和老年人药品安全认知不足,多数被调查者对药品质量问题的投诉渠道和程序及对药品监管和违法处罚方面的知识缺乏,对ADR缺乏正确认知,尚需加强相关宣传和教育。目前,我国药物不良事件系统权限仅对MAH、医疗机构和监管机构开放,暂未对消费者开放。作为药品使用环节的主体,公众报告的重要性不容忽视[13]。但开展公众报告的前提是公众对药物安全和不良事件报告有一定的基础认知,且有简便操作的端口填写、上传报告。
建议:1)增设公众直接报告端口,扩大不良事件报告收集来源,提高全民安全用药意识。各级ADR 监测机构从战略层面到实施层面、从概念到行为、从面到点地向公众普及药物安全、药品不良事件上报知识等,提高全民安全用药素养;将国家药品不良事件数据去掉身份信息等敏感数据后逐步向公众开放,以真实数据帮助公众提高对药物的认识能力。2)开发公众上报端口。可直接与中国药品电子监管码相连,扫码自动录入药品批号、批准文号、生产厂家等信息,只需上报人填写药品使用时间/剂量、不良事件发生时间、具体表现及就诊信息,后台自动生成结构化表格上传对应医疗机构药学部门或药店,由专业人员将相关术语标准化后再上传,并根据不良事件内容进行回访,既可保障患者的健康,又可提高上报人的积极性,促进医患沟通。
