N端非催化结构域对微泡菌ALW1褐藻胶裂解酶AlgL7酶学性质的影响
2023-09-13黄小艺李鹤宾陈艳红姜泽东李清彪朱艳冰
黄小艺,李鹤宾,陈艳红,3,4,姜泽东,3,4,倪 辉,3,4,李清彪,3,4,朱艳冰,3,4,
(1.集美大学海洋食品与生物工程学院,福建 厦门 361021;2.厦门医学院药学系,福建 厦门 361023;3.福建省食品微生物与酶工程重点实验室,福建 厦门 361021;4.厦门市食品生物工程技术研究中心,福建 厦门 361021)
褐藻是一种广泛分布在海洋生态系统中的大型藻类。褐藻胶是褐藻细胞壁中一种主要的线性多糖,占褐藻干质量的40%[1]。褐藻胶由D-甘露糖醛酸(β-Dmannuronic acid,M)和L-古罗糖醛酸(α-L-guluronic acid,G)通过1,4-糖苷键连接形成[2]。研究发现,褐藻胶降解成褐藻胶寡糖后,生物利用性和生物活性显著提高,包括抗凋亡、抗肿瘤、免疫调节、抗炎、抗菌和抗氧化等[3]。利用酶法制备褐藻胶寡糖具有反应特异性高、反应条件温和、降低环境污染等优点,在褐藻胶寡糖的制备中更具有优势[4]。
褐藻胶裂解酶通过β-消除机制作用于褐藻胶的1,4-糖苷键,最终在产物末端六元环C4和C5位生成不饱和双键,产生非还原端不饱和的褐藻胶寡糖[5-6]。褐藻胶裂解酶来源广泛,包括细菌、真菌、病毒和软体动物[5]。根据一级结构差异,褐藻胶裂解酶可分为15 个多糖裂解酶家族;根据裂解方式不同,可分为内切型和外切型褐藻胶裂解酶;根据底物特异性,可分为D-聚甘露糖醛酸钠(polyM)偏好型、L-聚古罗糖醛酸钠(polyG)偏好型和双功能型褐藻胶裂解酶[7]。褐藻胶裂解酶的酶学性质与其来源生物体和生存环境有一定关系[1],非催化结构域可能影响褐藻胶裂解酶的催化性质[2,8]。与其他多糖裂解酶一样,褐藻胶裂解酶是一种包含催化和非催化多结构域的裂解酶。褐藻胶裂解酶常见的非催化结构域包括碳水化合物结合模块(carbohydrate-binding module,CBM)[9-10]和F5/8 C型结构域。通常来说,催化结构域在识别、结合、降解底物方面扮演重要角色[11],而非催化模块影响酶的生化特性[12]。
大多数褐藻酸裂解酶的活性和稳定性较低[13],限制了该酶的广泛应用。褐藻胶裂解酶非催化结构域的截短或重组可能改良酶催化性质[7,14-16]。研究组前期从腐烂的海带中分离得到海洋微泡菌ALW1(Microbulbifersp.ALW1)[17],基因组分析发现含有1 个预测为PL7家族的褐藻胶裂解酶AlgL7的编码基因,该酶包含2 个非催化模块CBM和F5/8 C型结构域。为了解该酶非催化结构域的功能,通过基因截短、蛋白质表达和纯化,研究非催化模块对褐藻胶裂解酶AlgL7酶学性质的影响,旨在解析该酶非催化结构域与酶性质的构效关系,为酶的实践应用提供一定理论基础。
1 材料与方法
1.1 材料与试剂
微泡菌ALW1、大肠杆菌BL21(DE3)为本实验室保存。
海藻酸钠、polyM、polyG 国药集团化学试剂有限公司;EcoRI、BamHI、XhoI、T4DNA连接酶日本TaKaRa公司;细菌基因组提取试剂盒 天根生化科技(北京)有限公司;异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)、卡那霉素生工生物工程(上海)股份有限公司;3,5-二硝基水杨酸(3,5-dinitrosalicylic acid,DNS)试剂、2,2-联喹啉-4,4-二甲酸二钠(bicinchoninic acid kit,BCA)试剂盒厦门市淘烁生物科技有限公司;Ni Sepharose 6 Fast Flow美国GE Healthcare Life Sciences公司;其他化学试剂均为分析纯产品。
1.2 仪器与设备
Sorvall LYNX 4000高速冷冻离心机 美国赛默飞世尔科技有限公司;恒温振荡摇床 上海智城分析仪器制造有限公司;水浴锅 冠森生物科技有限公司;Epoch2T微量酶标仪 美国伯腾仪器有限公司;聚合酶链式反应(polymerase chain reaction,PCR)基因扩增仪伯乐生命医学产品有限公司;鼓风干燥箱 深圳市爱特尔电子科技有限公司;核酸电泳仪 美国GE Healthcare Life Sciences公司。
1.3 方法
1.3.1 褐藻胶裂解酶AlgL7的生物信息学分析
利用ExPAsy网站中ProtParam工具对褐藻胶裂解酶AlgL7的氨基酸组成、理论分子质量和等电点等理化性质进行预测。使用Clustal X2进行多序列比对,MEGA 11.0软件构建褐藻胶裂解酶AlgL7的系统发育树。利用NCBI的保守结构域模块进行蛋白质的结构域分析。
1.3.2 褐藻胶裂解酶AlgL7及其截短体基因工程菌株构建
参照细菌基因组提取试剂盒方法提取菌株ALW1的基因组DNA,以该基因组为模板,基于AlgL7保守结构域的预测结果,利用PCR分别扩增褐藻胶裂解酶AlgL7及其截短体(包括CD1和CD2)基因,引物序列如表1所示。获得PCR产物后,CD1基因利用限制性内切酶BamHI和XhoI进行酶切,AlgL7和CD2基因利用EcoRI和XhoI进行酶切,然后利用T4DNA连接酶分别将目的基因连接到pET-28a载体后,转化至大肠杆菌BL21(DE3)感受态细胞。利用含卡那霉素的平板筛选和菌落PCR鉴定后,重组质粒送至厦门铂瑞生物科技有限公司测序。

表1 用于扩增AlgL7及其截短体的引物Table 1 Primers used for the amplification of AlgL7 and its truncations
1.3.3 褐藻胶裂解酶AlgL7及其截短体的表达与纯化
将测序成功的褐藻胶裂解酶AlgL 7 及其截短体基因工程菌株按1%接种量接种至LB液体培养基(含50 µg/mL卡那霉素),37 ℃、180 r/min过夜培养,当OD600nm值达到0.6~0.8后加入IPTG(终浓度0.1 mmol/L),16 ℃诱导表达18~24 h。将发酵液4 ℃、5000×g离心10 min,弃上清液,加入缓冲液(50 mmol/L NaH2PO4、300 mmol/L NaCl、30 mmol/L咪唑,pH 8.0)悬浮菌体,在冰浴条件下进行超声破碎,条件为超声5 s、间隙5 s,总时间15 min,功率300 W。将处理液4 ℃、12000×g离心20 min,得到粗酶液。参照Ni Sepharose 6 Fast Flow使用说明书,利用亲和层析对重组酶进行分离纯化。利用十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析目的蛋白的纯度和分子质量,利用BCA试剂盒进行蛋白质定量。
1.3.4 褐藻胶裂解酶活力的测定
采用DNS法[18]。反应体系为5 μL酶液(0.11 mg/mL)加入200 μL 5 mg/mL海藻酸钠底物溶液(溶于50 mmol/L磷酸氢二钠-磷酸二氢钠缓冲液,pH 7.0),在最适温度下温浴15 min后,加入200 μL DNS试剂,沸水浴10 min,冷却至室温后,利用酶标仪在波长540 nm测定吸光度。褐藻胶裂解酶的活力定义为:在一定条件下,每分钟生成1 μmoL还原糖所需的酶量为1 个酶活力单位(U)。
1.3.5 褐藻胶裂解酶AlgL7及其截短体的底物特异性
分别配制质量浓度为5 mg/mL海藻酸钠、polyM、polyG溶液测定重组酶的活力,研究褐藻胶裂解酶AlgL7及其截短体的底物特异性。不同的底物与酶在最适温度下孵育15 min后,利用DNS法测定酶活力。
1.3.6 温度对褐藻胶裂解酶AlgL7及其截短体活性和稳定性的影响
在不同温度(20~60 ℃)下分别测定褐藻胶裂解酶AlgL7及其截短体的活力,研究酶的最适反应温度。分别将褐藻胶裂解酶AlgL7及其截短体在不同温度(20~40 ℃)下放置15 min后,立即置于冰浴5 min,测定酶的残余活力,研究酶的温度稳定性,以未经热处理的酶活力为100%。
1.3.7 pH值对褐藻胶裂解酶AlgL7及其截短体活性和稳定性的影响
在不同pH值条件下分别测定褐藻胶裂解酶AlgL7及其截短体的活力,研究酶的最适反应pH值。分别将褐藻胶裂解酶AlgL7及其截短体在不同pH值条件下25 ℃处理30 min后,测定酶的残余活力,研究酶的pH值稳定性,以未经处理的酶活力为100%。所用缓冲液为50 mmol/L柠檬酸-Na2HPO4缓冲液(pH 3.0~6.0)、NaH2PO4-Na2HPO4缓冲液(pH 6.0~8.0)、Tris-HCl缓冲液(pH 8.0~9.0)和甘氨酸-NaOH缓冲液(pH 9.0~11.0)。
1.3.8 褐藻胶裂解酶AlgL7及其截短体的动力学参数测定
在不同海藻酸钠底物质量浓度(0.5~5 mg/mL)下测定褐藻胶裂解酶AlgL7及其截短体的活力,利用Lineweaver-Burk双倒数作图法,计算酶的米氏亲和常数(Km)和最大反应速率(Vmax)。
1.3.9 褐藻胶裂解酶AlgL7及其截短体的酶解产物鉴定
50 mL 5 mg/mL海藻酸钠、polyG和polyM不同底物溶液中分别加入3 U褐藻胶裂解酶,于30 ℃条件下反应,每小时取样一次,利用DNS法测定还原糖的释放量;孵育8 h后,向反应混合液中添加3 U褐藻胶裂解酶,继续反应9 h,还原糖的释放量不再发生变化时,将反应物沸水浴灭活10 min,4 ℃、11100×g离心20 min,收集上清液。加入3 倍体积无水乙醇,4 ℃静置2 h后,4 ℃、18000×g离心20 min,取上清液,冻干得到褐藻胶寡糖产物。参照Li Zhipeng等[19]报道的液相色谱-质谱方法鉴定酶解产物。
1.4 数据处理
2 结果与分析
2.1 褐藻胶裂解酶AlgL7的序列分析
微泡菌ALW1的褐藻胶裂解酶AlgL7基因(GenBank收录号OM831233)有1893 个碱基对,预测编码630 个氨基酸残基的蛋白质,理论等电点(pI)为4.40,理论分子质量为71.5 kDa。系统发育分析显示,AlgL7与来自PL7家族的褐藻胶裂解酶处于同一分支(图1a),表明该褐藻胶裂解酶属于PL7家族。保守结构域分析显示,AlgL7含有CBM结构域(Ile55~Tyr158)、F5/8 C型结构域(Ala202~Val322)和C端催化结构域(Phe364~His630)(图1b)。C端催化结构域命名为CD1,包含F5/8 C型结构域和C端催化结构域的截短酶命名为CD2(图1b)。此外,序列比对确定了微泡菌ALW1来源的AlgL7中含有QIH(Gln497~His499)、RTELREMLR(Arg428~Arg436)和YFKAG(Tyr600~Gly604)3 个保守区域,推测它们与促进底物识别和酶功能有关[20]。
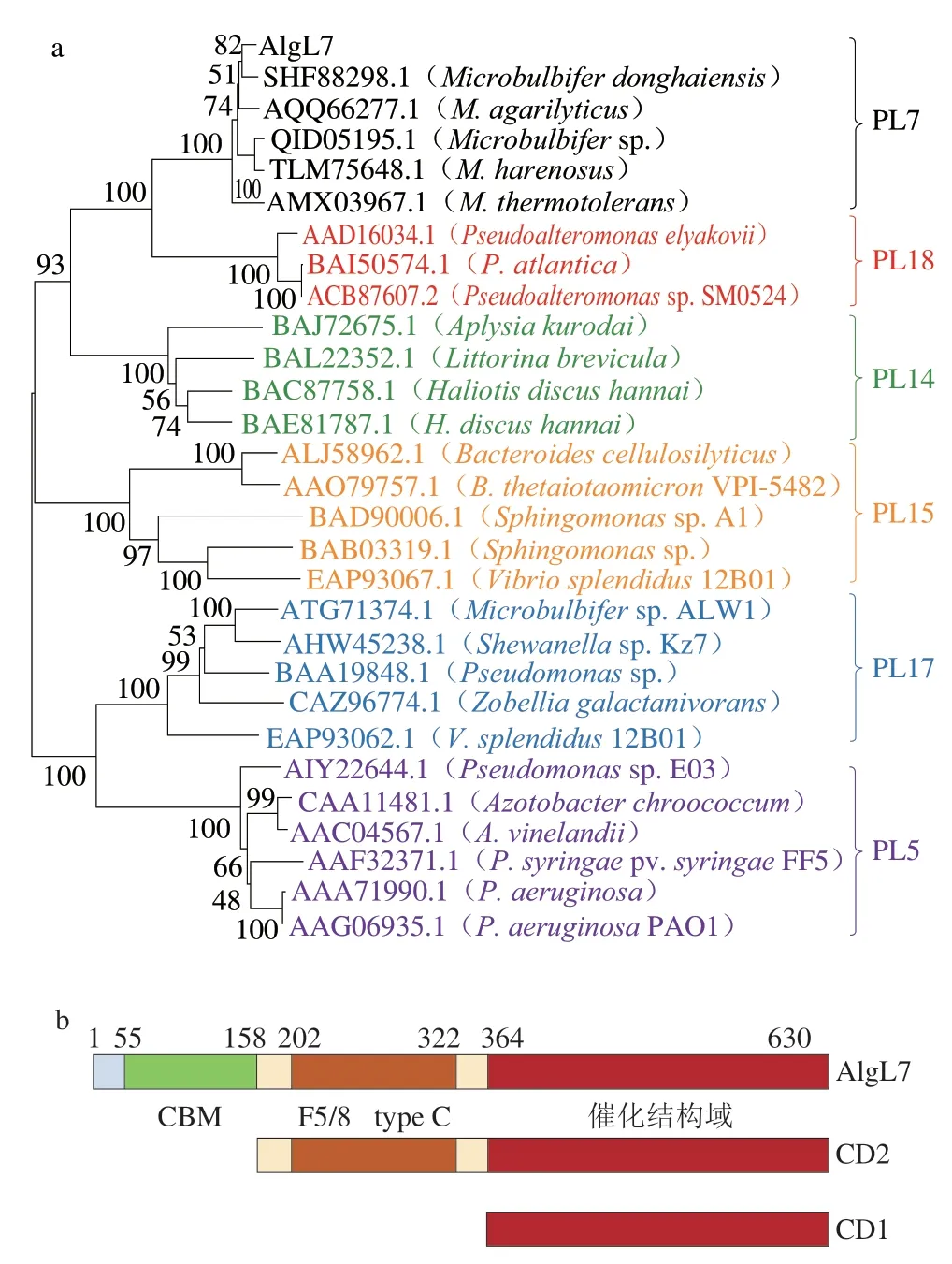
图1 褐藻胶裂解酶AlgL7的系统发育(a)和结构域(b)分析Fig.1 Phylogenetic analysis (a) and domain analysis (b) of alginate lyase AlgL7
2.2 褐藻胶裂解酶AlgL7及其截短体的表达与纯化
成功构建了AlgL7、截短体CD1和CD2的基因工程菌株,利用IPTG进行诱导表达后,进行重组蛋白的纯化,SDS-PAGE分析显示,目的蛋白成功纯化,AlgL7、CD1和CD2的分子质量分别约为71.5、32.0 kDa和60.0 kDa(图2a),与蛋白质的理论分子质量吻合。酶活力分析结果表明,以海藻酸钠为底物,AlgL7、CD1和CD2的比活力分别为125.1、125.9 U/mg和183.9 U/mg(图2b)。AlgL7和CD2的酶活力相比,CBM结构域截短会显著增强酶的催化活性,CD2是AlgL7全长酶活力的1.47 倍,来自Vibrio natriegensSK42.001褐藻胶裂解酶Aly01FL的CBM截短体也显示出类似酶活力增强的现象[21],来自Marinimicrobiumsp.H1褐藻胶裂解酶AlgH-I的CBM截短体显示出酶活力降低的影响结果[16]。CD1和CD2酶活力相比,F5/8 C型结构域截短会降低酶的催化活性,Flammeovirgasp.MY04来源褐藻胶裂解酶Aly5的F5/8 C截短体对海藻酸钠的酶活力也低于野生型酶[22],说明F5/8 C型结构域在维持酶活力方面具有重要作用。催化活性是酶应用的一个重要指标,高活性褐藻胶裂解酶在工业上具有更大的应用价值。
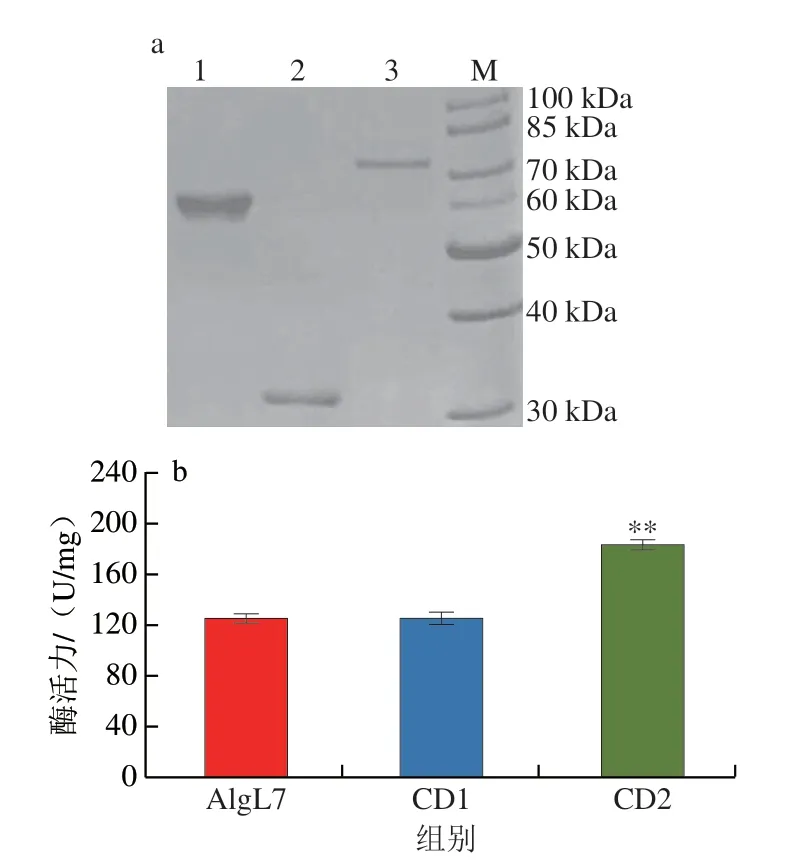
图2 褐藻胶裂解酶AlgL7及其截短体的SDS-PAGE(a)和酶活力(b)分析Fig.2 SDS-PAGE (a) and enzymatic activity (b) analysis of alginate lyase AlgL7 and its truncations
2.3 褐藻胶裂解酶AlgL7及其截短体的底物特异性
利用海藻酸钠、polyM和polyG 3 种多糖作为底物进行酶的底物特异性研究。如图3所示,AlgL7、CD1和CD2对海藻酸钠、polyM和polyG 3 种底物均有活性,说明非催化结构域CBM和F5/8 C型结构域未影响酶的底物特异性,它们对底物的催化活性不是必需,这与Yan Junjun等[16]报道的结果类似,底物特异性并没有因为删除CBM和F5/8 C型结构域而发生变化。另外,与AlgL7相比,CD2对ployG的酶活力显著提高,CD1和CD2对polyM的酶活力显著降低,CD2对海藻酸钠的酶活力显著提高,说明非催化结构域CBM和F5/8 C型结构域影响了酶对不同底物的催化活性。
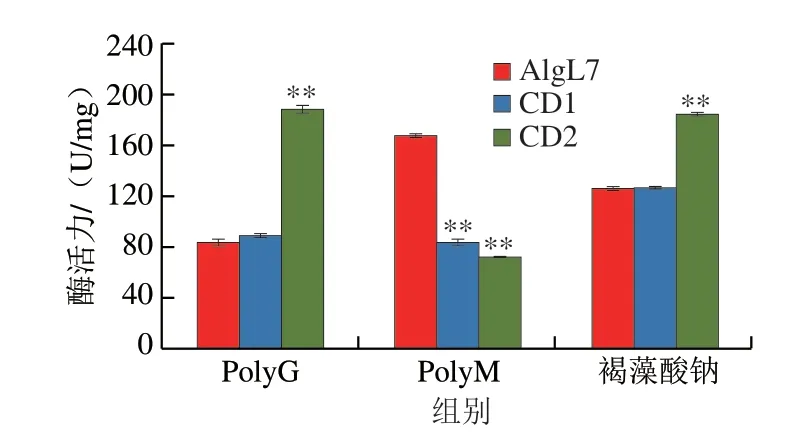
图3 褐藻胶裂解酶AlgL7及其截短体的底物特异性Fig.3 Substrate specificity of alginate lyase AlgL7 and its truncations
CBM为碳水化合物活性酶内的连续氨基酸序列,大多数独立形成β-三明治形状的折叠区,参与酶与底物的结合与识别,以及产物的释放[23-24]。与本研究结果不同,来自Agarivoranssp.L11褐藻胶裂解酶AlyL2的CBM13使该酶易于降解M-block底物[25]。与本研究结果类似,来源于Vibrio natriegensSK42.001褐藻胶裂解酶Aly01FL的CBM模块缺失导致酶对PolyM催化活性降低[21]。本研究中,去除CBM结构域的CD1和CD2截短酶对polyM酶活力显著降低(图3),说明非催化结构域CBM可能影响了AlgL7对PolyM底物的结合与识别。据报道,PL7家族褐藻胶裂解酶的底物特异性与保守区的蛋白质序列有关[26]。PL7家族的褐藻胶裂解酶包含3 个高度保守的区域(R/E)(S/T/N)EL、Q(I/V)H和YFKAG(V/I)YNQ,这些保守区域形成了β-三明治形状的空腔结合底物。本研究中,褐藻胶裂解酶AlgL7包含QIH保守结构域,是一个对polyM和polyG都起作用的双功能褐藻胶裂解酶。
F5/8 C型结构域被称为discoidin(DS)结构域,它可以通过增强酶与底物的相互作用能提高糖苷水解酶的水解活性[27]。本研究中,与CD2相比,去除F5/8 C型结构域的CD1截短酶对PolyG和海藻酸钠的酶活力显著降低(图3),说明F5/8 C型结构域可能影响了AlgL7对PolyG底物的相互作用。
2.4 温度对AlgL7及其截短体活性和稳定性的影响
如图4a所示,AlgL7和CD2在40 ℃时催化活性最高,CD1的最适反应温度为30 ℃,说明CBM对酶的最适反应温度无影响,F5/8 C型结构域去除降低了酶的最适反应温度。大部分PL7家族褐藻胶裂解酶的最适反应温度为30~45 ℃,例如Serratia marcescensNJ-07来源褐藻胶裂解酶AlgNJ-07[28]、Flammeovirgasp.strain MY04来源褐藻胶裂解酶Aly2[29]和Vibrio furnissiiH1来源褐藻胶裂解酶AlyH1[30]的最适反应温度均为40 ℃。根据Meng Qing等[21]的研究报道,移除CBM结构域并不改变褐藻胶裂解酶Aly01的最适反应温度。而褐藻胶裂解酶AlyL2中,截短CBM13结构域,酶的最适反应温度降低了10 ℃[25]。另外,与本研究结果类似,来自Flammeovirgasp.MY04褐藻胶裂解酶Aly5中F5/8 C型结构域的去除降低了酶的最适反应温度[22],表明F5/8 C型结构域在酶的生化特性中与酶最适反应温度紧密相关。
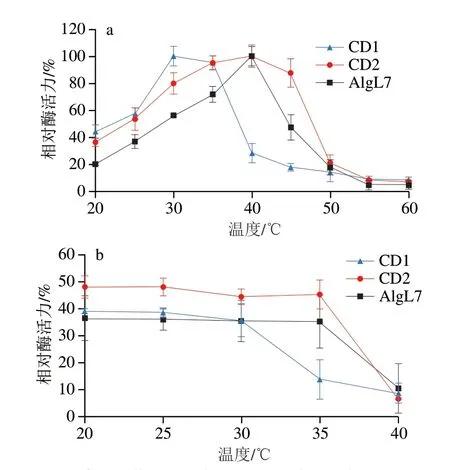
图4 温度对褐藻胶裂解酶AlgL7及其截短体酶活力(a)和稳定性(b)的影响Fig.4 Effect of temperature on the activity (a) and stability (b) of alginate lyase AlgL7 and its truncations
如图4b所示,相较于AlgL7,截短酶CD2的热稳定性显著增强,在20~35 ℃下孵育15 min,残余酶活力保持在45%以上,表明非催化结构域CBM的截短提高了酶的热稳定性。截短褐藻胶裂解酶的非催化结构域后,该酶可能具有紧凑的三维结构,更有利于抵抗热变性条件[7]。与本研究结果不同,褐藻胶裂解酶AlyL2的CBM提高了酶热稳定性[25]。另外,在20~35 ℃范围内,截短酶CD1的温度稳定性低于截短酶CD2,说明F5/8 C型结构域的去除降低了酶的温度稳定性。酶的温度稳定性提高有利于酶的工业应用[31]。
2.5 pH值对AlgL7及其截短体活性和稳定性的影响
如图5a所示,AlgL7及其截短体的最适反应pH值均为7.0,说明CBM和F5/8 C型结构域对酶的最适反应pH值无影响。褐藻胶裂解酶AlgH结构中F5/8 C型结构域也不改变酶的最适反应pH值[16]。如图5b所示,截短体CD2在pH 3.0~6.0和8.0~11.0范围内的pH值稳定性高于AlgL7,表明CBM的去除提高了酶在酸性和碱性条件下稳定性。对褐藻胶裂解酶AlyL2-FL去除C端的CBM结构域,最适反应pH值由8.6降低至7.0,在pH 3.0~6.0范围内去除CBM的截短体保留酶活力远低于原始型酶。对褐藻胶裂解酶VxAly7B去除N端的CBM结构域,酶的最适反应pH值提高了0.6,在pH 3.0~6.0范围内残余酶活力略高于原始型酶[32]。另外,本研究中截短酶CD2相较于CD1在pH 3.0~6.0和10.0~11.0范围内pH值稳定性高于CD1(图5b),表明F5/8 C型结构域提高了酶在酸性和碱性条件下的稳定性。
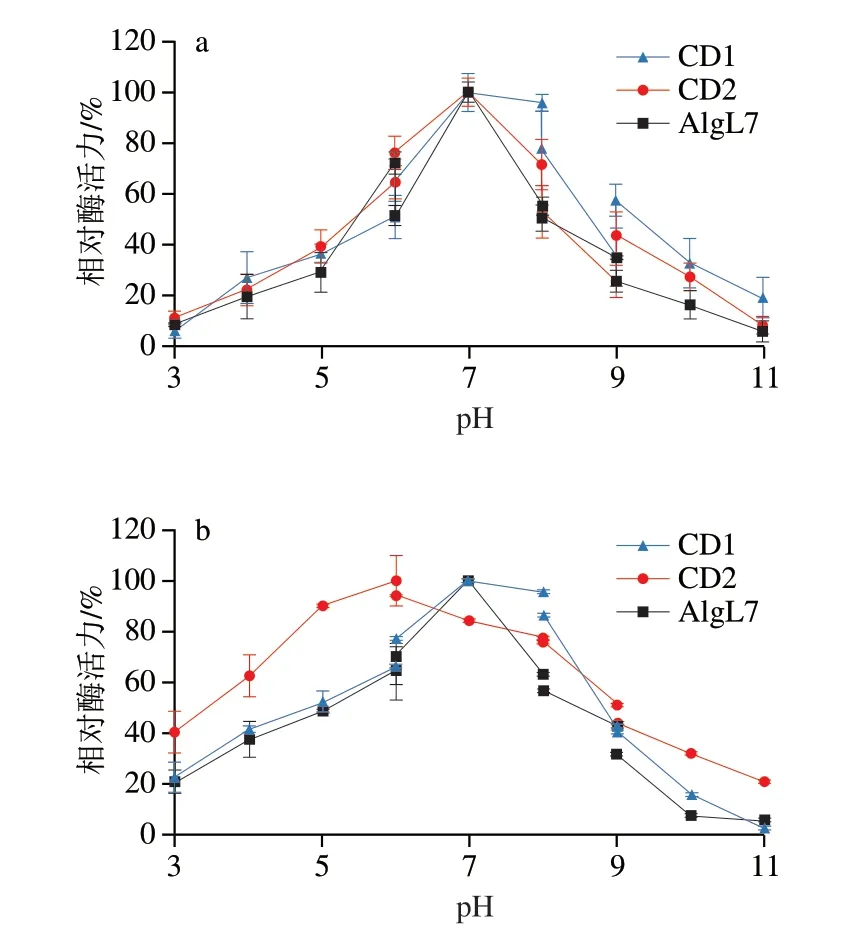
图5 pH值对褐藻胶裂解酶AlgL7及其截短体酶活力(a)和稳定性(b)的影响Fig.5 Effects of pH on the activity (a) and stability (b) of alginate lyase AlgL7 and its truncations
2.6 褐藻胶裂解酶AlgL7及其截短体的动力学参数
如表2所示,以海藻酸钠为底物,AlgL7的Km和Vmax值最低,CD2的Km和Vmax值最高,表明CBM结构域降低了酶的最大反应速率,但提高了酶与底物之间的亲和力,促进AlgL7与海藻酸钠的结合;F5/8 C型结构域提高了酶的最大反应速率,但降低了酶与底物之间的亲和力。相似的研究结果出现在Marinimicrobiumsp.H1来源褐藻胶裂解酶AlgH中,不含CBM的截短酶Km和Vmax值增大[16]。然而,在不同褐藻胶裂解酶中,CBM表现出不同的影响,例如CBM32降低了褐藻胶裂解酶VxAly7B对海藻酸钠的亲和力[32]。

表2 褐藻胶裂解酶AlgL7及其截短体对海藻酸钠的动力学参数Table 2 Kinetic parameters of alginate lyase AlgL7 and its truncations on sodium alginate
2.7 褐藻胶裂解酶AlgL7及其截短体的酶解产物分析
利用液相色谱-质谱分析AlgL7、CD1和CD2降解海藻酸钠、polyG和polyM的终产物组成。如图6所示,AlgL7能够将海藻酸钠降解生成聚合度为2、3和4的寡糖,降解polyG和polyM的主要产物为二糖和三糖(图6a~c),表明AlgL7是一种内切型褐藻胶裂解酶。CD1和CD2降解海藻酸钠、polyM和polyG的产物均为二糖和三糖(图6d~i)。上述结果表明,CBM和F5/8 C型结构域对酶解产物没有显著差异,表明非催化结构域在底物降解模式中没有发挥重要作用。
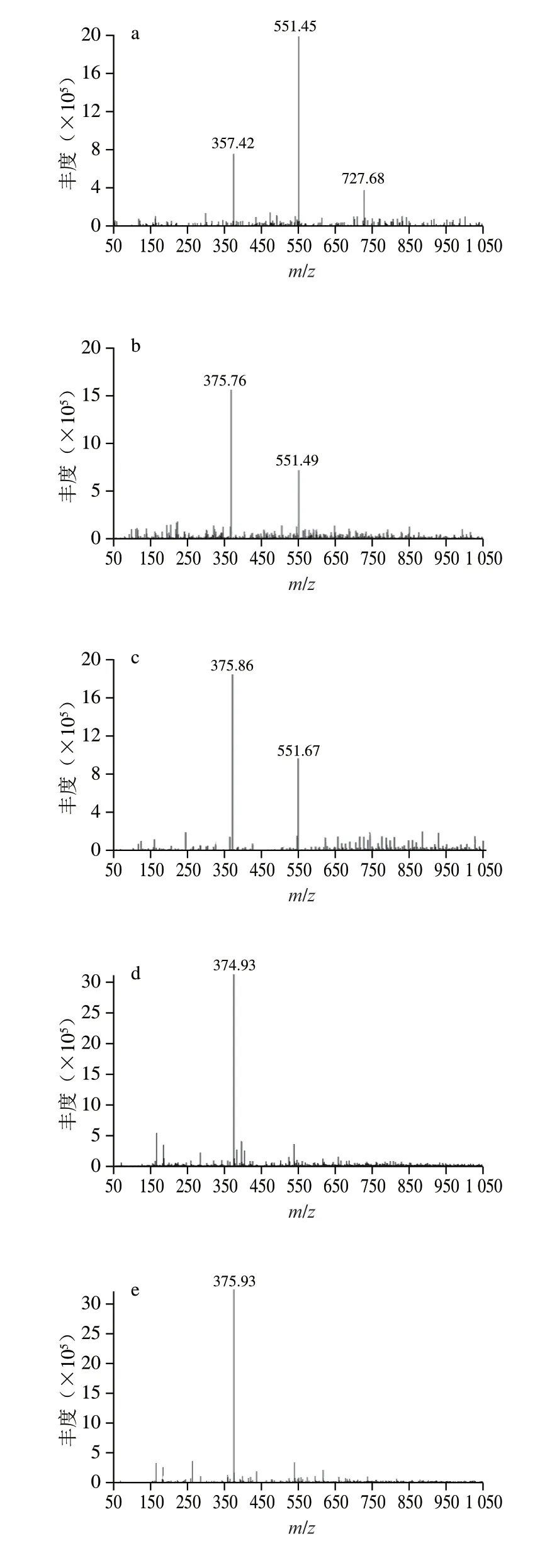
图6 褐藻胶裂解酶AlgL7及其截短体酶解产物的质谱分析Fig.6 Mass spectra of the enzymatic hydrolysates obtained using AlgL7 and its truncations
3 结论
克隆表达了微泡菌ALW1来源的褐藻胶裂解酶全长酶AlgL7及其两个截短酶CD1(催化结构域)、CD2(包含F5/8 C型结构域和催化结构域)。酶学性质的比较分析显示,CBM结构域降低了酶的催化活性、热稳定性和Vmax值,但提高了酶与底物的亲和力;F5/8 C型结构域提高了酶的催化活性、最适反应温度、热稳定性和Vmax值,但降低了酶与底物的亲和力。截短体CD2的酶活力和热稳定性得到显著提高,能降解海藻酸钠生成聚合度低的褐藻胶寡糖二糖、三糖和四糖。本研究明确了非催化模块CBM和F5/8 C型结构域对褐藻胶裂解酶AlgL7酶学性质的影响,获得了具有优良性质的截短酶CD2,扩大该褐藻胶裂解酶的应用范围。
