菜豆R2R3-MYB基因家族鉴定及其在BCMV侵染后的表达分析
2023-09-13王古悦唐慕宁牛静雅冯雪
王古悦,唐慕宁,牛静雅,冯雪
(山西农业大学 植物保护学院,山西 太谷 030801)
转录因子由DNA结合域、转录调控区、核定位信号和寡聚位点4个功能域组成[1]。根据DNA结合域的特异性,可将转录因子分为若干个不同的家族[2]。MYB基因家族是植物最大的转录因子家族之一,根据结构数不同又可将MYB划分为4个亚家族:1R-MYB(MYB-related)、R2R3-MYB、R1R2R3-MYB(3R-MYB)、4R-MYB[3]。其中,R2R3-MYB亚家族是MYB转录因子中最丰富的一类,在植物生长发育、次生代谢和非生物/生物胁迫中起着重要的作用[3-5]。目前,在拟南芥(Arabidopsis thalianaL.)[3]、甜樱桃(Prunus aviumL.)[6]、烟草(Nicotiana tabacumL.)[7]等多种植物中鉴定出R2R3-MYB基因家族成员。李彤等[8]用VIGS基因沉默技术和实时荧光定量PCR发现,番茄SlMYB28参与调控番茄黄叶卷曲病毒侵染;张亚丽等[9]在苹果愈伤组织中过表达MdMYB30并结合实时荧光定量PCR发现,苹果MdMYB30可增强对病原菌的抗性;邱正坤等[10]利用VIGS基因沉默和过表达技术发现,茄子SmMYB44可增强对青枯病的抗性等。然而,关于菜豆R2R3-MYB基因家族成员的数量和特点还未见报道。
菜豆(Phaseolus vulgarisL.)又称芸豆,是豆类食物来源之一,因其营养丰富、用途多样而备受关注[11]。菜豆普通花叶病毒(Bean common mosaic virus,BCMV)是菜豆及其他豆类上最常见和危害最严重的病毒之一。BCMV侵染菜豆后可引起花叶、矮缩、畸形、坏死等症状,严重时可造成绝收[12-13]。本研究通过对菜豆R2R3-MYB基因家族成员进行鉴定和综合分析,包括理化性质、基因结构、顺式作用元件、染色体定位、共线性分析、BCMV侵染后的基因表达模式等,旨在解析菜豆R2R3-MYB基因家族成员在BCMV侵染后的生物学功能。
1 材料和方法
1.1 菜豆R2R3-MYB基因家族成员鉴定及特征分析
从Phytozome v13数据库(https://phytozomenext.jgi.doe.gov/)下载菜豆参考基因组序列和注释文件。从TAIR数据库(http://plants.ensembl.org/index.html/)下载拟南芥参考基因组序列和注释文件,将126个拟南芥R2R3-MYB蛋白序列作为靶序列,通过TBtools、NCBI的Blast(http://www.ncbi.nlm.nhi.gov/)、NCBI的Conserved Domain Search(https://www.ncbi.nlm.nih. gov/cdd/?term=)分析,剔除没有MYB结构域、MYB结构域不完整或重复的序列,并利用SoftBerry网站(http://linux1.softberry.com/)补全剪接不完整的序列。利用ExPASy网站(https://web.expasy.org/protparam/)预测菜豆R2R3-MYB基因家族成员的理化性质。利用CELLO v.2.5网站(http://cello.life.nctu.edu.tw/)进行亚细胞定位预测。利用MUSCLE对菜豆R2R3-MYB进行多序列比对,后利用TBtools软件进行可视化。
1.2 菜豆R2R3-MYB基因家族成员系统进化分析
利用MEGA-X软件采用邻接法,校验参数Bootstrap设置为1 000,其他参数保持默认值,构建系统进化树。利用iTOL网站(https://itol.embl.de/)美化进化树。
1.3 菜豆R2R3-MYB基因家族成员保守基序、基因结构、顺式作用元件分析
利用MEME网站(https://meme-suite.org/meme/tools/meme)预测菜豆R2R3-MYB基因家族成员的保守基序序列,设置最大基序数为20,其他参数保持默认值。利用TBtools软件提取菜豆R2R3-MYB基因家族成员起始密码子上游2 kb序列信息,并利用PlantCARE网站(http://bioinformatics.psb.ugent.be/webtools/plantcare/html/)预测顺式作用元件。
1.4 菜豆R2R3-MYB基因家族成员染色体定位及共线性分析
根据菜豆基因组注释文件,得到基因在染色体上的位置信息,并利用TBtools软件进行可视化。利用TBtools软件分析菜豆基因组内和菜豆与拟南芥基因组间的共线性关系,并计算每对复制事件的非同义替代率(Ka)、同义替代率(Ks)和Ka/Ks值。根据Ks值和突变率λ=1.5×10-8,估计菜豆复制事件分化时间(T=Ks/2λ)[14]。
1.5 菜豆R2R3-MYB基因家族成员在BCMV侵染后的转录组分析
以菜豆Dubbele Witte(DW)为试验材料,于28 ℃(光照16 h)/25 ℃(黑暗8 h),相对湿度50%的人工培养箱生长。在菜豆DW子叶完全展开时,BCMV分离物C54摩擦接种菜豆DW,PBS溶液摩擦菜豆DW作为对照组,接毒14 d后分别采集接种叶和系统叶,所有样品于液氮速冻后送至北京百迈客生物科技有限公司进行RNA-Seq分析。FPKM值进行Log2(FPKM+1)转换并利用TBtools软件绘制表达热图,以|FC|≥1.5且FDR<0.05作为筛选差异表达基因的标准,每个处理设置3次生物学重复。
1.6 实时荧光定量PCR分析
分别采集0、2、4、8、16 h和1、3、5、7、14、21 d的叶片,利用Trizol(Biosharp,中国)提取叶片总RNA,使用Hiscript Ⅲ All-in-one RT SuperMix Perfect for qPCR反转录试剂盒(Vazyme,中国)合成cDNA。利用IDT网站(https://sg.idtdna.com/pages)设计基因特异性引物(表1),以Act11为内参基因[15],使用ChamQ Universal SYBR qPCR Master Mix试剂盒(Vazyme,中国)在实时荧光定量PCR仪上进行试验。
反应体系为20 μL:2×ChamQ Universal SYBR qPCR Master Mix 10 μL,ddH2O 8.2 μL,上下游引物各0.4 μL,cDNA 1 μL。PCR反应程序为:95 ℃3 min;95 ℃ 10 s和60 ℃ 15 s进行40个循环;95 ℃15 s,60 ℃ 1 min,95 ℃ 15 s。设置3次技术重复,采用2-ΔΔCT计算目的基因的相对表达量,利用GraphPad Prism 8作图。
2 结果与分析
2.1 菜豆R2R3-MYB基因家族成员染色体定位
利用TAIR、SoftBerry、NCBI、TBtools等工具对菜豆R2R3-MYB基因家族成员进行筛选和鉴定,最终得到159个R2R3-MYB基因家族成员,其中157个不均匀分布在11条染色体上,依据在染色体的排列顺序分别命名为PvMYB1~PvMYB157;而PvMYB158和PvMYB159未定位到染色体。染色体定位结果显示,3号染色体分布的基因最多,有21个,而6号染色体分布的基因最少,只有8个。大多数基因聚集在染色体两端(图1)。
2.2 菜豆R2R3-MYB基因家族成员鉴定及特征分析
理化性质分析可见,159个菜豆R2R3-MYBs编码蛋白的长度为184~554个氨基酸,分子质量为20 692.45~61 028.67 u,等电点为4.79~10.34,所有蛋白亲水性值小于0,158个蛋白不稳定系数大于40,亚细胞定位预测显示,155个成员位于细胞核(表2)。
R2和R3重复序列显示,R2结构域中有3个保守的色氨酸残基(W),3个色氨酸残基之间相隔19个氨基酸残基(图2-A)。R3结构域中只发现2个色氨酸残基(W),而第1个色氨酸残基被疏水氨基酸替代,如苯丙氨酸(F)、异亮氨酸(I)、亮氨酸(L),3个保守氨基酸残基之间相隔18个氨基酸残基(图2-B)。同时,在R2重复中的G-4、E-10、D-11、L-14、G-22、L-35、R-37、K-40、C-42、R-43、R-45、N-48、L-50、P-52和R3重复中的E-10、G-22、I-28、A-29、P-33、G-34、R-35、T-36、D-37、N-38、K-41、N-42高度保守。

图2 菜豆R2R3-MYB基因家族成员的R2(A)和R3(B)重复序列标识Fig.2 Sequence logos of the R2(A)and R3(B) repeats of R2R3-MYB gene family members in common bean
2.3 菜豆R2R3-MYB基因家族成员系统进化分析
将159个菜豆R2R3-MYB蛋白序列和126个拟南芥R2R3-MYB蛋白序列构建系统进化树,根据与拟南芥序列的相似性和拓扑结构,将菜豆R2R3-MYB基因家族成员划分为32个亚组(P1~P32)(图3),大多数亚组包含菜豆和拟南芥成员,如P2、P3、P16亚组等;P1、P15亚组不包含拟南芥成员,而在菜豆中没有发现与拟南芥S12亚组聚类的成员。
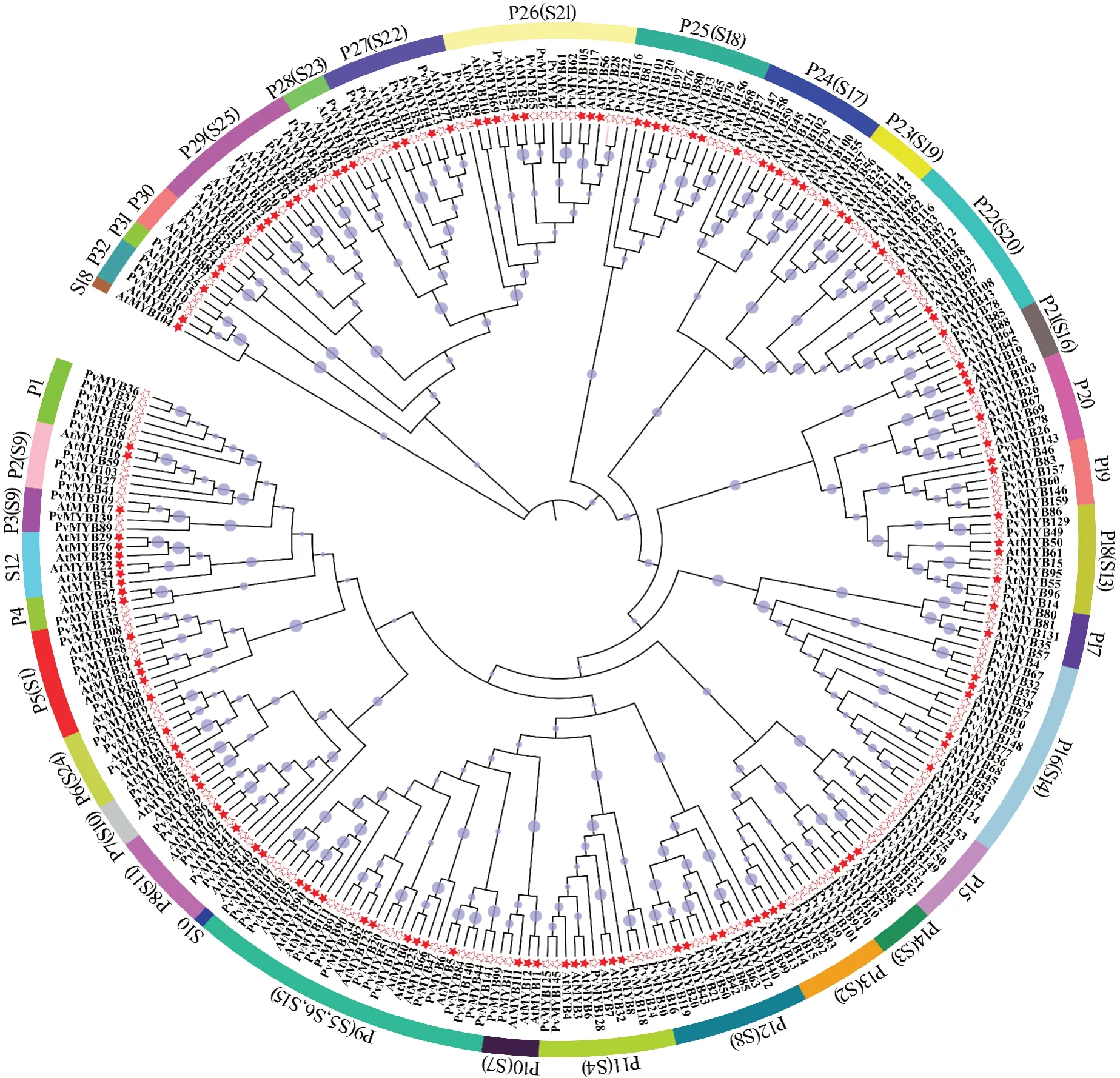
图3 菜豆(☆)与拟南芥(★)R2R3-MYB基因家族成员的系统进化树Fig.3 Phylogenetic tree of the R2R3-MYB gene family members between common bean(☆)and Arabidopsis thaliana(★)
2.4 菜豆R2R3-MYB基因家族成员保守基序、基因结构、顺式作用元件分析
从159个菜豆R2R3-MYB基因家族成员所编码的蛋白序列中,共预测了20个保守基序(图4-B)。多数成员具有5个保守基序并按Motif 3、Motif 4、Motif 2、Motif 7、Motif 1依次排列在N端。一些亚组的成员在C端检测到特殊基序,如P22亚组中检测到Motif 11,P32亚组中检测到Motif 20,表明这些基因可能具有独特功能。菜豆R2R3-MYB基因家族成员包含0~13个内含子(图4-C)。PvMYB1、PvMYB18、PvMYB53、PvMYB117、PvMYB122未发现内含子,而PvMYB23内含子数最多。
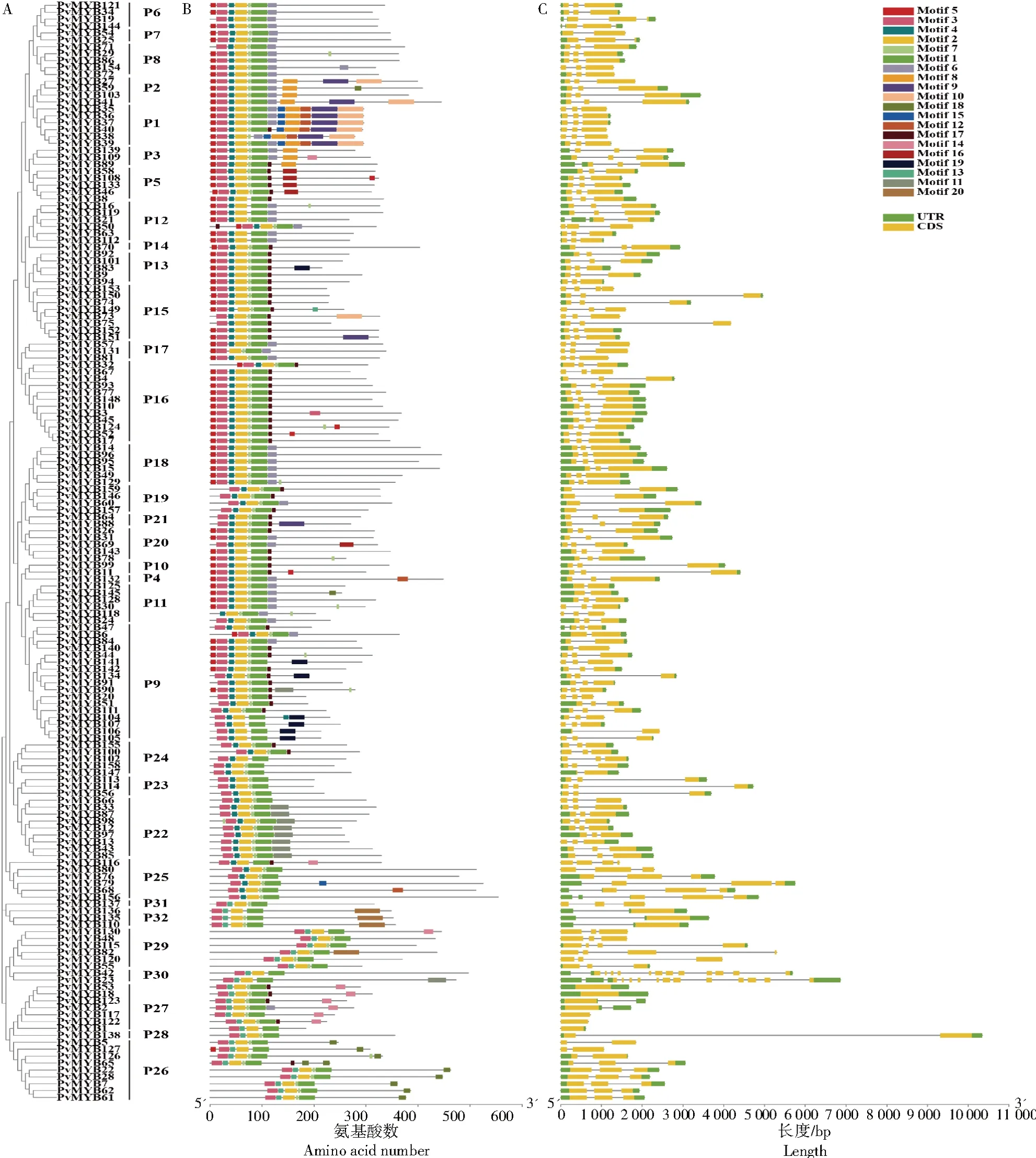
图4 菜豆R2R3-MYB基因家族成员的系统发育树(A)、保守基序(B)和基因结构(C)Fig.4 Phylogenetic tree(A),conserved motif(B),and gene structure(C)of R2R3-MYB gene family members in common bean
在菜豆R2R3-MYB基因家族成员起始密码子上游2 kb启动子区,共预测到58种顺式作用元件,可将其分为植物生长发育、光响应、植物激素反应、非生物/生物胁迫四大类(图5)。
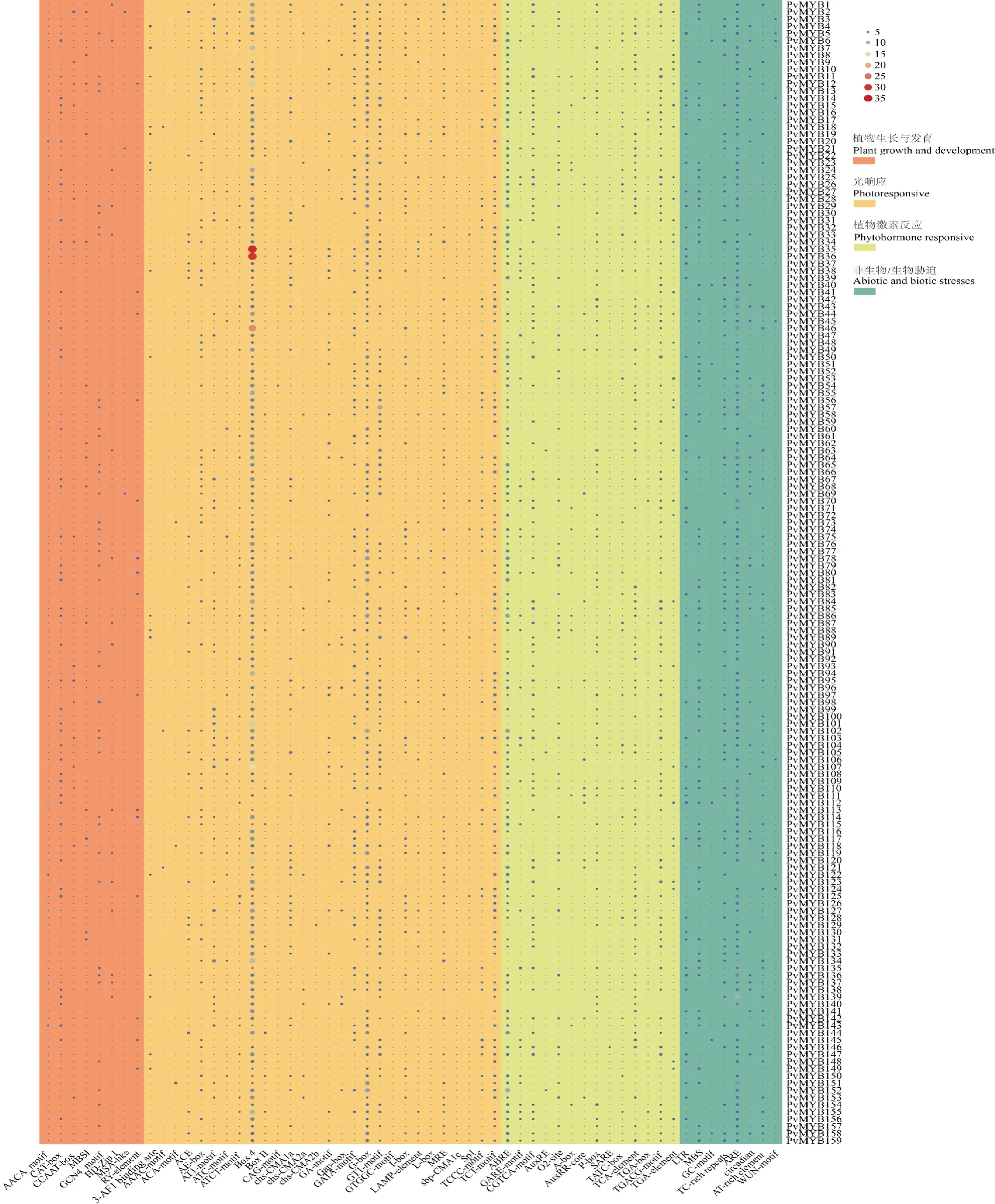
图5 菜豆R2R3-MYB基因家族成员启动子区的顺式作用元件Fig.5 Cis-elements in promoter region of R2R3-MYB gene family members in common bean
植物生长发育包含8种元件,其中CAT-box(分生组织表达)占比最高,为32.75%;其次是GCN4_motif(胚乳表达),占比23.56%。光响应包含28种元件,其中,Box 4占比最高,为32.95%;其次是G-box,占比16.96%。植物激素反应包含14种元件,其中ABRE(脱落酸响应)占比最高,为33.19%;其次是CGTCA-motif(茉莉酸响应)和TGACG-motif(茉莉酸响应),均占比13.23%;再次为TCA-element(水杨酸响应),占比11.31%。非生物/生物胁迫包含8种元素,其中ARE(厌氧诱导)占比最高,为50.50%;其次是MBS(干旱诱导),占比14.49%;再次为TC-rich repeats(防御和应激反应),占比11.76%。
2.5 菜豆R2R3-MYB基因家族成员共线性分析
菜豆基因组内的共线性分析显示,在不同的染色体上共有72对片段复制事件(图6)。片段复制事件的Ks值为0.519 8~5.436 9,表明该复制事件很可能发生在17百万~181百万年。串联复制事件的Ks值为0~2.948 9,表明该复制事件很可能发生在0~98百万年;这些复制事件的Ka/Ks值均小于1,表明这些基因均经历了纯化选择,在很大程度上有助于维持菜豆R2R3-MYB基因功能。
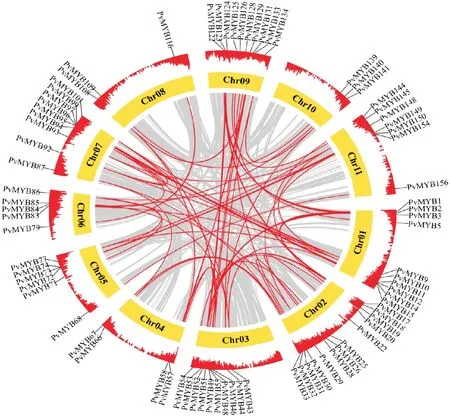
图6 菜豆R2R3-MYB基因家族成员的共线性分析Fig.6 Collinearity analysis of R2R3-MYB gene family members in common bean
2.6 菜豆R2R3-MYB基因家族成员在BCMV侵染后的表达分析
转录组数据明确了BCMV分离物C54侵染菜豆感病品种DW后寄主在显症期时的叶片基因表达水平(登录号PRJNA900512)。去除不表达或低表达水平(FPKM<0.5)的基因,最终得到67个菜豆R2R3-MYB基因家族成员的表达热图(图7)。
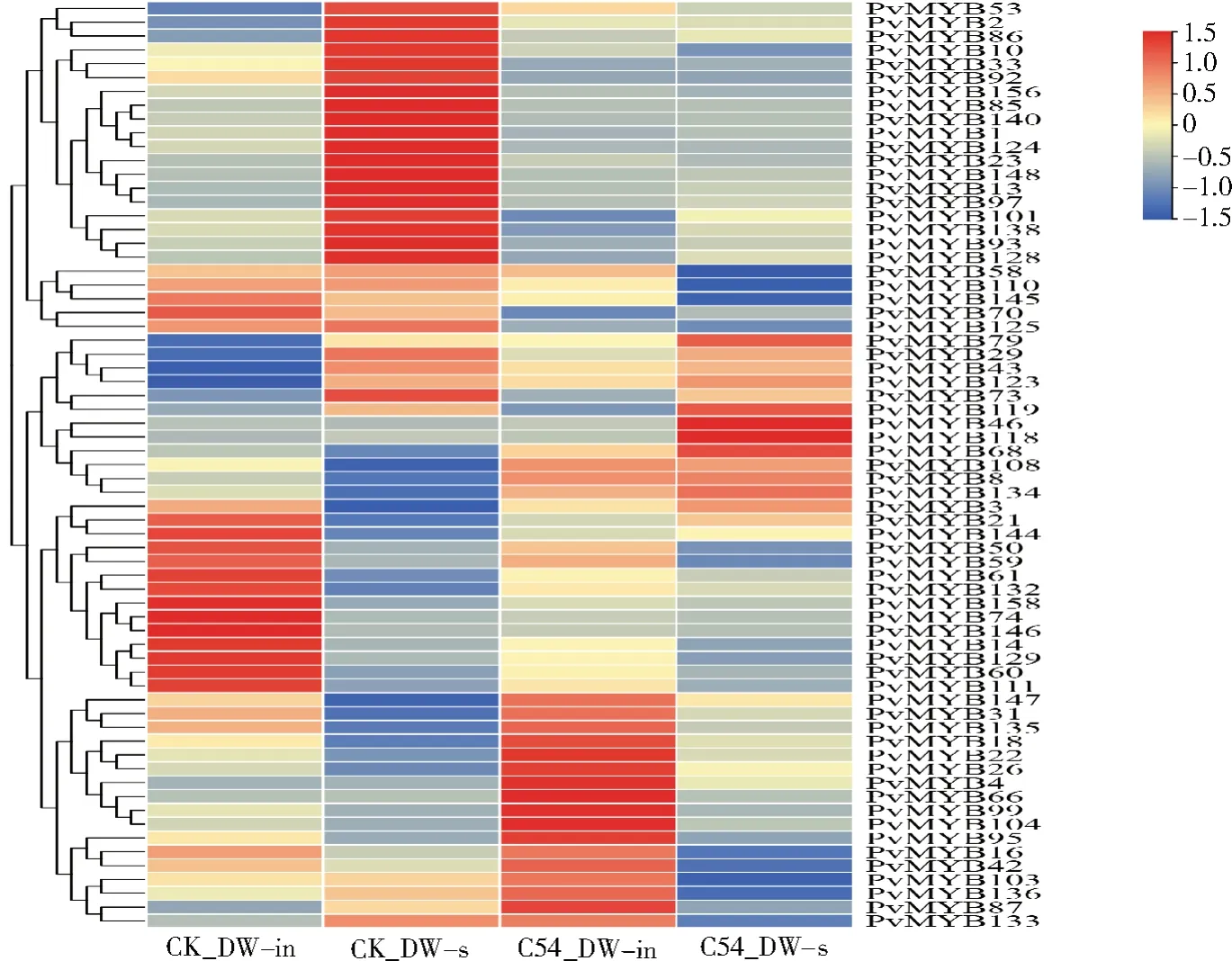
图7 BCMV侵染菜豆后R2R3-MYB基因家族成员的表达热Fig.7 Heatmap of R2R3-MYB gene family members expression in common bean after BCMV infection
图7结果表明,与对照组相比,在接种叶和系统叶中共有53个差异表达基因:接种叶有20个差异表达基因,其中11个上调,9个下调;系统叶有33个差异表达基因,其中20个上调,13个下调。基于转录组数据,发现PvMYB18、PvMYB29、PvMYB33、PvMYB92、PvMYB93、PvMYB97、PvMYB128、PvMYB124、PvMYB134等基因在受到侵染后表达量差异较大。
为分析菜豆R2R3-MYB家族基因成员在显症期的表达水平,对上述差异较大的9个基因进行在BCMV侵染不同时间下的qRT-PCR,结果表明(图8),在BCMV侵染早期,所有基因的相对表达量均有上调:其中,PvMYB18、PvMYB124、PvMYB134在2 h时上调幅度最大;PvMYB29、PvMYB33、PvMYB92、PvMYB128在4 h时上调幅度最大;PvMYB97和PvMYB93则分别在8、16 h时上调幅度最大。在病毒侵染后不断复制直至寄主显症期,PvMYB33、PvMYB92、PvMYB93的表达量呈先升高后降低的趋势,在7 d时相对表达量最高。
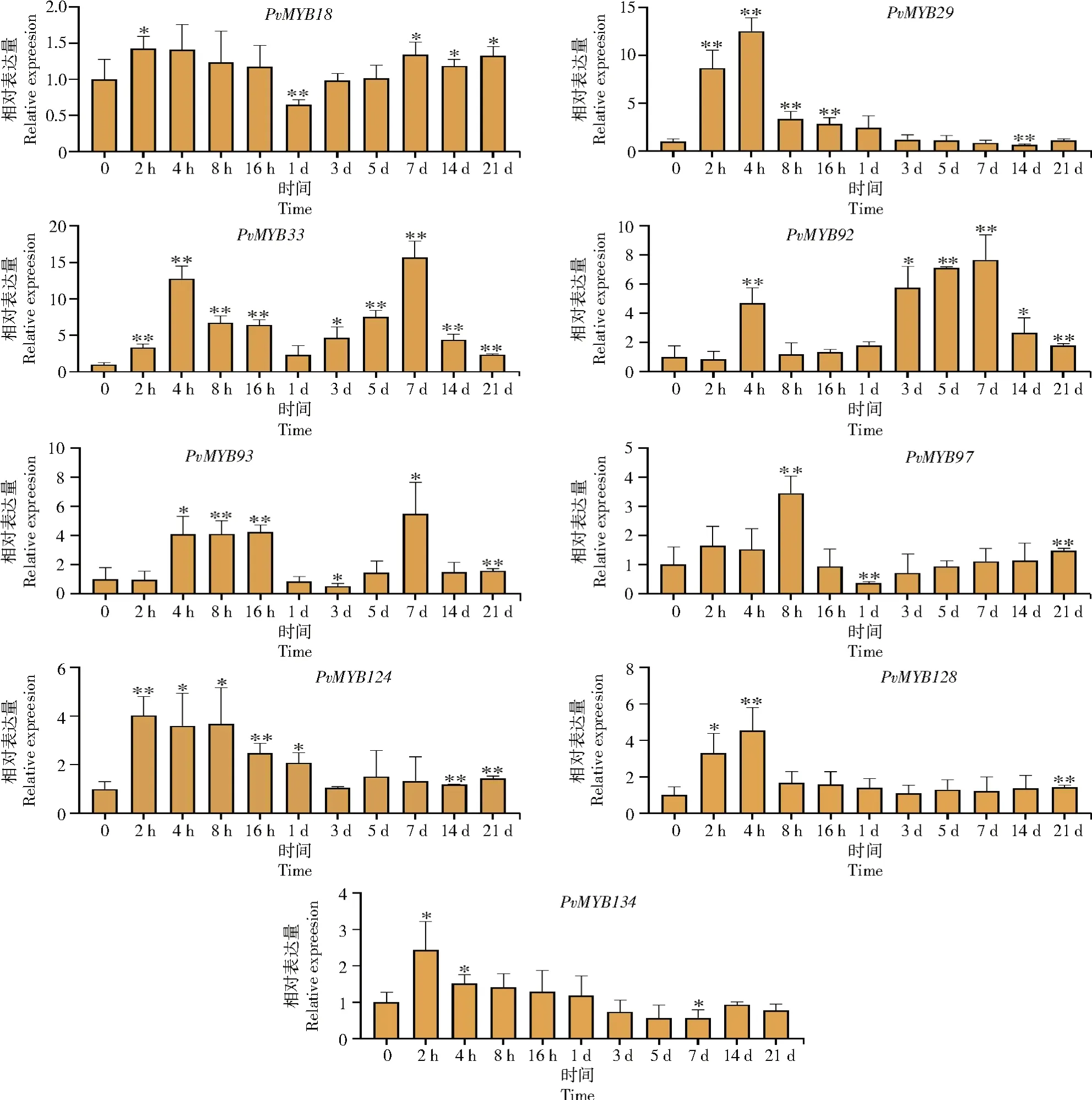
图8 BCMV侵染菜豆后菜豆R2R3-MYB基因家族成员的相对表达量Fig.8 Relative expression of R2R3-MYB gene family members in common bean after BCMV infection
3 结论与讨论
本研究从菜豆基因组中鉴定到159个R2R3-MYB基因家族成员,其中有2个基因没有定位到染色体上,可能是由基因组注释不全造成的。少数基因在C端有一些特殊基序,如motif 14、motif 20,这可能是成员功能多样性的重要原因。菜豆R2R3-MYB蛋白由高度保守的MYB结构域组成,R2重复序列有3个高度保守的色氨酸残基,而R3重复序列在第1个色氨酸残基处存在多样性,这与拟南芥报道一致[16]。系统进化分析表明,大多数亚组包含菜豆和拟南芥成员,表明它们来自共同的祖先。而一些亚组不含拟南芥成员,这可能与菜豆和拟南芥的物种特异性适应有关。在菜豆R2R3-MYB基因家族中,有72对片段复制事件和18对串联复制事件,表明片段复制事件对其扩增起着重要的作用,这与马铃薯(Solanum tuberosumL.)报道一致[17]。
菜豆R2R3-MYB基因家族成员上游调控区发现,ABRE、CGTCA-motif、TCA-element、TGACG-motif、TC-rich repeats等顺式作用元件分别与脱落酸响应、茉莉酸响应、水杨酸响应、防御和应激反应相关。已有报道,病毒侵染可以影响植物体内脱落酸含量[18];茉莉酸是对死体营养型病原体和昆虫侵袭的防御反应的调节剂[19];水杨酸可以影响病毒在受侵染植物体内细胞间运输、长距离移动和复制[20]。这些结果预示了菜豆R2R3-MYB基因家族成员在生物胁迫响应中的潜在作用。
通过qRT-PCR检测了菜豆R2R3-MYB基因家族成员在BCMV侵染后不同时刻的相对表达水平:9个目标基因在BCMV侵染后早期均出现上调,PvMYB33、PvMYB92、PvMYB93在显症期出现显著上调。其中,PvMYB33和PvMYB97与拟南芥S20亚组聚为一类,S20亚组成员AtMYB108在脱落酸诱导的细胞死亡中起调控作用[21];PvMYB92与拟南芥S2亚组聚为一类,S2亚组成员AtMYB15的过表达可以改善拟南芥的耐旱性和耐盐性[22];PvMYB93和PvMYB124与拟南芥S14亚组聚为一类,S14亚组成员AtMYB36、AtMYB37、AtMYB84、AtMYB87与植物生长发育相关[23-24]。此外,PvMYB18与拟南芥S22亚组聚为一类,S22亚组成员AtMYB44可以激活水杨酸介导的防御反应,调节对生物营养型病原体丁香假单胞菌的抗性[25]。PvMYB29与拟南芥S11亚组聚为一类,S11亚组成员AtMYB102有助于拟南芥抵抗菜青虫的取食[26]。PvMYB128与拟南芥S4亚组聚为一类,S4亚组成员AtMYB3、AtMYB4、AtMYB7、AtMYB8、AtMYB32属于一般苯丙素代谢和木质素阻遏剂,木质素有助于植物对生物和非生物胁迫的反应[27-28]。PvMYB134与AtMYB82聚类在一个分支上,AtMYB82参与毛状体发育的调控,拟南芥毛状体细胞可以感知外部机械刺激而诱导防御相关基因的表达[29-30]。因而推测这些基因可能直接或间接地参与了菜豆感性品种对BCMV侵染应答的调控,但菜豆R2R3-MYB基因家族成员在BCMV侵染过程中具体作用的分子机制及这些基因是否具有组织特异性还有待进一步研究。
本研究通过生信分析,明确了菜豆R3R3-MYB基因家族共有159个成员,其中157个成员不均匀分布于11条染色体上,依次命名为PvMYB1~PvMYB157,而PvMYB158和PvMYB159未定位在染色体上。系统发育树可将其分为32个亚组,顺式作用元件分析发现,该家族成员含有多种逆境响应元件。qRT-PCR结果显示,PvMYB33、PvMYB92、PvMYB93在4 h和7 d时有较高的表达量,PvMYB29、PvMYB97、PvMYB124、PvMYB128、PvMYB134在侵染早期出现较高的表达量,推测它们在菜豆受到BCMV侵染后的不同阶段发挥着重要作用,为了解菜豆R2R3-MYB基因家族的生物学功能提供理论基础。
