基于响应面法优化贝莱斯芽孢杆菌C44发酵参数
2023-09-13马红珍闫敏李磊杨治平张家星蒙秋霞史向远
马红珍 ,闫敏 ,李磊 ,杨治平 ,张家星 ,蒙秋霞 ,史向远
(1.山西农业大学 资源环境学院,山西 太原 030031;2.山西农业大学 生态环境产业技术研究院,山西 太原 030031;3.山西农业大学 园艺学院,山西 太谷 030801;4.山西农业大学 山西有机旱作农业研究院,山西 太原 030031)
贝莱斯芽孢杆菌(Bacillus velezensis)能够产生多种生物活性物质,具有良好的生物学功能,在促进植物生长和防治植物真菌病害方面具有重要作用。相关研究表明,贝莱斯芽孢杆菌FKM10可以通过增加生物量、促进养分吸收、改善土壤肥力、改变土壤微生物群落结构等促进湖北海棠的生长[1]。多花黄精内生贝莱斯芽孢杆菌ZJU-3可产生多种植物激素[2],发酵液中的脂肽粗提物能显著抑制尖孢镰刀菌菌丝的生长,抑制率达到51.6%,展现出较好的促生与抑菌效果。KIM等[3]研究证实,贝莱斯芽孢杆菌AK-0对真菌病原体Colletotrichum gloeosporioidesYCHH4的菌丝生长具有较强的抑制作用,在田间条件下可有效防制苹果炭疽病。此外,贝莱斯芽孢杆菌还陆续被证实对黄瓜枯萎病菌、油菜菌核病菌、亚麻炭疽病菌、亚麻枯萎病菌、辣椒疫霉病菌、油茶炭痕病菌及马铃薯立枯病菌均有明显的抑制效果[4],是一种极具应用前景的新型生防菌[5-7]。贝莱斯芽孢杆菌C44分离自浑源健康黄芪根际土壤中,对黄芪根腐病的主要致病菌尖孢镰刀菌[8]有较强的抗菌活性,有较大的应用需求与应用价值。但有关贝莱斯芽孢杆菌的发酵研究尚少,发酵效果较差,要想将贝莱斯芽孢杆菌C44广泛生产并应用于环境中还需要对其发酵条件进行进一步优化。
发酵培养基成分(碳源、氮源和无机盐等)和培养条件(温度、pH和转速等)对微生物数量和抗菌活性强弱有很大的影响[9-10]。目前,在有关微生物发酵培养基与培养条件的优化方法中,报道最多的是采用响应面法。响应面分析法对工艺条件优化效果较好[11-13],其中Plackett-Burman试验与Box-Behnken试验可用来判断试验因素及交互作用对目标响应值影响程度,准确表达因素对响应值的影响。通过中心组合试验,拟合得到二次多项式模型,从试验设计到结果表述,均较为准确[14]。响应面法对试验设计进行了优化,以科学的方法来布置试验,并对试验结果进行处理,消耗最小的人力、物力,在最少的时间获得更多更好的生产[15]。因此,响应面法被广泛应用于微生物发酵过程的优化并取得了较好的效果,乔佳慧子等[16]使用响应面法优化萎缩芽孢杆菌E20303发酵培养基,优化后抑菌率由51.15%提高至72.51%;郭艳霞[17]等用响应面法对贝莱斯芽孢杆菌YB19产生中性蛋白酶的活力进行了发酵条件优化,使得其菌株产中性蛋白酶活力为370.03 U/g。
本研究将通过单因素试验与响应面法相结合,以微生物数量和抗菌活性物质为参考指标,优化贝莱斯芽孢杆菌C44发酵条件,使之高效发酵,增加菌落数,同时增强抗菌活性,还尽可能地缩短贝莱斯芽孢杆菌菌株扩培周期,以期为该生防菌进一步扩大培养提供一定的帮助。
1 材料和方法
1.1 试验材料
供试菌株为贝莱斯芽孢杆菌(Bacillus velezensis)C44和黄芪根腐病菌尖孢镰刀菌(Fusarium oxysporum),均由山西农业大学生态环境产业技术研究院实验室保存。
供试基础培养基[18]有LB培养基、SOB培养基、YPD培养基、NB培养基、NBG培养基。
主要试剂有胰蛋白胨、牛肉膏、酵母提取物(生物试剂,北京奥博星生物技术有限责任公司);氯化钠、磷酸氢二钠、氯化钾(分析纯,天津市北辰方正试剂厂);蔗糖、乳糖、葡萄糖(分析纯,天津市科密欧化学试剂有限公司);硫酸铵(分析纯,天津市致远化学试剂有限公司);磷酸氢二钾(分析纯,天津市北辰方正试剂厂);硫酸镁、硫酸锰(分析纯,天津市凯通化学试剂有限公司);氯化钙(分析纯,天津市兴复科技发展有限公司)。
1.2 试验方法
1.2.1 菌落数与抗菌活性测定
1.2.1.1 菌落数测定 用菌落计数法[19],取贝莱斯芽孢杆菌发酵菌液1 mL加入9 mL无菌试管水中,充分振摇,梯度稀释到1.0×107倍,然后将100 μL稀释液吸入牛肉膏蛋白胨平板(NA)中,涂匀后在30 °C下培养48 h,对NA培养平板上的菌落数进行统计并重复3次。
1.2.1.2 抗菌活性测定 用双层平板法进行研究[20],将发酵好的菌液于10 000 r/min离心25 min,取上清液,过滤(0.22 μL滤膜)备用。将琼脂培养基10 mL注入培养皿内,放置在水平面上,待其凝固,再取孢子浓度1.0×106cfu/mL尖孢镰刀菌菌悬液,在熔化50 °C左右PDA培养基里混合,二者液体之比为1∶10,混合液倒入上述凝固培养皿内5 mL,放在水平台面固化。将无菌牛津杯竖直放置于双层检测平板之上,添加200 μL的贝莱斯芽孢杆菌待测液进行试验,置于培养箱内,培养72 h,测抑菌圈的直径并重复3次。
1.2.2 培养基与发酵条件优化
1.2.2.1 基础培养基筛选 将活化后的C44菌株在NB液体培养基中接种,于30 °C、180 r/min条件下振荡培养18 h为种子液。基础培养的条件为:转速180 r/min、培养温度30 ℃、接种量体积比为3%、装液量体积比为40%、培养时间24 h。在5种供试基础培养基上,接种上述培养液3%,按照上述基本培养条件发酵。再取液体发酵液,统计菌落数,检测发酵液抗菌活性,以筛选出最适基础培养基。
1.2.2.2 发酵培养基组成优化 采用1.2.2.1发酵培养条件,改变发酵培养基组成,24 h后按照1.2.1测定发酵液菌落数和抑菌圈大小,筛选出最佳发酵培养基组成,每个处理重复3次,具体培养基组成设定如下。
碳源组分和质量浓度:分别用蔗糖(Su)、乳糖(La)、葡萄糖(Gl)、麦芽糖(Ma)、甘露醇(Mn)、可溶性淀粉(Ss)替换1.2.2.1优选基础培养基LB中的胰蛋白胨(Tr),其他组分不变,筛选出最佳碳源组分。在最佳碳源组分基础上,设置最佳碳源的质量浓度分别为5、10、15、20 g/L处理,其他组分不变,筛选出最佳碳源质量浓度。氮源组分和浓度:LB为基础培养基,分别用尿素(Ur)、牛肉膏(BE)、硫酸铵(AS)、硝酸铵(AN)、麸皮(Br)替换LB基础培养基中的酵母提取物(YE),基础培养基中的其他组分不变,筛选出最佳氮源。在最佳氮源基础上,改变培养基中最佳氮源的质量浓度(5、10、15、20 g/L),基础培养基中的其他组分不变,筛选出最佳氮源质量浓度。无机盐组分和质量浓度:LB为基础培养基,分别用氯化钾(PC)、磷酸氢二钾(DH)、磷酸氢二钠(DP)、硫酸镁(MS)、硫酸锰(MG)、氯化钙(CC)替换LB基础培养基中的氯化钠(SC),基础培养基中的其他组分不变,筛选出最佳无机盐。在最佳无机盐基础上,改变培养基中最佳无机盐的质量浓度(5、10、15、20 g/L),基础培养基中的其他组分不变,筛选出最佳无机盐质量浓度。
1.2.2.3 发酵培养条件优化 在1.2.2.2优化的LB培养基上,改变发酵条件,24 h后按照1.2.1测定发酵液菌落数和抑菌圈大小,筛选出最佳发酵条件,每个处理重复3次,具体发酵条件设置如下。
pH值:设初始pH值为5、6、7、8、9,复筛pH值为7.1、7.2、7.3、7.4、7.5;培养温度为25、30、35 ℃;转速为150、180、210 r/min;250 mL体积装液量为50、100、150、200 mL;接种量为1%、3%、5%、7%。
1.2.3 响应面试验
1.2.3.1 Plackett-Burman试验 为确定影响C44菌株菌落数较显著的发酵参数,基于单因素试验结果,使用Design-Expert.V 8.0.6.1对胰蛋白胨添加量、酵母提取物添加量、磷酸氢二钠添加量、初始pH值、温度、转速、装液量、接种量等8个发酵参数设计Plackett-Burman试验(N=12的8因素2水平)。以菌落数为响应值,每个处理重复3次,取平均值为响应值。各因素对应因子编码如表1所示。

表1 Plackett-Burman试验设计的因素水平和编码Tab.1 Factors,levels,and codes of Plackett-Burman experimental design
1.2.3.2 最陡爬坡试验 基于Plackett-Burman试验结果,通过方差分析,发现对菌落数有显著影响的3个因子,综合考虑每个因子效应的正负以及试验成本,设计最陡爬坡试验中每个因子的步长以及爬坡方向。
1.2.3.3 Box-Behnken试验 基于Plackett-Burman试验和最陡爬坡试验结果,利用软件Design-Expert.V8.0.6.1对N=17的3因素3水平Box-Behnken试验进行设计,自变量为磷酸氢二钠(A)、温度(B)及转速(C)的3组平行试验并进行数据分析,结果如表2所示。

表2 Box-Behnken试验设计的因素水平和编码Tab.2 Factors, levels,and codes of Box-Behnken experimental design
2 结果与分析
2.1 培养基的筛选
由图1可知,在LB培养基中,贝莱斯芽孢杆菌C44菌落数、抑菌圈直径均明显大于其他培养基(P<0.05),分别为1.27×1010cfu/mL和13 mm,比NB处理中的菌落数和拮抗活性分别高出533.3%和550.0%,表明LB培养基对贝莱斯芽孢杆菌生长较为有利,抑菌物质较多。故在后续优化试验中,以LB培养基作为本菌株的基础培养基。

图1 基础培养基对C44菌株菌落数和抑菌圈的影响Fig.1 Effect of basal medium on colony number and inhibition zone of C44 strain.
2.2 培养基组成优化
不同碳源对菌株C44菌落数和活性的影响如图2-A所示,在供试的7种碳源中,Tr处理的菌落数和抑菌圈直径最高,分别为1.27×1010cfu/mL和13.3 mm,菌落数比其他处理分别高出111.1%、40.7%、81.0%、442.9%、26.7%、18.8%,Ma的菌落数和抗菌活性最低。

图2 不同营养成分对C44菌株菌落数和抑菌圈的影响Fig.2 Effects of different nutrients on colony number and inhibition zone of C44 strain
由图2-B可知,Tr的质量浓度为5~10 g/L时,菌落数和抗菌活性逐渐升高;Tr的质量浓度为10~15 g/L时,菌株C44的菌落数和抗菌活性逐渐降低;Tr的质量浓度为15~20 g/L时,菌株C44的菌落数和抗菌活性变化不大,这可能是大量的Tr使贝莱斯芽孢杆菌C44菌体快速增长的同时也增加了代谢产物的积累,一些有害代谢产物会抑制菌体的生长繁殖。因此,确定Tr的最佳质量浓度为10 g/L。
不同氮源对菌株C44菌落数和活性的影响如图2-C所示,在供试的6种氮源中,YE处理的菌落数和抑菌圈直径最高,分别为1.68×1010cfu/mL和13.7 mm,其菌落数分别比其他处理高出215.6%、32.9%、288.5%、1 583.3%、1 583.3%,而Ur和BE则不利于菌株C44的生长繁殖,菌落数和抗菌活性均较低。从图2-D可以看出,YE的质量浓度为5~10 g/L时,菌落数和抗菌活性逐渐升高;YE的质量浓度为10~15 g/L时,菌落数和抗菌活性逐渐降低,YE的质量浓度为15~20 g/L时,菌落数和抗菌活性变化不大,说明高质量浓度的YE不利于菌株C44的繁殖生长。故YE的最佳质量浓度为10 g/L。
无机盐不仅是组成菌体细胞最主要的营养成分之一,同时,它还是酶的组成部分、酶激活剂或者抑制剂,对培养基渗透压、pH、氧化还原电位等有调节作用。不同无机盐对菌株C44菌落数和活性的影响如图2-E所示,在供试的7种无机盐中,DP和MS处理的菌落数和抑菌圈直径均较高,其中DP的菌落数和抑菌圈直径最高,分别为2.27×1010cfu/mL和14.6 mm,而CC处理的菌落数和抗菌活性最低。
从图2-F可以看出,DP的质量浓度为5~10 g/L时,菌落数和抗菌活性逐渐升高;DP的质量浓度为10~25 g/L时,菌落数和抗菌活性逐渐下降,说明高质量浓度的DP会抑制C44菌体的繁殖。故确定DP的最佳质量浓度为10 g/L。
2.3 发酵条件的优化
由图3-A可知,初筛过程中,随培养基pH值升高,菌株C44菌落数增大,活性提高,在pH值为7~8时,对菌株生长最为有利,其中,pH值在7时,菌落数和抑菌圈直径都达到最大值,分别为2.43×1010cfu/mL和14.7 mm,之后则显著下降(P<0.05)。为确定最佳pH值,依次对pH值为7.1、7.2、7.3、7.4、7.5进行复筛,从图3-B可以看出,pH值为7.1~7.3时,菌株C44菌落数增大,活性提高,在pH值为7.3时,菌落数和抑菌圈直径最高;从抑菌圈直径来看,pH值为7.1~7.4时均较高,pH值为7.4之后逐渐下降。结合菌株C44菌落数与抑菌活性,将7.2~7.3确定为贝莱斯芽孢杆菌最适宜pH值。

图3 不同发酵条件对C44菌株菌落数和抑菌圈的影响Fig.3 Effects of different fermentation conditions on colony number and inhibition zone of C44 strain
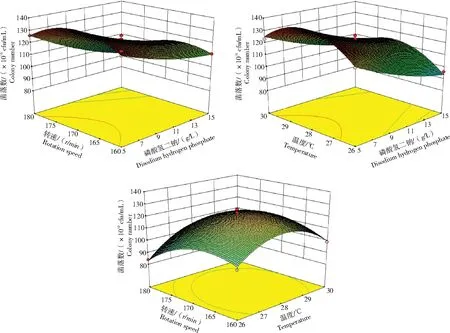
图4 磷酸氢二钠、温度和转速三者交互作用对贝拉斯芽孢杆菌C44生长影响的响应面Fig.4 Response surface of interactions among disodium hydrogen phosphate,temperature,and rotation speed on the growth of Bacillus velezensis C44
温度对确保酶活性至关重要,同时也影响着细胞膜流动性及发酵液内物质溶解度,温度偏低和偏高都会抑制菌株C44的繁殖生长。如图3-C所示,30 ℃下菌落数和拮抗活性最高,菌落数和抑菌圈直径分别为2.97×1010cfu/mL和16.0 mm,比25、35 ℃处理分别高出81.6%、53.5%和20.9%、12.9%。故确定30 ℃为最佳温度。
由图3-D可知,当转速为150~180 r/min时,随着转速的升高,C44菌落数明显增加,抑菌活性逐渐增强,180 r/min转速时菌落数和抑菌活性最高,分别为3.39×1010cfu/mL和17.5 mm;此后菌落数及抑菌活性随转速升高而下降,表明当转速超过180 r/min后,其对贝莱斯芽孢杆菌生长繁殖会造成一定程度的障碍。故选择最佳转速为180 r/min。
从图3-E可以看出,装液量在50~100 mL时,C44菌株随着装液量增加菌落数和抑菌活性逐渐升高,并在100 mL时的菌落数和抑菌圈直径达最大,分别为3.63×1010cfu/mL和17.9 mm;装液量为100~200 mL时,菌株菌落数和抑菌活性随着装液量增加逐渐降低,因为装液量越大,营养物质越多,菌株生长会越好,就会导致耗氧量增加,这必然会影响菌株的生长代谢。故选100 mL为最佳装液量。
接种量太低,会延长发酵周期,菌株繁殖生长峰值推迟,接种量过大会使培养基内有限营养物质消耗加快,缩短周期。由图3-F可知,接种量为1%~5%时,菌株的菌落数和抑菌活性逐渐升高,当接种量为5%时,C44菌落数和抑菌圈直径为最大,分别为3.87×1010cfu/mL和18.3 mm;接种量为5%~7%时,菌株的菌落数和抑菌活性逐渐降低。故选5%为最佳接种量。
2.4 基于响应面法对发酵条件优化
2.4.1 Plackett-Burman试验结果 根据单因素试验结果,确定研究因素和水平后,按照表1对发酵条件中8种因素进行考察,对试验设计得出的结果进行方差分析,以筛选出对菌落数影响显著的因素作进一步优化。
由表3可知,Plackett-Burman试验模型R2=0.983 5,P值为0.013 5、低于0.05,说明此模型有统计学意义。由各因子P值可知,DP、温度、转速和胰蛋白胨对菌落数的值影响极显著(P<0.01),其余4种因素对菌落数的值影响不显著(P>0.05),从极显著因素中选出3个P值最小的因素进行后续试验。根据表3的各因素预估系数(系数为正表示正效应,需对试验设计的试剂用量梯度增加;系数为负表示负效应,需对试验设计的试剂用量梯度减少)可知,DP、温度、转速对菌落数的值均表现为正效应。因此,根据P值和因素的正效应进行下一步的最陡爬坡试验。

表3 Plackett-Burman 试验方差分析Tab.3 Variance analysis of Plackett-Burman test
2.4.2 最陡爬坡试验结果 依据表3的Plackett-Burman试验方差分析因子的正负效应,并结合实际情况,确定了爬坡试验中因子的爬坡方向及步长,其具体设计与结果如表4所示。由表4可知,第2组试验菌落数最高,为7.933×1010cfu/mL,故以此为试验的水平中心进行后续响应面试验与分析。

表4 最陡爬坡试验设计及结果Tab.4 The steepest ascent experiment design
2.4.3 响应面试验 根据Plackett-Burman试验和最陡爬坡试验结果,以菌落数为响应值,以DP 10 g/L、温度28 ℃、转速170 r/min为中心点,对Box-Behnken试验设计的结果建立回归模型并进行方差分析,结果如表5所示。

表5 响应面试验方差分析Tab.5 Variance Analysis of response surface test
方差分析结果显示,所选择的回归模型P<0.000 1,R2=0.983 4,说明此模型对于试验结果的影响极为显著,具有较好的可信度;且失拟项P=0.158 1>0.05,不显著,回归模型拟合度较高,能充分解释试验因子和响应变量的函数关系。菌落数值(Y)对DP(A)、温度(B)、转速(C)的多元二次回归方程为:Y=123.00-12.75A+3.00B-5.25C+0.75AB-3.75AC+3.75BC+3.37A2-16.13B2-11.62C2。
由4图可知,当磷酸氢二钠一定时,菌落数随转速的升高而逐渐升高,达到某一转速后菌落数开始呈现下降趋势;在一定转速下菌落数随磷酸氢二钠含量升高而降低。当磷酸氢二钠用量一定时,菌落数随温度升高而逐渐升高,达到某一温度后,菌落数开始慢慢下降;在一定的温度范围,高温较低温更有利于菌落的生长;当温度一定时,随着磷酸氢二钠的增加,菌落数呈逐渐下降趋势。当温度一定时,菌落数随转速升高表现为先升高后降低;当转速一定时,菌落数随温度升高有个上升过程,温度约28 °C菌落数达到最大值,然后开始下降。
通过构建的响应面模型,实现了参数最优化分析,结果表明,贝莱斯芽孢杆菌菌落数最多时,其最佳培养条件为:磷酸氢二钠5.6 g/L、温度28.7 °C、转速172 r/min。
为验证响应面试验所得结果的可靠性,对通过响应面试验得出的最佳发酵条件进行3次平行试验,测得C44菌落数为1.28×1011cfu/mL,与预测值1.35×1011cfu/mL相当接近。因此,得到的模型能够较好预测实际C44菌株的菌落数,响应面法适用于贝莱斯芽孢杆菌菌落数研究。
3 结论与讨论
本研究以单因素为基础,采用响应面法筛选得到了贝莱斯芽孢杆菌C44的最佳发酵培养基及发酵条件,结果表明,生防菌生产发酵效率及抗菌物质生产与培养基组分和发酵条件都密切相关[21]。李姝江等[18]和武天上等[22]先后对贝莱斯芽孢杆菌ZJ20菌株、CC0955菌株等进行优化研究,但得到的培养基成分和发酵条件都不一致,说明不同贝莱斯芽孢杆菌在不同环境中受温度、培养条件等外界因素的影响下对营养成分的需求存在差异。
本研究以LB为基础培养基,选定Plackett-Burman试验得到的3个主要影响因子磷酸氢二钠、温度、转速为自变量,以菌落数作为响应值进行了分析,所得因素对菌落数影响程度大小依次是磷酸氢二钠>转速>温度。其中磷酸氢二钠与转速以及温度与转速之间交互作用大于磷酸氢二钠与温度交互作用。研究认为,贝莱斯芽孢杆菌菌落数最多时,其最佳培养条件:磷酸氢二钠为5.6 g/L、温度为28.7 °C、转速为172 r/min,并对所得贝莱斯芽孢杆菌C44菌株的优化发酵条件加以验证,试验得到的C44菌落数为1.28×1011cfu/mL,与预测值具有较好的一致性,表明该模型是有效的。这与曹可可等[23]、李冰等[24]的研究结果相似,均反映出响应面法可提高试验效率,优化菌量,降低成本等。本研究结果为贝莱斯芽孢杆菌的后期深入研究及开发应用鉴定了基础。
