酿酒酵母烟酰胺核苷激酶的异源表达及其酶学性质分析
2023-09-13何建菊刘欣欣史红玲冉璐妮张英君唐存多
何建菊,刘欣欣,史红玲,冉璐妮,王 贤,张英君,唐存多,,3,
(1.南阳师范学院生命科学与农业工程学院,河南 南阳 473061;2.赊店老酒股份有限公司博士后创新实践基地,河南 南阳 473300;3.河南农业大学食品科学技术学院,河南 郑州 450002)
烟酰胺单核苷酸(nicotinamide mononucleotide,NMN)是一种天然存在的活性核苷酸,有α、β两种异构体,其中β-NMN是辅酶烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD+)的活性形式[1]。NMN是细胞氧化还原NAD+的关键中间体[2]。NAD+在人体中发挥着至关重要的生物作用,主要包括参与生物氧化还原反应、维持细胞氧化还原稳态及参与信号传导过程[3]。有研究表明人体中NAD+含量会随着年龄的增长而慢慢减少[4-6],NMN在体内需要转化成NAD+才有生理功能[5]。临床研究发现,通过调节生物体内NMN水平,对心脏和脑缺血、阿尔茨海默病、饮食和年龄引起的2型糖尿病和肥胖等有较好的治疗和修复作用[6-8]。近几年,NMN被誉为“不老神药”[9],有实验表明,在小鼠模型中口服NMN会导致NAD+的回升,能抗衰老、延长寿命[10-11]。此外,通过烟酰胺核苷激酶(nicotinamide riboside kinase,NRK)途径增加NAD+含量能恢复抗病毒聚ADP核糖聚合酶功能,对SARS-CoV-2产生先天免疫[12]。
NAD+主要有3 种代谢合成路径:Preiss-Handler途径、从头合成途径和补救合成途径[13]。补救合成途径是以烟酰胺核糖(nicotinamide ribose,NR)为底物,在NRK的作用下磷酸化生成NMN。NMN合成最早使用的是化学合成法,由于使用的各种化学试剂对环境造成污染、产物分离困难,且存在手性异构体等问题,制约了NMN的大规模生产[2]。随着生物催化、酶工程技术的发展,NMN的生物合成成为热点。生物合成包括天然发酵法和酶促合成法,天然发酵法因为底物和产物都很容易被菌体自身消耗,产物很难大量积累,生产效率低下,不适于工业化生产[2]。酶促合成法是一种较为绿色环保的制备方法[14],因为其没有有机溶剂的残留,也不存在手性问题等优点。
目前,生产NMN的生物催化法有两种,第1种是烟酰胺底物路线,第2种是NR底物路线[11]。烟酰胺底物路线是指以烟酰胺、ATP和核糖为底物,通过烟酰胺磷酸核糖转移酶、核糖磷酸焦磷酸激酶以及核糖激酶制得NMN的方法[15-16]。第2种方法是以NR和ATP为底物,只需NRK的催化即可生成NMN,这是一个单酶反应体系。反应速率快,底物转化率高,是目前比较热门的合成路线[17-19]。虽然NR价格昂贵,但是考虑到NMN的重要性,以及NMN在医疗和生物技术行业的广泛应用,在可接受的成本范围内高效制造NMN仍然具有重要的意义[20]。同时,开发高活性的NRK,降低酶的使用成本也是降低NMN生物合成成本的有效途径。
本研究从酿酒酵母(Saccharomyces cerevisiae)中克隆出NRK基因片段,再借助pET28a质粒在大肠杆菌(Escherichia coli)BL21(DE3)中实现高水平的可溶性表达,并对其酶学特性进行分析。本研究有望为NRK进一步分子改造、表达宿主的优选及应用奠定坚实的基础。
1 材料与方法
1.1 材料与试剂
1.1.1 试剂
NR、β-烟酰胺核苷酸标准品 麦克林化学试剂有限公司;甲醇(色谱纯)天津科密欧化学试剂有限公司;三磷酸腺苷溶液、磷酸二氢钠、氯化镁、异丙基-β-D-硫代半乳糖苷(isopropyl-β-D-thiogalactoside,IPTG)生工生物工程(上海)股份有限公司;rTaqDNA聚合酶、PrimeSTAR®HS DNA聚合酶、PrimeScript™ II 1st Strand cDNA Synthesis Kit、DL 2000 DNA Marker、DNA连接试剂盒Ver.2.1 宝生物工程(大连)有限公司。
1.1.2 菌株、质粒与培养基
携带原核表达质粒的BL21(DE3)/pET28a、酿酒酵母菌株由本课题组保藏[21]。LB(Luria-Bertani)培养基用于大肠杆菌的培养,酵母浸出粉胨葡萄糖培养基用于酿酒酵母的培养。
1.2 仪器与设备
核酸电泳仪 北京市六一仪器厂;蛋白电泳仪美国Bio-Rad公司;EC 2006型高效液相色谱(high performance liquid chromatography,HPLC)系统 大连依利特分析仪器有限公司;Hypersil C18柱 美国Thermo Scientific公司。
1.3 方法
1.3.1 重组大肠杆菌的构建
以Saccharomyces cerevisiae和Nicotinamide nucleoside kinase为关键词搜索,在NCBI(http://www.ncbi.nlm.nih.gov/)中找到酿酒酵母NRK1(ScNRK1),对应的基因组序列(GenBank:AY611479.1)。为了去除模板核苷酸序列中的内含子,选择进行合成NRKcDNA的第1链,根据已报道的NRK1序列设计特异性引物NRK1-F:GGAATTCCATATGATGACTTCG AAAAAAGTGATA(含NdeI酶切位点)和NRK1-R:CCGCTCGAGCTAATCCTTACAAAGCTTTAG(含XhoI酶切位点),并委托苏州弘讯生物技术有限公司进行合成。
以酿酒酵母的总RNA为模板,用PrimeScript™ II 1st Strand cDNA Synthesis Kit进行cDNA第1链的合成,再利用NRK1-F和NRK1-R引物PCR扩增NRK的编码基因,利用限制性内切酶NdeI和XhoI对目的基因及pET28a质粒分别进行双酶切,然后连接转化进入大肠杆菌BL21(DE3)感受态细胞,经抗性筛选和测序鉴定获得BL21(DE3)/pET28a-ScNRK1重组菌。将上述重组菌连续在无抗LB培养基上传代10 次,然后接种至含卡那霉素的LB培养基上培养,观察它的生长情况,通过卡那霉素抗性筛选考察重组菌携带质粒的遗传稳定性[22]。
1.3.2 重组大肠杆菌的诱导表达及纯化
将BL21(DE3)/pET28a-ScNRK1重组大肠杆菌单菌落接种至5 mL含100 μg/mL卡那霉素的LB液体培养基中,37 ℃、200 r/min条件下振荡培养14 h,以2%接种量转接至100 mL新鲜LB液体培养基中,培养至OD600nm约为1.0,加入1 mol/L IPTG溶液至终浓度为0.1 mmol/L,16 ℃、200 r/min诱导培养20 h;将100 mL菌液于8000 r/min、4 ℃离心5 min,收集菌体,用20 mmol/L Tris-HCl菌体重悬后进行超声破碎,破碎后收集上清液,上清液通过平衡好的镍琼脂糖柱上进行纯化,进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDS-PAGE)分析[22-23]。
1.3.3 酶活力分析
NRK活力分析:以NR为底物,NMN生成量为标准计算酶活力。根据已报道的酶活力测定方法[23-24]略作修改。酶活力测定的反应体系为1 m L,包含20 mmol/L pH 7.6 Tris-HCl缓冲液、10 mmol/L MgCl2、2 mmol/L ATP、10 mmol/L NR,加入稀释适当倍数的100 μL酶液,40 ℃反应20 min,沸水中煮5 min终止反应,0.22 μm滤膜过滤反应液,用HPLC测定酶活力。HPLC条件:色谱柱为Thermo Hypersil C18柱,检测波长260 nm,柱温30 ℃,流动相为磷酸二氢钠缓冲液-甲醇(95∶5,V/V),流速1 mL/min,进样体积10 μL。在测定条件下每分钟生成1 μmol NMN所需的酶量定义为1 个酶活力单位(IU)。
1.3.4 NMN的定量分析
将NMN准品用超纯水分别配成0.2、0.4、0.6、0.8、1.0 mmol/L的溶液,然后分别取10 μL进行HPLC分析,获得各浓度NMN的峰面积后,进行线性拟合获得回归方程及相关系数,色谱条件和上述测酶活力方法相同,后面待检样品产物按照同样条件进行HPLC分析,根据测得的峰面积可以由回归方程计算出相应的样品浓度。
1.3.5 重组酶的温度特性
参照1.3.3节方法,分别在25~55 ℃(以5 ℃为间隔)下测定该重组酶的催化活性以获得该重组酶的最适反应温度。将重组酶分别在25~55 ℃(以5 ℃为间隔)下保温1 h,然后在最适反应温度下测定各自的残留酶活力,以冰浴保存1 h后酶活力为100%,以此考察各重组酶的温度稳定性[25]。
1.3.6 重组酶的pH值特性
参照1.3.3节方法,在最适反应温度下,分别在pH 3.4~7.0(以0.6为间隔)下测定重组酶的催化活性以获得重组酶的最适反应pH值。将重组酶分别在pH 3.4~7.0(以0.6为间隔)缓冲液中冰浴1 h,然后在各自最适反应温度和最适反应pH值下测定各自的残留酶活力,以未经处理值为100%,以此考察各重组酶的pH值稳定性[25]。
1.3.7 重组酶的最适Mg2+浓度
已有文献报道,NRK催化活性受Mg2+浓度的影响[26]。为考察Mg2+浓度对重组酶酶活力的影响,参照1.3.3节方法,在最适反应温度下,分别在MgCl2终浓度为0.1~0.4 mol/L(以0.05 mol/L为间隔)下测定重组酶的催化活性,以获得最适Mg2+浓度,以最适Mg2+浓度下酶活力为100%,以此检测重组酶的最适Mg2+浓度。
1.3.8 重组酶的动力学参数
重组NRK动力学参数的测定根据已报道方法稍加修改,以确定NR底物的特异性[27],反应系统中ATP浓度为1 mmol/L。在最佳反应条件下,在0.1~0.35 mmol/L不同NR浓度下测定重组酶的催化活性。每次测定重复3 次。同样地,固定NR浓度为1 mmol/L,将ATP浓度设置为0.04~0.2 mmol/L,以测定重组酶的催化活性,每次测定执行3 次,依次考察对ATP的动力学参数。使用Michaelis-Menten方程计算未表现出底物抑制酶的表观动力学数据,或者当观察到底物抑制时使用以下方程:V=Vmax/(1+Km/S+S/Ki)[28],所有计算均使用Origin 9.0软件。
1.3.9 NMN的生物合成
NMN反应进程:配制1 mL体系,包含50 mmol/L pH 5.8 Tris-HCl缓冲液、17.5 mmol/L MgCl2、3 mmol/L ATP、6 mmol/L NR,加入稀释适当倍数的100 μL酶液,在反应10、20、30、40、50、60 min时取样,终止反应,用0.22 μm滤膜过滤,进行HPLC分析,获得各反应时间下的NMN峰面积,计算NMN随反应时间变化的得率。
1.3.10 常用网站及软件
NCBI(http://www.ncbi.nlm.nih.gov/)数据库和BLAST(https://blast.ncbi.nlm.nih.gov/Blast.cgi):蛋白质、基因序列及蛋白质3-D结构的搜索;DNAMAN:用于基因序列及限制性酶切位点分析和测序结果分析;ProtParam(https://web.expasy.org/cgi-bin/protparam/protparam)网站:预测蛋白质的理论理化性质;TMHMM-2.0(https://services.healthtech.dtu.dk/service.phpTMHMM-2.0):用于预测蛋白质的跨膜结构。
1.4 数据统计及图表绘制
图片均用Adobe Photoshop CS 8.0软件进行色阶、对比度调节及标注等处理。简单的数据处理及分析均借助Origin 9进行。
2 结果与分析
2.1 重组大肠杆菌的构建
目的基因PCR扩增产物的电泳图如图1A所示,在约750 bp处出现了明显的特异性条带,PCR产物的片段长度与预期的理论长度基本一致。潜在重组质粒双酶切的电泳检测如图1B所示,鉴定后送生工生物工程(上海)股份有限公司进行测序鉴定,获得ScNRK1的基因序列,并推测出其氨基酸序列。
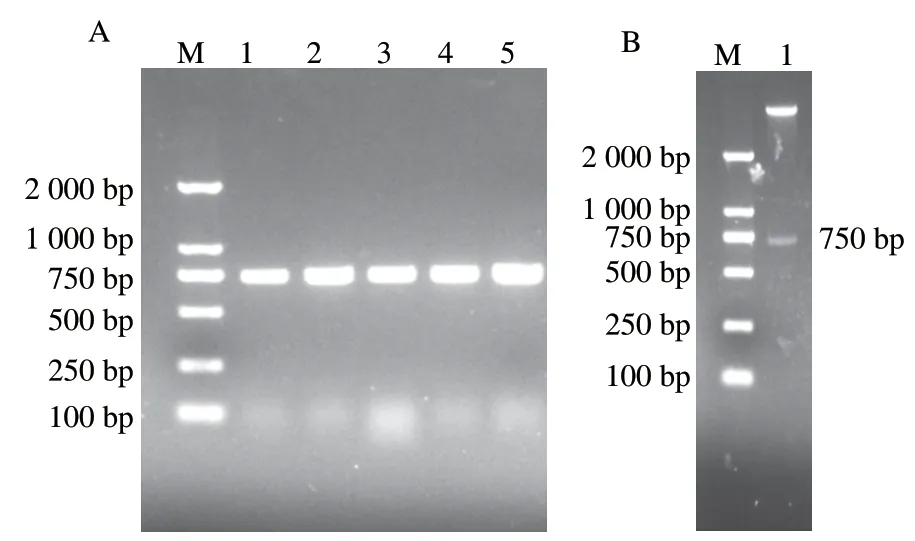
图1 ScNRK1基因的PCR扩增(A)及pET28a-ScNRK1的双酶切验证(B)Fig.1 PCR amplification of ScNRK1 (A) and double-enzyme digestion of pET28a-ScNRK1 (B)
2.2 ScNRK1的序列分析
将上述推测出的ScNRK1氨基酸序列在ProtParam上进行理论理化性质的预测,结果表明ScNRK1的理论等电点为6.23,理论分子质量为27689.58 Da,不稳定指数II为25.59,是一个较稳定的蛋白,其在大肠杆菌和酵母体内的半衰期分别能达到10 h和20 h以上。利用TMHMM-2.0服务器预测蛋白跨膜结构的结果显示,ScNRK1的240 个氨基酸残基均为膜外残基,表明ScNRK1理论上较容易实现胞外分泌型表达。
2.3 重组大肠杆菌的诱导表达及鉴定
图2结果显示,BL21(DE3)/pET28a-ScNRK1上清液在约27 kDa处有明显的特异性条带,与ScNRK1的理论分子质量27689.58 Da基本一致,表明已成功实现了ScNRK1在大肠杆菌中的可溶性表达。经亲和纯化后产物在约27 kDa处出现了单一特异性条带,表明经过亲和层析,获得了电泳纯的重组ScNRK1,可以用于后续酶学特性的分析。酶活力测定结果表明,BL21(DE3)/pET28a-ScNRK1发酵液中NRK活力达14.75 U/mL,纯化后重组ScNRK1的比活力为2252.59 U/mg(表1),其表达水平和比活均显著高于已报道的水平[7],具有较好的应用前景。
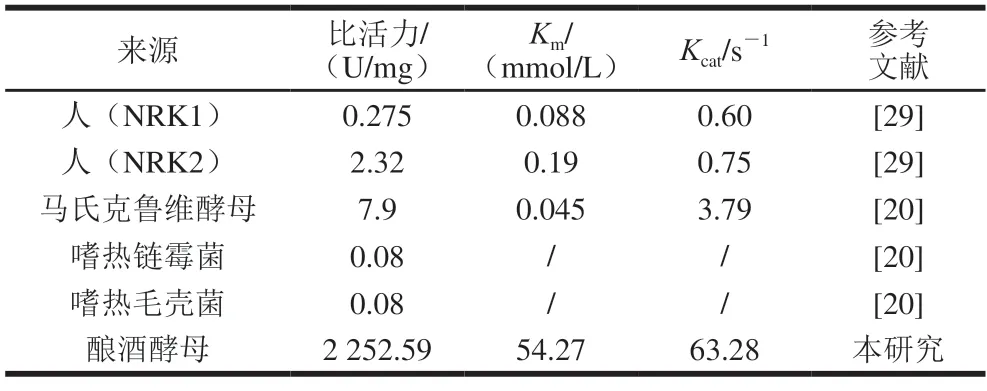
表1 不同来源NRK的比活力及动力学参数的比较Table 1 Comparison of specific activity and kinetic parameters of nicotinamide nucleoside kinases from different sources
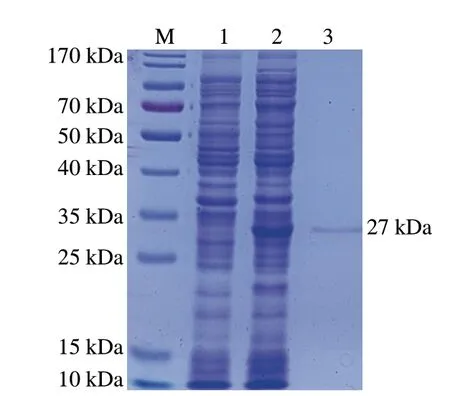
图2 重组大肠菌表达产物的SDS-PAGE分析Fig.2 SDS-PAGE analysis of expression products in recombinant E.coli
2.4 NMN标准品的HPLC分析
将分析纯的NMN在ThermoHypersil C18柱上进行HPLC分析,在该分析条件下,NMN的保留时间约为2.79 min(图3A),底物标准品也进行HPLC分析,保留时间为4.02 min(图3B)。将NMN浓度(x/(mmol/L))对相应峰面积(y)进行线拟合,获得NMN标准曲线,回归方程为y=173.87x+101.32,R2=0.9935,结果表明在该HPLC分析条件及浓度范围下,NMN浓度与峰面积呈良好线性相关,因此,利用此法可以对NMN进行精确定量。
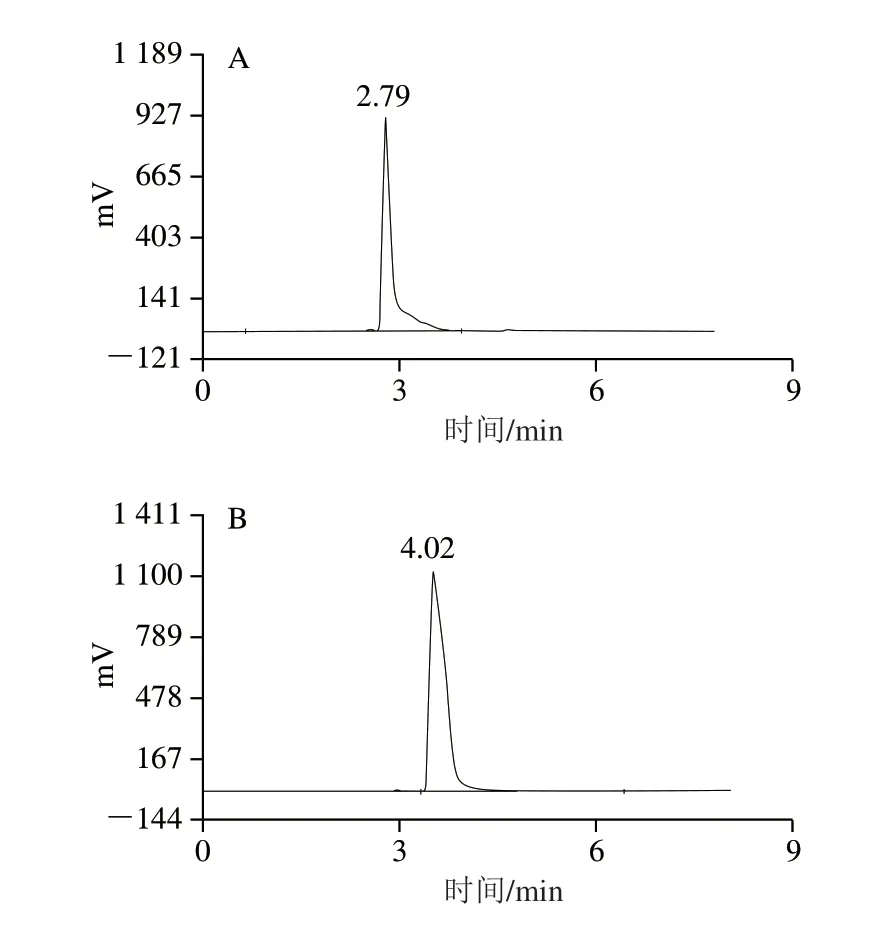
图3 NMN(A)、NR(B)标准品分析Fig.3 HPLC chromatograms of NMN (A) and NR (B) standards
2.5 温度对重组ScNRK1活力的影响
从图4可以看出,在20~30 ℃温度范围内,酶促反应速率随温度的升高而增大。当温度超过30 ℃时,反应速率降低,重组ScNRK1的最佳反应温度为30 ℃,这和之前文献报道的最适温度相同[30]。由图5可知,当孵育的温度超过40 ℃时,其残余酶活力显著下降,仅为50%左右,这在一定程度上也会限制它在NMN生物合成中的应用,在以后研究中可通过蛋白质工程和固定化技术对ScNRK1的热稳定性进行改造,以满足工业化生产的需求[20]。
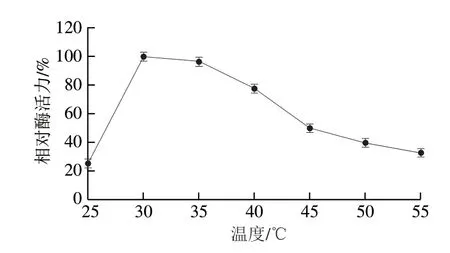
图4 重组ScNRK1的最适反应温度Fig.4 Optimal temperature of recombinant ScNRK1
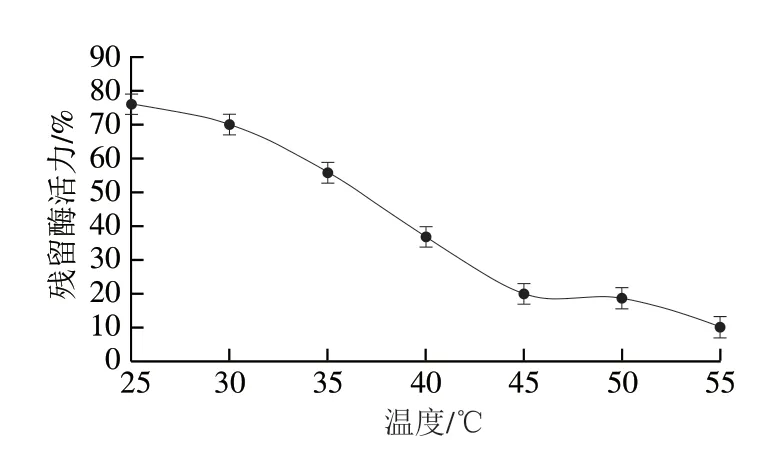
图5 重组ScNRK1的温度稳定性Fig.5 Temperature stability of recombinant ScNRK1
2.6 pH值对重组ScNRK1活力的影响
缓冲液pH值过高或过低可能会导致酶的空间结构发生变化,从而降低其催化活性[31]。从图6可以看出,重组ScNRK1是一种嗜酸性酶,其最适反应pH值为5.8。当pH值稍微偏离其最佳pH值时,其催化活性显著降低。因此,在使用过程中必须严格控制反应系统的pH值。从图7可以看出,重组ScNRK1对pH值的耐受性较好,在测定条件下,它的残余酶活力均大于90%。
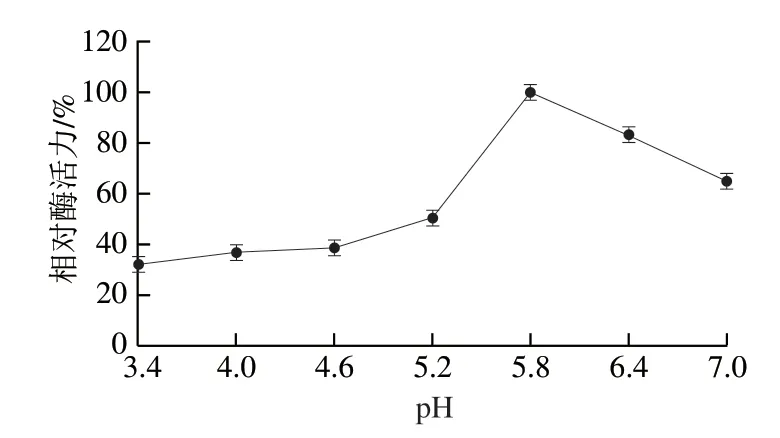
图6 重组ScNRK1的最适pH值Fig.6 Optimal pH of recombinant ScNRK1
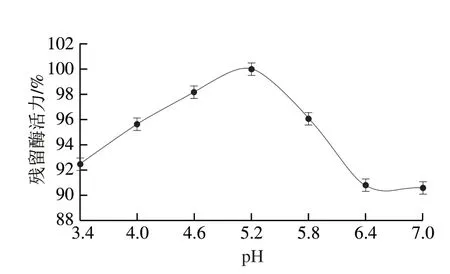
图7 重组ScNRK1的pH值稳定性Fig.7 pH stability of recombinant ScNRK1
2.7 重组ScNRK1的最适Mg2+浓度
从图8可以看出,重组ScNRK1的最佳Mg2+浓度为350 mmol/L,过低的Mg2+浓度不能充分发挥酶的催化活性,过高的Mg2+浓度对酶的催化活性也有一定的抑制作用。
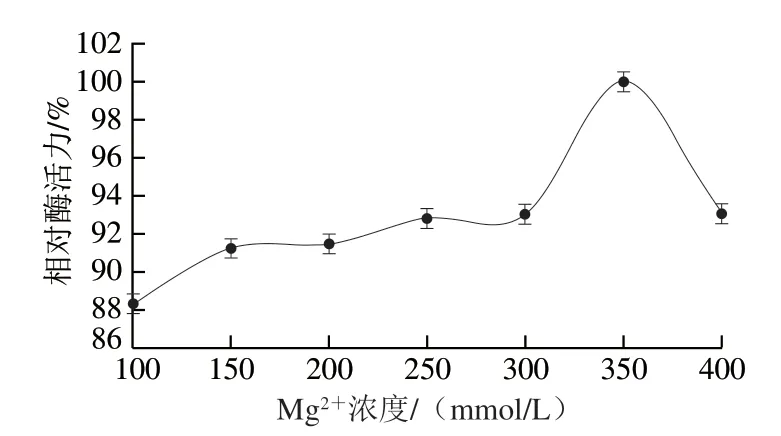
图8 Mg2+浓度对重组ScNRK1酶活力的影响Fig.8 Effect of Mg2+ concentration on the activity of recombinant ScNRK1
2.8 重组ScNRK1的动力学参数
重组ScNRK1对NR有很高的催化效率,其Kcat和Kcat/Km值分别为63.28 s-1和1.17 L/(mmol·s)。同样,其对ATP也表现出较高的催化效率,其Kcat和Kcat/Km值分别为92.96 s-1和1.71 L/(mmol·s),表明重组ScNRK1在NMN的酶法合成中具有重要潜力,对降低合成过程中酶的使用成本具有重要的意义。
2.9 NMN的生物合成
如图9所示,已有部分NR(4.01 min)转化成烟酰胺核苷酸(2.79 min)。6 mmol/L的NR用上述方法得到反应进程曲线,如图10所示,表明离理论得率仍有一定的差距[19],在后续研究中仍需对反应条件进行系统的优化。但这种一步酶法反应节约了一定的反应时间[9,17]。
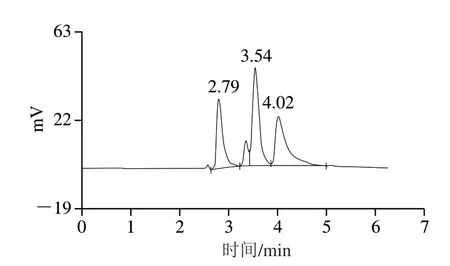
图9 NMN反应液相色谱图Fig.9 Liquid chromatogram of NMN reaction products
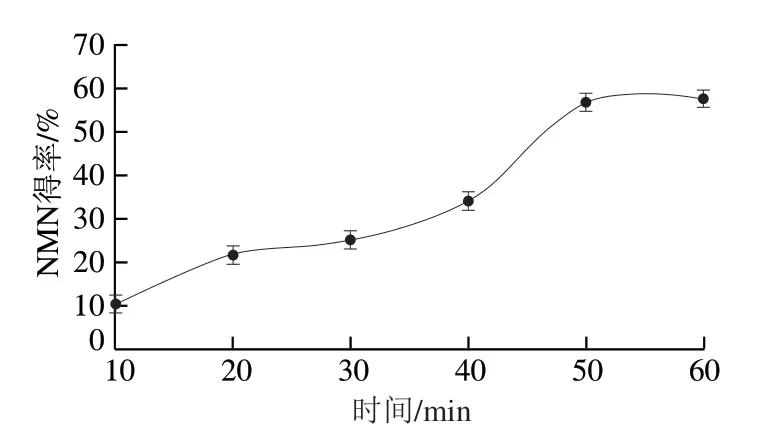
图10 NMN的反应进程Fig.10 Evolution of NMN yield during the reaction process
3 讨论
NMN是公认NAD+生物合成中间体的一种核苷酸[11],是食品、化妆品、保健品的研究热点[9]。采用基因组挖矿技术,可以快速地将假定酶变为真实酶,为生物催化提供更多的选择[32]。
本研究从酿酒酵母中克隆出NRK基因片段,再借助pET28a质粒在大肠杆菌BL21中实现高水平的可溶性表达,酶活力测定结果表明,BL21(DE3)/pET28a-ScNRK1发酵液中NRK活力达14.75 U/mL,纯化后重组ScNRK1比活力为2252.59 U/mg,其表达水平和比活力均显著高于已报道的水平[7]。表明从酿酒酵母中挖掘的NRK有一定优势。温度特性结果表明,酿酒酵母来源NRK的最适温度为30 ℃,且稳定性差,这与之前的报道相同[30],这都限制了NMN的工业化生产。接下来将对NRK进一步分子改造、表达宿主的优选。最后对底物NR进行催化生成NMN进行研究,虽然离理论得率仍有一定的差距[19],但反应节约了反应时间,为更快生产NMN奠定了基础。
