基于UPLC法的甘参复方指纹图谱研究
2023-09-13李美谦郭丽娜王艳萍李文静
洪 博, 李美谦, 刘 军, 郭丽娜, 王艳萍,李文静*
1.黑龙江中医药大学药学院,哈尔滨 150000;2. 齐齐哈尔医学院药学院,齐齐哈尔 161006
肝纤维化是由多种原因引起的慢性肝损伤所致的病理改变,在中医学中属“臌胀”“胁痛”“积聚”“黄疸”等病证范畴,是慢性肝病发展到肝硬化的必经阶段,也是导致肝癌的重要原因[1-2]。肝纤维化无法自行痊愈,肝纤维化患者预后的差别很大,主要取决于发病初期是否得到有效控制。若经过规范治疗,如脂肪肝逆转、病毒被根除和停用肝毒性药物等,病因被去除,肝纤维化病情可长期保持稳定,甚至逆转[3-4]。若患者慢性肝损伤持续存在,病情逐渐进展,数年至数十年后可进展为肝硬化,最终导致死亡。目前对肝纤维化的诊治虽然取得了一些进展,但是抗肝纤维化的药物仍处于缺乏状态。因此,找到能逆转肝纤维化且毒性和不良反应小的药物是目前科研工作者的重要研究方向,中医药在逆转肝纤维化及抑制肝纤维化进展方面具有显著的优势[5-8]。甘参复方(GSC)[9-10]是由甘草和丹参配伍组成的方剂,以丹酚酸与甘草酸为主要药效指标[10],该方具有多成分、多靶点和多通路的特征,临床应用较为广泛,目前研究已证实GSC可用于治疗肝纤维化,且治疗效果明显,能很好地将中药复方传统药理学与现代药理学相结合[11]。近年来,对于GSC的质量控制研究主要集中于对各个药材活性成分的检测,较多集中在对其药理作用机制、提取工艺的研究和含量测定等方面[12],尚未见有关建立GSC指纹图谱的研究报道。由于中药复方的化学成分复杂,且复方质量与各味药材的产地、批次等因素有关,故需要建立能反映GSC化学成分整体性、系统性的质量控制方法。因此,本文用超高效液相色谱法(ultra performance liquid chromatography,UPLC),建立12批GSC的指纹图谱以评价其整体质量,为GSC的质量控制研究提供参考。
1 仪器与试药
1.1 仪器
SHIMADZU LC-30AD型超高效液相色谱仪(日本岛津公司);METTLER TOLEDO精密天平(0.01 mg,瑞士苏黎世的梅特勒-托利多集团);KH-500DE型数控超声波清洗器(昆山禾创超声仪器有限公司);TGL-18C-C型台式高速离心机(上海安亭科学仪器厂);SCT型数显搅拌电热套(菏泽市精科仪器有限公司)。
1.2 试药
对照品:丹参素(批号180328,质量分数≥98%)、芍药内酯苷(批号160516,质量分数≥98%)、芍药苷(批号160524,质量分数≥98%)、芹糖甘草苷(批号160916,质量分数≥98%)、甘草苷(批号161201,质量分数≥98%)、迷迭香酸(批号181018,质量分数≥98%)、丹酚酸B(批号181008,质量分数≥98%)、苯甲酰芍药苷(批号160517,质量分数≥98%)、甘草酸(批号160602,质量分数≥98%)、二氢丹参酮Ⅰ(批号181019,质量分数≥98%),均购自北京莱耀生物科技有限公司;隐丹参酮(批号110852-201807,质量分数≥98%)、丹参酮Ⅰ(批号110867-201607,质量分数≥98%)、丹参酮ⅡA(批号110766-201721,质量分数≥98%),均购自中国食品药品检定研究院。甲醇、乙腈(色谱纯,瑞典Oceanpak公司);磷酸(色谱纯,天津科密欧化学试剂有限公司);乙醇(分析纯,天津富宇精细化工有限公司);纯净水(杭州娃哈哈集团有限公司)。
药材均购自其道地产地或主产区(甘草产自新疆,丹参产自四川),经齐齐哈尔医学院药学院郭丽娜教授鉴定,丹参为唇形科植物丹参SalviamiltiorrhizaBge. 的干燥根和根茎,甘草为豆科植物甘草GlycyrrhizauralensisFisch的干燥根和根茎。12批GSC分别为S1(20210901)、S2(20210902)、S3(20210903)、S4(20210904)、S5(20210905)、S6(20210906)、S7(20210907)、S8(20210908)、S9(20210909)、S10(20210910)、S11(20210911)、S12(20210912)。
2 方法与结果
2.1 色谱条件
色谱柱为Waters T3-C18色谱柱(100 mm×2.1 mm, 1.7 μm)。流动相为乙腈(A)-0.5 mL·L- 1磷酸水(B)溶液,梯度洗脱:0~10 min,10%~20%A;10~20 min,20%~24%A;20~35 min,24%~48%A;35~45 min,48%~80%A;45~50 min,80%~90%A;50~60 min,90%~10%A。柱温为40 ℃;流速为0.3 mL·min-1;进样量为5 μL;检测波长为240 nm。
2.2 供试品溶液的制备
精密称取粉碎后的甘草和丹参各5.0 g,置于250 mL 烧瓶中,用10倍量的体积分数50%的乙醇提取2次,在60 ℃每次提取1.5 h,摇匀,滤过,合并2次滤液置于另一个250 mL 烧瓶中,减压浓缩,将浓缩液置于100 mL量瓶中,定容,过0.22 μm微孔滤膜,即得供试品溶液。
2.3 方法学考察
2.3.1精密度实验 取同一批次GSC供试品溶液(S1),按2.1项下色谱条件连续进样6次,记录色谱图,计算得各共有峰的相对保留时间RSD值均<0.7%,相对峰面积的RSD值均<0.5%,表明仪器的精密度良好。
2.3.2重复性实验 取GSC供试品溶液(S1)6份,按照2.2项下方法制备供试品溶液,按照2.1项下色谱条件进样测定,计算得各共有峰相对保留时间和相对峰面积的RSD值分别为0.06%~0.96%、0.39%~1.88%,表明该方法的重复性良好。
2.3.3稳定性实验 取GSC供试品溶液(S1),分别在0、2、4、6、8、10、12 h进样测定,记录色谱图,计算得各共有峰相对保留时间的RSD值均<0.04%,相对峰面积的RSD值均<0.72%,表明供试品溶液在12 h内稳定性良好。
2.4 指纹图谱的建立及相似度评价
取12批GSC样品,按照2.2项下方法制备供试品溶液,按照2.1项下色谱条件进样测定,记录色谱图,将数据导入“中药色谱指纹图谱相似度评价系统(2012年版)”,用中位数法生成对照图谱,经多点校正后进行色谱峰匹配,生成叠加图谱,结果见图1。共标定32个共有峰,其中23号峰(甘草酸)峰形对称、分离度好、峰面积大,因此选其作为参照峰(S峰),计算相对保留时间和相对峰面积,结果见表1、表2。计算12批GSC样品图谱相似度。计算得12批样品对照图谱相似度均在0.98以上,结果见表3,表明所建立的GSC指纹图谱稳定,不同批次药材的主要化学成分基本一致,可以反映其指纹特征、综合评价GSC的整体质量。

注:1.丹参素;2.芍药内酯苷;3.芍药苷;6.芹糖甘草苷;11.甘草苷;13.迷迭香酸;14.丹酚酸B;19.苯甲酰芍药苷;23.甘草酸;24.二氢丹参酮Ⅰ;26.隐丹参酮;30.丹参酮Ⅰ;32.丹参酮ⅡA;R为对照指纹图谱;其他数字表示的色谱峰未鉴定出。
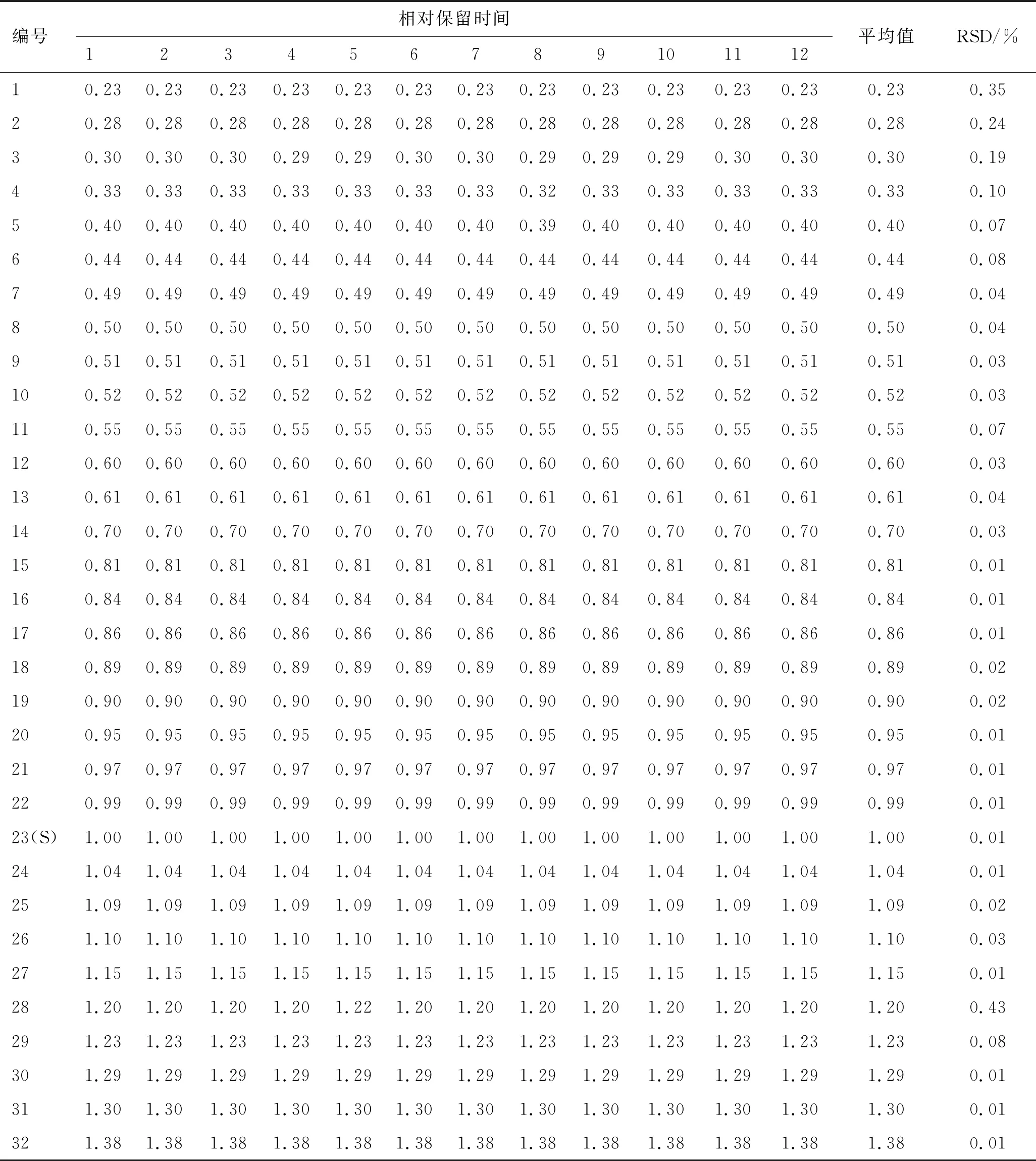
表1 共有峰的相对保留时间

表2 共有峰的相对峰面积
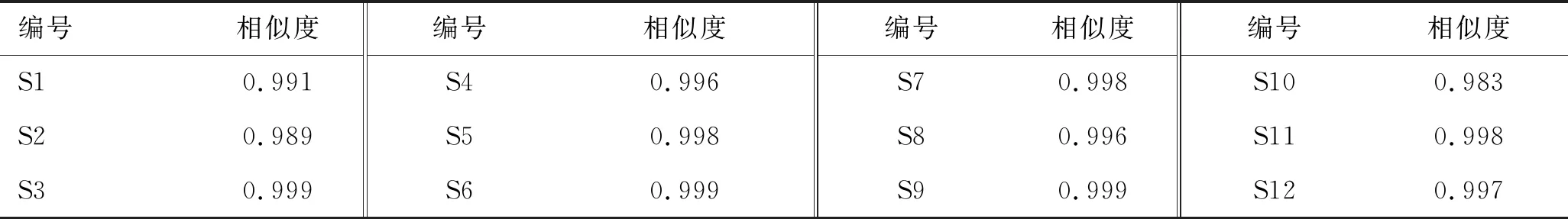
表3 相似度评价的结果
2.5 聚类分析
将12批GSC样品中32个共有峰的峰面积导入SPSS 24.0软件,用离差平均和法,测量区间为平方欧氏距离,以12批样品的共有峰的相对峰面积为变量进行聚类分析,聚类结果见图2。当平方欧氏距离为15时,可将12批标准汤剂样品分为3类,其中S9为一类,S8、S10聚为一类,S1~S7、S11、S12聚为一类,结果表明不同批号的GSC质量存在一定的差异。

图2 12批甘参复方样品的聚类分析
2.6 主成分分析(PCA)
用SPSS 24.0软件,以32个共有峰的峰面积作为变量,将12批样品进行主成分分析(principle component analysis,PCA)。通过降维因子分析,计算特征值、累积方差贡献率,结果见表4。不同产地的样品中前6个成分的累积方差贡献率为92.955%,可基本反映样品的主要信息。用SIMCA-P 14.1软件绘制12批不同产地甘参复方样品的主成分得分图,见图3。由图3可知,12批不同产地GSC样品明显分布于3个区域,均可将样品分为3类,与聚类分析结果一致。

图3 GSC样品的主成分分析
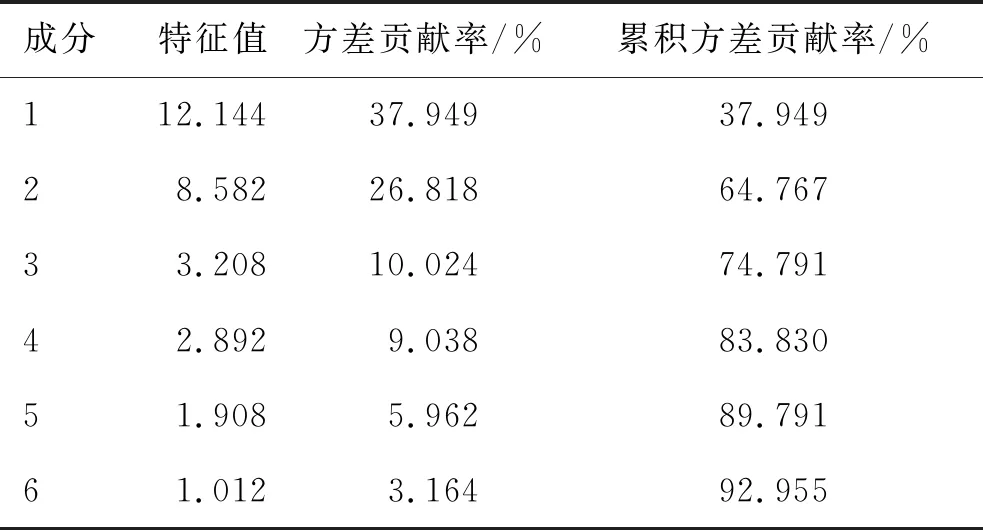
表4 不同产地GSC样品的主成分特征值及方差贡献率
2.7 偏最小二乘法判别分析
在主成分分析的基础上,为了更深入地探究不同产地间GSC样品的差异,本研究进一步用偏最小二乘法对12批样品进行比较。结果见图4。结果显示R2X和R2Y分别为0.782、0.975,预测能力参数Q2为0.777,表明建立的模型预测能力较好,且3类间离散趋势较为明显,与上述的聚类分析和主成分分析结果一致,表明不同产地的样品质量存在差异。

图4 偏最小二乘法判别分析图
3 讨论
中成药的质量不稳定是中药现代化研究中必须要解决的重大问题之一,由于海拔、气候、光照、降雨量及土壤等自然环境的影响,使同一种中药材中的有效成分差别很大。药材的质量直接关系到中药方剂的质量和疗效,《神农本草经》在序录中记载:“土地所出,真伪新陈,并各有法”;陶弘景在《本草经集注》中指出:“诸药所生,皆有境界”,并列出40多种中药材生于何地、何种土壤者良,现代研究将指纹图谱引入中药及其方剂的质量研究中。
本实验用指纹图谱研究由新疆的甘草和四川的丹参组成的GSC,建立了GSC的指纹图谱分析方法,可为GSC制剂质量标准的建立奠定基础。指纹图谱结果表明,12批样品的指纹图谱相似度均在0.98以上,相似度较高,且仪器的精密度、方法的重复性和稳定性均较好,表明所建立的GSC指纹图谱分析方法稳定、可靠。12批样品中各成分色谱峰的峰面积略有差别,表明不同批次的GSC中主要成分含量有一定差异,因此,非常有必要制定更加严格的标准进行方剂的质量控制。本文后期的研究方向是建立GSC的含量测定方法,对不同批号的GSC中的主要活性成分的含量进行研究,进一步完善GSC的质量标准。
由于本实验研究成分较多,各成分在不同条件下各有优劣,综合各方面因素考虑进行分析条件的确定。本实验首先考察了不同体积分数(30%、50%、75%、100%)的乙醇对GSC有效成分提取的影响,结果表明,用体积分数为50%的乙醇提取效果较好。指纹图谱测定色谱条件分别考察了乙腈-水、甲醇-水系统,并加入磷酸或甲酸进行调节,最终确定用乙腈-5 mL·L- 1磷酸水系统进行分离,所得各成分色谱图峰形较好、基线稳定。
