青娥丸调控Wnt1/β-catenin信号通路治疗糖尿病性骨质疏松症
2023-09-12饶艳玲黄威
饶艳玲 黄威
1.武汉市第五医院,湖北 武汉 430050
2.武汉市第三医院,湖北 武汉 430074
糖尿病性骨质疏松症(diabetic osteoporosis,DOP)是糖尿病造成的与骨骼和关节相关的严重代谢并发症,以高血糖微环境和全身性骨微结构、强度、质量损伤为特征,易发生骨折,治疗和康复困难[1-2]。临床数据显示,糖尿病患者出现骨质疏松的比例高达60.0%[3]。其最佳防治疗法为激素代替疗法,但其不良反应和副作用使患者的依从性差。研究表明,青娥丸是治疗肾虚血瘀型绝经后骨质疏松症的代表性方剂,能抑制破骨细胞活性,维持骨代谢平衡和骨钙吸收,药理疗效明显[4]。同时,加减后的青娥丸还能调节大鼠精神状态、体质量、血糖及脂质水平,发挥对2型糖尿病大鼠的治疗作用[5]。马陈等[6]认为青娥丸通过调控Wnt/β-catenin通路改善骨质疏松患者的骨密度,治疗绝经后的骨质疏松,但青娥丸对DOP的治疗效果及作用机制还不清楚。因此,本研究用青娥丸干预DOP小鼠模型,通过对其骨组织的修复情况,探究青娥丸对Wnt/β-catenin通路的影响,以期为寻找防治DOP的药物提供理论基础。
1 材料与方法
1.1 材料
1.1.1实验动物和药材:SPF级41只8周龄雄性C57小鼠来源于湖南斯莱克景达,于无特定病原体,22 ℃~26 ℃,相对湿度为50%~60%,人工光照明暗各12 h条件下饲养。实验动物使用许可证号:SYXK(鄂)2018-0104。杜仲、补骨脂、核桃仁、大蒜为主要药材,按2020版《中华人民共和国药典》中药物比例(16∶8∶5∶4)加水煎制,浓缩稀释至1 mL药液含生药5.4 g。
1.1.2试剂:戊巴比妥钠、STZ购于Sigma公司,高糖高脂糖尿病定制饲料购于江苏协同生物公司,DAB浓缩型试剂盒、EDTA·2Na购于北京索莱宝科技公司,苏木素购于北京雷根生物技术公司,Tris-EDTA修复液购于武汉赛维尔生物科技公司,小鼠ALP酶联免疫分析试剂盒、兔抗Wnt1、β-catenin、Runx2购于Bioswamp生物有限公司,Max VisionTMHRP-Polymer anti-Mouse/Rabbit IHC试剂盒购于迈新生物技术公司,Trizol购于美国ambion公司。
1.2 实验方法
1.2.1DOP小鼠模型构建及验证:空白组小鼠和模型组小鼠分别喂食标准饲料和高脂高糖饲料,模型组每日按照70 mg/kg腹腔注射1% STZ溶液,连续注射2 d,高脂高糖饲料继续饲养4周后尾静脉采血,随机血糖≥11.1 mmol/L者为糖尿病造模成功[7]。高脂高糖饲料继续饲养8周,从小鼠体重、尾静脉血糖含量,micro-CT扫描定量和股骨组织形态学变化来验证模型构建是否成功。
1.2.2实验分组及取材:模型构建成功后进行药物干预,对照组6只,其余各组7只。正常饲料喂养的小鼠为对照组,模型组用等体积的饮用水灌胃,青娥丸低、中、高剂量组按成人剂量的5、10、20倍(2.7、5.4、10.8 g/kg)灌胃[5],阿仑膦酸钠组用阿仑膦酸钠70 μg/kg灌胃,均为每天1次,连续给药12周,药物干预期间继续使用高脂高糖饲料。药物干预完成后处死小鼠,取小鼠血清、股骨,保存待测。
1.2.3HE染色观察各组股骨组织细胞形态:小鼠股骨组织置于慢速脱钙液进行脱钙处理,脱钙完成后将小鼠股骨纵切、脱水、浸蜡包埋。将组织切片脱蜡,苏木精液和伊红液染色,脱水,透明后封片,显微镜拍照。
1.2.4生化检测各组小鼠碱性磷酸酶(ALP)、尿素氮(BUN)、天冬氨酸转氨酶(AST)的水平:按照深圳迈瑞生化试剂盒说明书检测血清样本中ALP、BUN及AST含量。以标准物的OD值为横坐标,浓度为纵坐标,获得标准曲线方程,将样品的OD值代入方程式,计算出待测指标实际浓度。
1.2.5qPCR检测GSK-3β、LRP5、COL1A1 mRNA水平:总RNA用Trizol提取,纯化后利用PrimeScript Ⅱ RTase试剂盒将RNA转录为cDNA,目标基因引物见表1。PCR反应条件为:95 ℃保温3 min,95 ℃保温5 s,56 ℃保温10 s,40个循环。根据GAPDH的Ct值,用公式2-ΔΔCt计算靶基因cDNA相对表达。

表1 引物序列
1.2.6免疫组化检测蛋白Wnt1、β-catenin、Runx2表达水平:取小鼠股骨组织,脱水、浸蜡包埋、脱蜡水化。将水化后的玻片在Tris-EDTA缓冲液中高压修复18 min,置于3% H2O2中孵育10 min,10%山羊血清封闭30 min,滴加Wnt1抗体(1∶200)4 ℃孵育过夜,滴加二抗,DAB显色,苏木素复染,脱水,显微镜拍照分析。β-catenin、Runx2检测过程中,将水化后的玻片在柠檬酸钠缓冲溶液中高压修复23 min,其余步骤同上。
1.3 统计学分析

2 结果
2.1 各组小鼠Micro-CT股骨组织检测
与对照组相比,模型组小鼠的骨小梁体积数、厚度和数量、骨密度显著降低(P<0.05),而骨小梁间隔显著增加(P<0.05)。提示小鼠DOP模型构建成功。与模型组相比,青娥丸低、中、高剂量组及阿仑膦酸钠组小鼠骨小梁体积数、厚度和数量、骨密度显著升高(P<0.05),而骨小梁间隔显著减小(P<0.05),见图1、表2。

图1 各组小鼠micro-CT检测结果
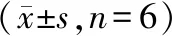
表2 各组小鼠micro-CT检测数据
2.2 青娥丸对小鼠一般行为的影响
对照组小鼠毛发光滑,多动,食欲正常。模型组小鼠毛发粗糙,食欲旺盛,多饮多尿,垫料潮湿,精神萎靡,少动。青娥丸低、中剂量干预后小鼠一般行为类似模型组,青娥丸高剂量和阿仑膦酸钠干预后,小鼠毛发粗糙,食欲正常,垫料无异常,多动,与模型组相比有明显改善。
2.3 青娥丸对DOP小鼠体重和血糖的影响
与对照组相比,模型组小鼠的尾静脉血糖值显著增加(P<0.01),体重明显下降(P<0.01)。与模型组相比,青娥丸中、高剂量组及阿仑膦酸钠组小鼠尾静脉血糖值显著下降(P<0.05),体重显著增加(P<0.05),见表3。

表3 青娥丸对DOP小鼠体重和血糖的影响
2.4 HE染色观察各组股骨组织细胞形态
与对照组相比,模型组小鼠骨细胞分布松散,胞质稀疏;细胞扁平,空骨陷窝明显增多;骨小梁宽度变窄,排列疏松。与模型组相比,青娥丸低、中、高剂量组及阿仑膦酸钠组小鼠股骨组织细胞形态规则,骨小梁宽度增加,排列更整齐,接近对照组形态,见图2。
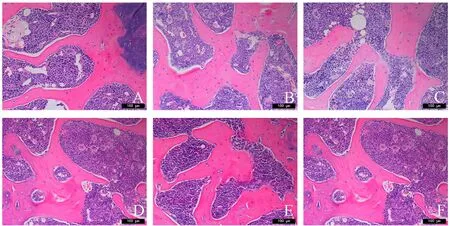
图2 青娥丸对DOP小鼠股骨组织形态的影响(×200)
2.5 各组小鼠ALP、BUN、AST水平
与对照组相比,模型组ALP、BUN、AST含量均显著增加(P<0.01)。与模型组相比,青娥丸低、中、高剂量组及阿仑膦酸钠组ALP、BUN、AST含量均显著下降(P<0.01),见表4。
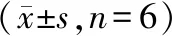
表4 青娥丸对DOP小鼠血清ALP、BUN、AST含量的影响
2.6 各组小鼠GSK-3β、LRP5、COL1A1 mRNA水平
与对照组相比,模型组GSK-3β mRNA水平显著上调(P<0.01),LRP5、COL1A1 mRNA水平显著下调(P<0.01)。与模型组相比,青娥丸低、中、高剂量组及阿仑膦酸钠组GSK-3β mRNA水平显著下调(P<0.01),LRP5、COL1A1 mRNA水平显著上调(P<0.01),见表5。
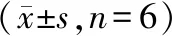
表5 青娥丸对DOP小鼠血清GSK-3β、LRP5、COL1A1 mRNA水平的影响
2.7 各组小鼠蛋白Wnt1、β-catenin、Runx2表达水平
与对照组相比,模型组中Wnt1、β-catenin、Runx2蛋白只有少量呈棕色的阳性表达(P<0.01)。与模型组相比,青娥丸低、中、高剂量组及阿仑膦酸钠组中Wnt1、β-catenin、Runx2蛋白棕色染色面积变大,阳性表达增多(P<0.05),见图3、表6。
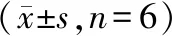
表6 青娥丸对Wnt1、β-catenin、Runx2蛋白光密度的影响
3 讨论
青娥丸自宋代以来就被用于中医临床治疗,现已被纳入绝经后骨质疏松症和非创伤性股骨头缺血性坏死的治疗指南。青娥丸能提高骨形态生成蛋白水平,促进成骨细胞分化,提高绝经后骨质疏松患者血清骨硬化蛋白表达,有效缓解骨质疏松造成的损伤[8]。在去卵巢小鼠模型中,青蛾丸有效提高骨髓灌注、改善骨髓微循环,对因老年或绝经导致的骨质疏松有明显治疗效果[9]。但其对糖尿病导致的骨质疏松治疗效果还尚未可知。本研究中DOP小鼠尾静脉血糖上升,出现多饮、多尿、多食、体重减轻,小鼠股骨组织微结构出现病理改变,而青娥丸干预治疗后,小鼠股骨组织病理损伤得到改善,骨密度增加,说明青娥丸对DOP小鼠具有治疗作用。
在过去20年中,骨质疏松症治疗有了实质性的进步,研发了有效的骨吸收抑制剂或骨形成刺激剂药物。阿仑膦酸钠是治疗骨质疏松症的常用药之一,可通过抑制骨吸收来增加骨量并降低患者骨折的风险,但常见的骨质疏松症药理疗法在DOP中的治疗效果还有待增强。DOP是由于胰岛素绝对或相对缺乏、激素失衡或内分泌功能障碍引起的钙、磷代谢紊乱,导致骨密度下降和骨微观结构改变,并且高糖水平会影响成骨细胞合成骨钙素的能力,损害骨形成,抑制骨矿化[10]。实验证据表明,较高水平的BUN可能会增加胰岛素抵抗并抑制胰岛素分泌,增加患糖尿病和脂肪肝的风险[11-12]。AST分布于肝细胞线粒体中,其水平升高会使免疫细胞大量浸入肝脏,诱导肝损伤,加重糖尿病[13]。本研究中,青娥丸和阿仑膦酸钠均可显著降低小鼠细胞中BUN和AST水平,高剂量的青娥丸效果优于阿仑膦酸钠作用效果。同时,青娥丸和阿仑膦酸钠干预后ALP表达降低。ALP是骨形成生物标志物,由成骨细胞合成,可以反映成骨细胞的成熟度,对骨形成具有重要影响[14-15]。这说明青娥丸不仅可以缓解DOP的骨损伤,同时对糖尿病的发展具有一定的抑制作用。
研究证明,青娥丸可以通过增加β-catenin蛋白表达改善去卵巢骨质疏松模型的骨微观结构和生物力学[16]。β-Catenin是Wnt通路的重要信号分子,在成骨细胞分化、增殖和凋亡中起着重要作用。在Wnt/β-catenin通路中,LRP5可以与Wnt构成复合体,抑制由GSK-3β表达,进而抑制β-catenin的磷酸化,而未磷酸化的β-catenin会与转录因子结合,从而激活下游转录因子Runx2[17-18]。GSK-3β可负向调节骨代谢,当其表达受到抑制时,能降低BMP信号通路中硬化蛋白表达,促进成骨细胞的分化[19]。本研究中,青娥丸干预DOP小鼠模型后,小鼠细胞中Wnt1/β-catenin通路蛋白表达上调,骨形成相关基因Runx2、LRP5 COL1A1表达上调,GSK-3β表达下调。这说明青娥丸能通过Wnt1/β-catenin通路调控骨形成相关基因的表达,从而发挥对DOP小鼠的治疗作用。
综上所述,青娥丸缓解DOP小鼠骨微结构和骨密度受损,同时抑制糖尿病进展,发挥积极治疗作用,其作用机制可能与青娥丸对Wnt1/β-catenin通路的激活作用有关。这为青娥丸对DOP患者的治疗提供了更多的依据,有望成为临床抗DOP的理想选择。
