外泌体非编码RNAs在骨质疏松症中的研究进展
2023-09-12娄纯彪蔡武胜吕浩魏传付李志超曹慧
娄纯彪 蔡武胜 吕浩 魏传付 李志超 曹慧*
1.山东中医药大学,山东 济南 250000
2.菏泽市第三人民医院,山东 菏泽 274000
3.山东中医药大学附属医院,山东 济南 250000
骨质疏松症(osteoporosis,OP)是一种慢性全身性骨骼疾病,由正常情况下严格调节的骨稳态失衡所引起,其特征是源自骨髓间充质干细胞(bone marrow mesenchymal stem cells,BMSCs)的成骨细胞(osteoblasts,OB)骨形成减少与源自造血干细胞的破骨细胞(osteoclasts,OC)骨吸收增加,导致骨密度降低以及骨折风险增加[1]。目前,诊断OP的首选技术是双能X射线吸收测定法(dualenergy X-ray absorptiometry,DXA)扫描[2],虽然DXA很有价值,但由于特异性和敏感性有限,只能揭示已经确定的骨骼结构变化,而无法区分导致相同骨病理状况的不同潜在原因[3]。同时,目前可用的抗再吸收和合成代谢药物仅导致骨矿物质密度适度增加和非椎体骨折率适度降低,未满足患者对更有效抗OP方法的需求[4]。因此,尽管OP的管理策略在过去几年中取得了一些进展,但导致OP的复杂分子机制以及潜在生物标志物和治疗靶点的缺乏阻碍了其预防和治疗的改进[5]。
外泌体是直径为40~100 nm的圆盘状囊泡,作为细胞间天然高效的运输载体,通过配体-受体相互作用、内吞作用、直接膜融合或信号通路传导将其包含的多种生物活性分子递送至靶细胞[6-7]。值得注意的是,非编码RNAs(non-coding RNAs,ncRNAs)也存在于外泌体中,其主要由微小RNAs(micro RNAs,miRNAs)、长链非编码RNAs(long non-coding RNAs,lncRNAs)和环状RNAs(circular RNAs,circRNAs)组成,作为骨稳态调节因子在OP中发挥了至关重要的作用[8]。鉴于外泌体ncRNAs在众多疾病中发挥出的治疗潜力,外泌体ncRNAs可能成为探索OP发病机制和治疗方法的新型生物标志物和潜在治疗靶点。因此,本文总结了外泌体ncRNAs在OP中调控BMSCs成骨分化、OB骨基质矿化、OC骨吸收、骨相关细胞活性和凋亡以及血管生成方面所发挥的作用,以确定与OP相关的外泌体ncRNAs的最新研究成果、潜在应用和挑战。见图1。
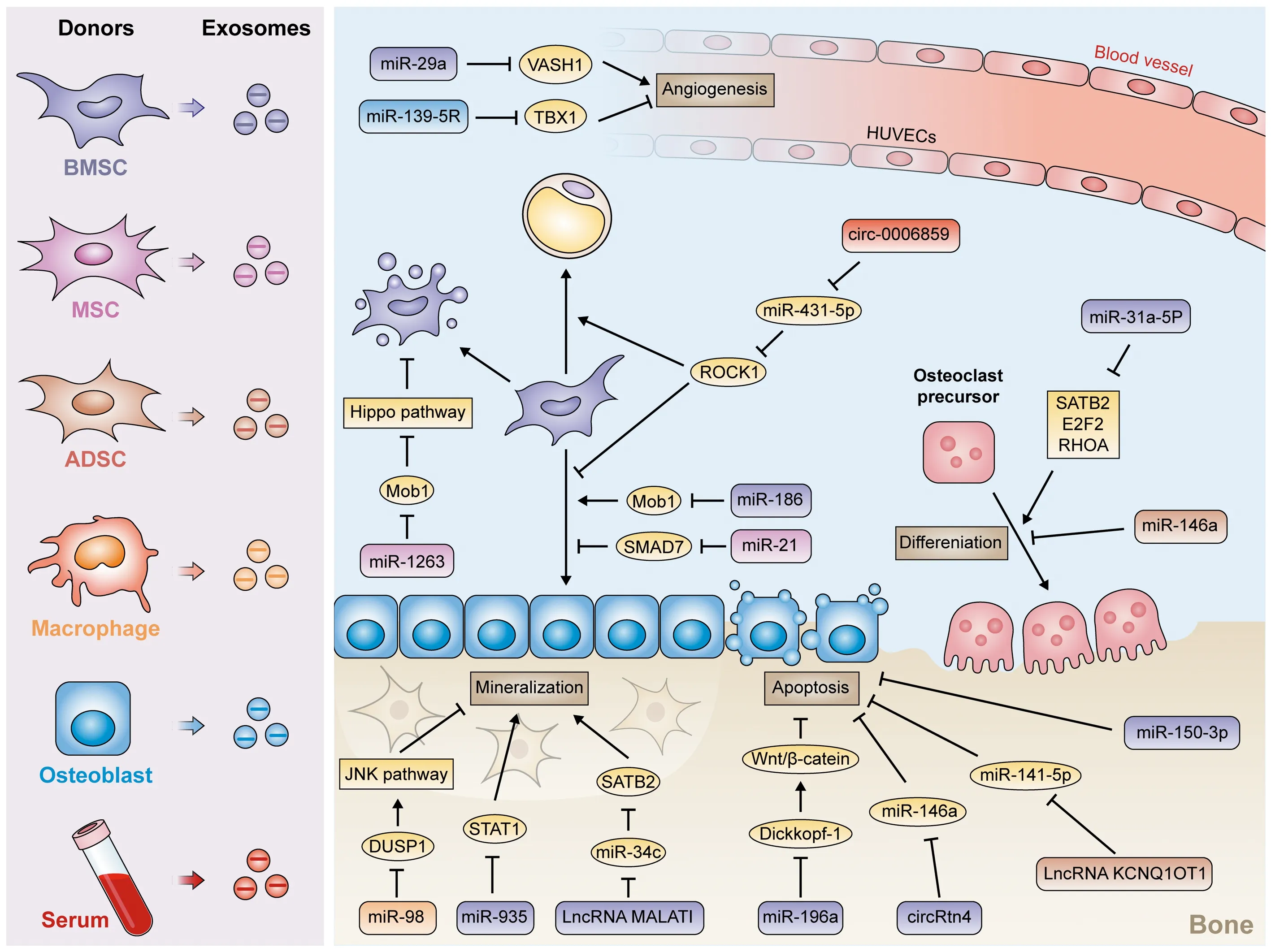
图1 外泌体ncRNAs在OP中的调控机制
1 外泌体ncRNAs调控成骨分化
作为OB和脂肪细胞的共同祖细胞,BMSCs在骨稳态、组织再生和整体能量稳态中发挥着关键作用[9]。在衰老过程中,BMSCs会降低分化为OB的能力,但会增加分化为脂肪细胞的能力,这会造成骨质流失从而导致OP[10]。因此,促进BMSCs成骨分化,恢复骨内稳态平衡是OP防治研究的方向之一。Li等[11]发现源自正常BMSCs的外泌体在体内改善了卵巢切除术(OVX)大鼠OP症状,在体外则促进了OVX大鼠BMSCs的增殖和成骨分化,其机制与miR-186在外泌体中高表达并靶向抑制单极纺锤体结合蛋白1(mps one binder kinase activator protein 1,Mob1)表达有关。与之相反,Jiang等[12]发现从OP患者中提取的间充质干细胞(mesenchymal stem cells,MSCs)来源的外泌体中miR-21表达明显高于健康成人,用来自OP患者的外泌体处理的MSCs中成骨分化标志物Runt相关转录因子2(Runx2)、碱性磷酸酶(alkaline phosphatase,ALP)和骨钙素(osteocalcin,OCN)表达显著降低。同时,Smad同源物7(SMAD7)被证实为miR-21直接靶点,在OP患者中下调,而SMAD7的过表达抑制ALP、OCN和Runx2表达,证明了从OP患者中提取的MSCs衍生的外泌体miR-21通过靶向SMAD7从而抑制BMSCs成骨分化。
此外,Feng等[13]观察到绝经后骨质疏松症(postmenopausal osteoporosis,PMOP)患者血清中分离的外泌体中circ_0006859表达较健康患者明显上调,进一步研究发现circ_0006859过表达可以抑制OCN和ALP水平,促进脂肪形成标志物转录因子CCAAT/增强子结合蛋白(C/EBPα)和过氧化物酶体增殖物激活受体γ(PPARγ)的水平,其作用机制是通过作为miR-431-5p的内源竞争RNA(ceRNA),促进miR-431-5p靶基因Rho相关卷曲螺旋蛋白激酶1(ROCK1)表达实现的,表明外泌体circ_0006859是PMOP的潜在生物标志物,并通过海绵化miR-431-5p调节BMSCs中成骨和脂肪形成之间的平衡。
2 外泌体ncRNAs调控OB骨基质矿化
OB是来自BMSCs的长方体细胞,负责产生并维持骨骼结构,为骨基质产生胶原蛋白(主要是Ⅰ型胶原),并调节随后的基质矿化,在体内合成与矿化基质相关的非胶原蛋白(包括唾液酸蛋白、OPN、OCN),而且通过分泌细胞因子或通过直接细胞接触对OC的分化和活性造成影响[14-16]。OB谱系的发育和功能受到多种因素影响,ncRNAs作为主要因素之一,被认为在OB增殖、分化、骨基质矿化、活性和凋亡方面发挥重要作用[8]。最新的几项研究探讨了不同细胞衍生的外泌体和其携带的ncRNAs在调节OB骨基质矿化中的作用。Zhang等[17]报道了携带miR-935的BMSCs衍生的外泌体与OVX大鼠的相关性,其通过将miR-935递送到人成骨细胞系hFOB1.19中从而靶向并抑制信号转导和转录激活因子1(STAT1)水平,促进hFOB1.19细胞增殖、ALP活性和矿化结节形成。此外,OVX大鼠体内实验表明,抑制miR-935显著降低骨密度(bone mineral density,BMD)、骨体积分数(BV/TV)、骨小梁数目(Tb.N)、骨小梁厚度(Tb.Th)并增加骨小梁间隙(Tb.Sp),证明了BMSCs衍生的外泌体miR-935通过靶向STAT1促进hFOB1.19细胞的增殖、分化和矿化。同样,Yang等[18]证明了携带lncRNA MALAT1的BMSCs衍生的外泌体促进了hFOB1.19细胞增殖、ALP活性和矿化结节形成,其机制是作为miR-34c的ceRNA以促进特异AT序列结合蛋白2(SATB2)表达,OVX小鼠体内实验表明miR-34c逆转了MALAT1的作用,SATB2逆转了miR-34c的作用,证明了BMSCs衍生的外泌体lncRNA MALAT1通过介导miR-34c/SATB2轴促进hFOB1.19细胞增殖、分化和矿化并有效减轻OP症状。
慢性炎症是OP的直接诱因[19]。巨噬细胞是一类免疫反应的主要调节因子,分为M1促炎表型和M2抗炎表型。据报道,巨噬细胞向M1表型的极化会导致小鼠骨溶解[20],以及在炎症反应的调节过程中分泌外泌体[21]。Yu等[22]在OVX小鼠中观察到BMD降低和Tb.N减少,在用M1巨噬细胞衍生的外泌体处理后则进一步加重了骨质流失,进一步的体外试验发现M1巨噬细胞衍生的外泌体处理的MC3T3-E1细胞中miR-98水平显著上调,通过靶向双特异性磷酸酶-1(DUSP1)激活其介导的JNK信号通路,降低MC3T3-E1细胞中成骨细胞特异性转录因子(OSX)、Runx2、ALP表达和减少矿化结节形成,从而推动骨质流失和OP的发展。
3 外泌体ncRNAs调控OC介导的骨吸收
骨骼的重塑是一个紧密耦合的过程,OC作为人体唯一的骨吸收细胞,对骨重塑至关重要。OC是由破骨前体细胞融合产生的多核细胞,具有溶解骨基质的能力,通过在吸收区分泌H+、Cl-、组织蛋白酶K和基质金属蛋白酶以响应巨噬细胞集落来刺激因子和NF-κB配体的受体激活剂[23]。OC性骨吸收增强是PMOP、糖皮质激素性OP和炎症相关OP等疾病快速骨质丢失的主要原因[24]。因此,通过外泌体ncRNAs调节OC生成和功能从而抑制骨吸收可能是减少快速骨丢失和防治OP的有效手段。
促炎细胞因子,如肿瘤坏死因子-α(tumor necrosis factor alpha,TNF-α)、白细胞介素-1β(interleukin-1β,IL-1β)等,可以增加OC生成,促进骨吸收,从而导致OP[25]。Zhang等[26]通过建立细胞和糖尿病骨质疏松大鼠模型,评估携带miR-146a的脂肪干细胞(adipose-derived stem cells,ADSCs)衍生的外泌体的抗炎作用,发现外泌体miR-146a给药可有效抑制高糖诱导的OC中促炎细胞因子的产生以及骨吸收,并恢复链脲佐菌素诱导的糖尿病性OP大鼠的骨丢失,其机制是外泌体miR-146a通过抑制TNF-α、IL-18和IL-1β的表达,诱导NLRP3炎性体失活,最终降低OC骨吸收能力并恢复骨丢失。
骨髓微环境中年龄相关分子的改变是OP的驱动力之一,这些分子通过调节OB和OC的活性来抑制骨形成并促进骨吸收,从而导致与年龄相关的骨质流失[27]。Xu等[28]观察到来自老年大鼠的BMSCs中衰老相关分泌表型和成脂分化的增加以及成骨分化和干性的减少,进一步研究发现miR-31a-5p随着BMSCs的衰老而显著增加,并通过外泌体分泌到细胞外微环境中,然后使用外泌体作为载体的miR-31a-5p不仅通过靶向SATB2和E2F转录因子2(E2F2)分别调节BMSCs在成骨和细胞衰老中的功能,而且通过靶向RAS同源基因家族成员A(RhoA)正向调节OC分化,证明了外泌体miR-31a-5p可作为OB和OC生成的重要调节因子,在调节衰老骨髓微环境中的骨形成和骨吸收方面发挥重要作用。此外,他们还发现在骨髓中应用antagomiR-31a-5p可减少与年龄相关的骨质流失,为年龄相关性骨丢失提供了一项潜在的生物治疗策略。
4 外泌体ncRNAs调控骨相关细胞活性和凋亡
OB数量的维持有利于骨重塑过程中骨的形成,而OB的数量不仅取决于成熟细胞的生产,还与OB的存活率密切相关。因此,在OP防治中不仅需要促进OB增殖、分化和基质矿化功能的发挥,还需要保持OB活性并抑制其凋亡,以维持其正常数量。Qiu等[29]在OVX大鼠血清中发现miR-150-3p、Runx2、OSX明显减少,通过注射BMSCs衍生的外泌体可有效改善大鼠OP症状,其治疗效果受到外泌体中miR-150-3p水平的正向调控,同时在体外观察到外泌体可有效促进OVX大鼠中OBs的增殖、分化,增加OB活力并抑制其凋亡,并同样受到外泌体中miR-150-3p水平的正向调控,证明了BMSCs衍生的外泌体携带的miR-150-3p在OP中的积极治疗效果。Peng等[30]发现从BMSCs中提取的外泌体显著促进了HFOB1.19向成骨细胞的分化,进一步分析发现BMSCs衍生的外泌体中富含miR-196a,并可将miR-196a传递到HFOB1.19细胞,靶向并抑制Wnt通路抑制因子(Dickkopf-1)从而激活Wnt/β-catenin通路以促进成骨分化,流式细胞仪检测细胞凋亡率明显降低,同时凋亡相关蛋白caspase-3和caspase-6表达明显下降,而抑制miR-196a时外泌体将无法发挥作用,证明了BMSCs衍生的外泌体传递的miR-196a通过靶向Dickkopf-1激活Wnt/β-catenin通路,在促进OB分化,抑制OB凋亡中发挥重要作用。
在OP的发病机制中,TNF-α作为一种促炎细胞因子,已被证实可通过诱导细胞毒性和凋亡抑制OB分化和骨形成[31-32]。Wang等[33]将TNF-α诱导的OB与ADSCs衍生的外泌体或经lncRNA KCNQ1OT1修饰的ADSCs衍生的外泌体共培养,发现TNF-α剂量依赖性地增加miR-141-5p表达,抑制OB活力并促进其凋亡,ADSCs衍生的外泌体可以减弱TNF-α诱导的OB的细胞毒性和凋亡,与之相比,lncRNA KCNQ1OT1修饰的ADSCs衍生的外泌体通过海绵化miR-141-5p发挥更显著的抑制作用。类似的,Cao等[34]发现用TNF-α处理MC3T3-E1细胞可降低细胞活力并以剂量依赖性方式增加凋亡相关蛋白半胱氨酸天冬氨酸蛋白水解酶-3(caspase-3)、切割型caspase-3(c-caspase-3)和Bcl-2相关X蛋白(Bax)表达,促进细胞凋亡并增加miR-146a表达,而与源自circ-Rtn4修饰的BMSCs的外泌体共培养则通过海绵化miR-146a,抑制了TNF-α诱导的MC3T3-E1细胞caspase-3、c-caspase-3和Bax表达,减弱了细胞毒性和凋亡。
废用性骨质疏松症(disuse osteoporosis,DOP)是由于缺乏机械应力刺激而导致的,与PMOP和老年性骨质疏松症(senile osteoporosis,SOP)具有共同的特征,包括低骨量和骨组织的微结构退化,同时使人的骨折易感性增加[35]。Yang等[36]研究了源自MSCs的外泌体在DOP中的功能,发现来自DOP大鼠模型的BMSCs中Bax和c-caspase-3表达水平显著升高,而人脐带间充质干细胞(human umbilical cord mesenchymal stem cells,HUCMSCs)衍生的外泌体处理后表达水平明显受到抑制,高通量miRNA测序发现miR-1263的水平在差异表达的miRNAs中最为丰富,同时外泌体miR-1263可以直接靶向并抑制Mob1从而抑制Hippo信号通路的激活,逆转了体外DOP中BMSCs的凋亡。同时,他们还在体内实验中观察到大鼠DOP的改善和骨量的增加,证明了源自HUCMSCs的外泌体miR-1263可有效抑制BMSCs凋亡和预防DOP的发生发展。
5 外泌体ncRNAs调控血管生成
考虑到成骨和血管生成之间的联系,越来越多的研究开始研究OP的发生发展与血管生成之间的关系[37]。这两者之间被广泛接受的关系是血管生成减少引起OP,促进局部血管生成则会减轻OP[38]。Lu等[39]探索了衰老OB衍生的外泌体中miRNAs如何影响衰老过程中的人血管内皮细胞(human umbilical vascular endothelial cells,HUVECs),发现miR-139-5p在衰老的OB及其外泌体中高表达,将HUVECs和衰老OB共培养后,miR-139-5p在HUVECs中也上调,进一步研究发现miR-139-5p可以通过靶向T盒转录因子1(TBX1)促进HUVECs的凋亡和衰老,抑制其增殖和迁移,证明了衰老OB衍生的外泌体介导的miR-139-5p通过外泌体途径靶向TBX1调控HUVECs功能。同样,Liu等[40]报道了BMSCs衍生的外泌体可以被HUVECs摄取并促进HUVECs的增殖、迁移和管状结构形成,进一步分析发现BMSCs衍生的外泌体中miR-29a水平较高,并通过转运到HUVECs中以靶向血管生成抑制因子1(VASH1)的方式调节血管生成。此外,载有miR-29a的外泌体在小鼠体内表现出很强的促进血管生成和成骨的能力,表现为显著增加的BMD、BV/TV、Tb.N和较低的Tb.Sp,最终证明了BMSCs衍生的外泌体携带的miR-29a通过靶向VASH1调节血管生成和成骨,可作为OP的潜在治疗靶点。详见表1。
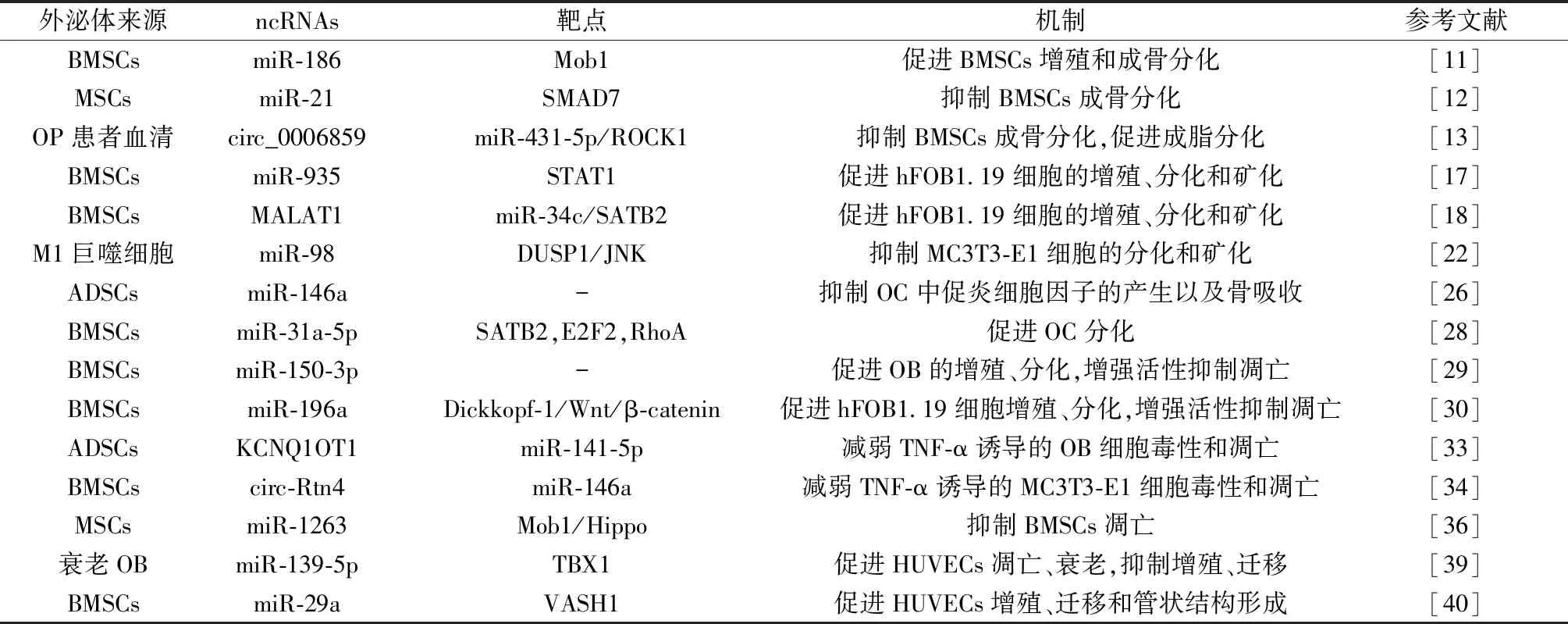
表1 外泌体ncRNAs在OP中的调控机制
6 总结和展望
本综述重点关注了外泌体的ncRNAs在OP中调控BMSCs成骨分化、OB骨基质矿化、OC骨吸收、骨相关细胞活性和凋亡以及血管生成方面所发挥的作用,这些ncRNAs都具有特定的特性,控制着其靶基因的表达和mRNA的稳定,影响着一个或多个骨代谢过程中的关键基因表达。更重要的是,它们经常被发现富集在外泌体中,而且几乎所有的细胞类型都可以分泌外泌体。因此,这些包裹着丰富ncRNAs的外泌体满载货物穿梭在BMSCs、OBs、OCs之间,在骨重塑过程中发挥着关键作用。近年来,不同来源的外泌体携带的ncRNAs被不断鉴别和研究,并被认可为OP的新型生物标志物和潜在治疗靶点。当然,由于这一研究领域的涉足时间较短,也不可避免地存在一些不足。首先,目前的研究仅限于体外细胞和动物模型展开,而未有作为治疗手段进入临床应用的报道出现。其次,lncRNAs和circRNAs都可以通过海绵化miRNAs来影响OP进程,而有关lncRNAs和circRNAs的研究相对较新较少,例如外泌体circRNAs在OC中的调节作用至今未有报道,但作为重要的调节因子,其治疗潜力是毋庸置疑的。同时,ncRNAs在不同疾病中也同时发挥着不同的调控作用,因此,有必要探索它们与OP及其他疾病之间的联系机制,例如寻找骨相关疾病之间的共性,这可能有助于使用外泌体ncRNAs进行治疗。最后,实验模型的标准、外泌体分离纯化方法的标准、样本量的标准等一系列标准问题也等待明确。总之,外泌体ncRNAs的研究仍然存在挑战,但具有一定的潜力,外泌体ncRNAs的深入研究在帮助开发新的OP诊断和治疗策略中具有重要意义。
