绝经后股四头肌肌肉萎缩膝骨关节炎大鼠模型的建立及鉴定
2023-09-12陈泽华申震陈国茜许学猛刘文刚
陈泽华 申震 陈国茜 许学猛,4* 刘文刚,4*
1. 株洲市中医伤科医院,湖南 株洲 412000
2. 昆明市中医院/云南中医药大学第三附属医院,云南 昆明 650011
3. 浙江省中医院骨伤科,浙江 杭州 310000
4. 广东省第二中医院,广东 广州 510405
膝骨关节炎(knee osteoarthritis,KOA)是一种慢性退行性骨关节病,正严重威胁着中老年人的健康[1]。近年来发现,KOA的病理变化累及全关节及关节周围组织,除软骨退变、软骨下骨硬化、囊性变、骨赘形成等骨质结构改变外,还伴有膝关节周围肌肉组织的异常改变[2]。研究发现KOA患者下肢肌肉萎缩主要以股四头肌为主,股四头肌肌肉萎缩会降低膝关节稳定性,会加剧关节软骨磨损,导致KOA形成[3-4]。目前,KOA的动物模型很多,包括Hulth造模法、膝关节制动,关节内注射碘乙酸、木瓜蛋白酶,卵巢切除去势等造模方法[5]。其中绝大部分造模方法仅关注膝关节的关节炎表现,即软骨破坏和关节炎症,却忽视了股四头肌肌肉萎缩在KOA发病过程中的作用。尽管采用肉毒素肌注引起股四头肌肌肉萎缩进而诱导KOA的动物模型在兔及大鼠中已被证实,但是既往肉毒素股四头肌肌肉注射的KOA模型存在一些不足,如需多次进行肉毒素注射,单次注射随着股四头肌肌肉修复膝关节软骨退变减轻,这并不符合KOA的病理过程[6-13]。由于女性绝经后雌激素水平下降可影响肌肉代谢,导致老龄性肌肉流失,故女性的KOA发病率高于男性,且女性中老年KOA患者伴有明显的股四头肌肌肉萎缩[14]。因此,本研究在肉毒素诱导股四头肌肌肉萎缩的基础上,结合卵巢切除去势进行叠加造模,以建立一种更符合绝经后KOA真实病理变化的大鼠模型,并比较不同模型之间的差异,为研究股四头肌肌肉萎缩与KOA之间的关系、探寻KOA的防治方法提供研究基础。
1 材料与方法
1.1 材料
1.1.1实验动物:3月龄SPF级雌性SD大鼠,共40只,体重(250 ± 15)g,购自广东省医学实验动物中心[SCXK(粤)2020-0059],于广州中医药大学第五临床医学院药理毒理实验室进行喂养,动物许可证编号为[SYXK(粤)2018-0002]。饲养条件:恒温25 ℃,相对湿度为40 % ~ 50 %,昼夜各12 h,自由饮水及摄食,每笼5只、分笼喂养。本实验研究经广州中医药大学第五临床医学院实验动物伦理委员会审查通过(048785)。
1.1.2主要试剂和仪器:注射用A型肉毒素(BOTOX-A,保妥适,100 U/支,注册证号:S20171005,爱尔兰);戊巴比妥钠(北京岚泰化工科技公司,中国);番红固绿染色液(赛维尔,产品编号:G1053-100 ML,中国);伊红-苏木素(HE)试剂(碧云天,产品编号:C0105 S,中国);BX51荧光显微镜(Olympus,日本);大小鼠抓力测定仪(型号:YLS-13A,上海欣软科技,中国)。
1.2 方法
1.2.1实验分组:随机将40只雌性SD大鼠分为卵巢切除组(OVX组)、卵巢切除+肉毒素组(OVX+BTX组)、肉毒素组(BTX组)和空白组(Control组),每组各10只。每组中的5只于造模后4周取材,另5只于造模后9周取材,对9周取材的各组大鼠定期称重。
1.2.2建立卵巢切除动物模型:采用2 %的戊巴比妥钠、按30 mg/kg剂量对除Control组外的三组大鼠进行腹腔注射麻醉。麻醉成功后,大鼠取俯卧位,消毒铺巾,在腰椎两侧各切开约1 cm,分离皮下组织及脂肪,小心牵拉出卵巢,丝线结扎后剪除卵巢。将输卵管回纳后,清洗伤口后予以缝合。术后予以左侧臀肌注射青霉素5万U预防感染,连续3 d。
1.2.3建立肉毒素股四头肌肌肉注射模型:BTX组大鼠肉毒素注射在麻醉后进行,OVX+BTX组则在卵巢切除术后进行肉毒素注射。注射方法:先将肉毒素用生理盐水配制成10 U/mL,在助手帮助下,沿右侧股直肌、股内侧肌及股外侧肌中点位置,按10 U/kg剂量平均于以上3个位置进行肌肉注射。仅单次注射,造模后大鼠如步态发生变化即造模成功。
1.2.4Lequesne MG评分:对9周取材的大鼠,在第4周和第9周时进行Lequesne MG评分[15],总分为0~11分,评分越高说明其KOA越严重。
1.2.5大鼠抓力测定:对9周取材的20只大鼠分别于第4周和第9周测定其四肢抓力及双后肢抓力。测定方法:将大鼠放置于抓力板上,向后轻拉大鼠尾巴,大鼠四肢抓紧抓力板时,均匀用力后拉至脱爪,测试仪自动记录下最大抓力。测量大鼠双后肢抓力时,悬吊大鼠上半身,使其身体与抓力板保持约30 °角,向后牵拉至脱爪测出双后肢的抓力。测量3次,取平均值。
1.2.6标本收集:造模后4周,每组取材5只,剩下的于造模后9周取材。先将大鼠麻醉后脱颈处死。在股四头肌远端于髌上缘止点处切断,沿肌间隙完整分离股四头肌。小心分离并切下右侧滑膜,最后将右侧膝关节完整取下。
1.2.7固定、切片及染色:将取下的肌肉、滑膜和膝关节置于含4 %多聚甲醛溶液中固定72 h,肌肉和滑膜组织可进行包埋切片,膝关节标本则先用EDTA脱钙5周后再进行包埋及切片。对肌肉及滑膜组织切片进行HE染色,膝关节切片则采用HE和番红-固绿染色。
1.2.8软骨Mankin评分及滑膜炎症评分:根据关节软骨切片的HE染色和番红-固绿染色进行Mankin评分[16](总分为0~14分),分数越高表示软骨破坏越严重。滑膜评分采用9分制[17],总分为0 ~ 9分,分值越高代表滑膜炎症越严重。
1.3 统计学分析

2 结果
2.1 各组大鼠体重比较
各组大鼠造模前体重无明显差异,造模4周后 OVX组体重[(359.00 ± 5.79)g]明显大于OVX+BTX组[(342.00 ± 11.83)g]和Control 组[(331.80 ± 22.99)]g,差异具有统计学意义(P=0.001、0.024,均< 0.05);而OVX+BTX组体重明显大于BTX组[(313.80 ± 22.15)]g,差异有统计学意义(P=0.020 <0.05)。造模9周后,OVX组大鼠体重[(463.20 ± 15.77)g]明显大于OVX+BTX组[(424.80 ± 16.96)g]、BTX组[(360.40 ± 14.22)g]和Control组[(373.00 ± 23.19)g],且有统计学意义(P=0.004、<0.001、<0.001,均<0.01),且OVX+BTX组体重明显大于BTX组和Control组,差异具有统计学意义(P<0.001、<0.001,均<0.05)。
2.2 各组大鼠Lequesne MG评分比较
造模4周后,OVX+BTX组和BTX组大鼠的Lequesne MG评分[分别为(6.20 ± 0.45)、(5.20 ± 0.45)]明显高于OVX组(1.00 ± 1.22)和Control组(0.20 ± 0.45),且差异均有统计学意义(P均<0.01)。造模9周后,OVX组、OVX+BTX组和BTX组大鼠的Lequesne MG评分较前均有不同程度的升高。比较发现,OVX+BTX组和BTX组大鼠Lequesne MG评分[分别为(9.00 ± 1.22)、(7.20 ± 0.84)]明显高于OVX组(4.40 ± 0.89)和Control组(0.20 ± 0.45),且差异均有统计学意义(P均<0.01);且OVX+BTX组大鼠Lequesne MG评分高于BTX组,差异有统计学意义(P<0.01)。同时,OVX组大鼠的Lequesne MG评分明显高于Control 组,差异具有统计学意义(P<0.01)。
2.3 大鼠抓力情况比较
造模4周后,OVX+BTX组和BTX组大鼠的四肢抓力[分别为(1 337.00 ± 167.41)g、(1 414.00 ± 203.22)g]明显低于OVX组[(1 640.00 ± 117.12)g],差异有统计学意义(P=0.007、0.035,均<0.05)。同时OVX+BTX组的四肢抓力体重比值(3.91 ± 0.50)明显低于OVX 组(4.57 ± 0.36)和Control组(4.67 ± 0.39),差异有统计学意义(P=0.038、0.008,均<0.05)。OVX+BTX组的双后肢抓力[(475.80 ± 20.44)g]和抓力体重比[(1.39 ± 0.07)]均明显低于OVX组[(741.00 ± 12.14)g、(2.06 ± 0.04)]和Control组[(968.80 ± 54.21)g、(2.63 ± 0.24)],均P< 0.01;BTX组的双后肢抓力[(587.00 ± 21.12)g]和抓力体重比(1.88 ± 0.09)均显著低于OVX组(P<0.001、P=0.042,均<0.05)和Control组(均<0.01),OVX组双后肢抓力和抓力体重比均显著低于Control组(P均<0.01);且OVX+BTX组双后肢抓力和抓力体重比均显著低于BTX组,差异有统计学意义(P均<0.01)。
造模9周后,OVX+BTX组四肢抓力[(1 504.00 ± 116.98)g]均显著低于OVX组[(1 852.40 ± 12.14)g]、BTX组[(1 753.80 ± 83.71)g]和Control组[(1 756.00 ± 37.12)g],P=0.001、0.024、0.018,均<0.05;OVX组四肢抓力体重比(4.01± 0.35)均明显低于BTX组(4.87± 0.34)和Control组(4.73 ± 0.56),P=0.004、0.013,均< 0.05,OVX+BTX组四肢抓力体重比(3.55 ± 0.33)明显低于BTX组和Control组(均<0.01)。OVX+BTX组双后肢抓力[(579.20 ± 65.42)g]及抓力体重比(1.36 ± 0.15)均显著低于OVX组[(943.20 ± 36.87)g、(2.04 ± 0.05)]、BTX组[(743.20 ± 52.98)g、(2.06 ± 0.17)]和Control组[(968.80 ± 54.21)g、(2.61 ± 0.26)],均< 0.01,且BTX组双后肢抓力及抓力体重比均显著低于Control组(均<0.01)。BTX组双后肢抓力明显低于OVX组(P<0.01),而二者的双后肢抓力体重比并无统计学差异(P=0.798)。OVX组双后肢抓力体重比明显低于Control组(P<0.01),而二者的双后肢抓力却并无统计学差异(P=0.459)。
2.4 各组股四头肌组织形态学观察
各组大鼠右侧股四头肌横切截面如图1所示,OVX+BTX组和BTX组在造模4周后,右侧股四头肌均出现明显萎缩,肌肉组织内出现炎性浸润,肌纤维横截面较Control组和OVX组明显减小。造模后9周,OVX组、OVX+BTX组和BTX组均可见肌纤维间隙增宽,OVX+BTX组和BTX组的萎缩肌肉组织炎性吸收,但仍未完成修复,部分萎缩肌纤维细胞发生脂肪变。
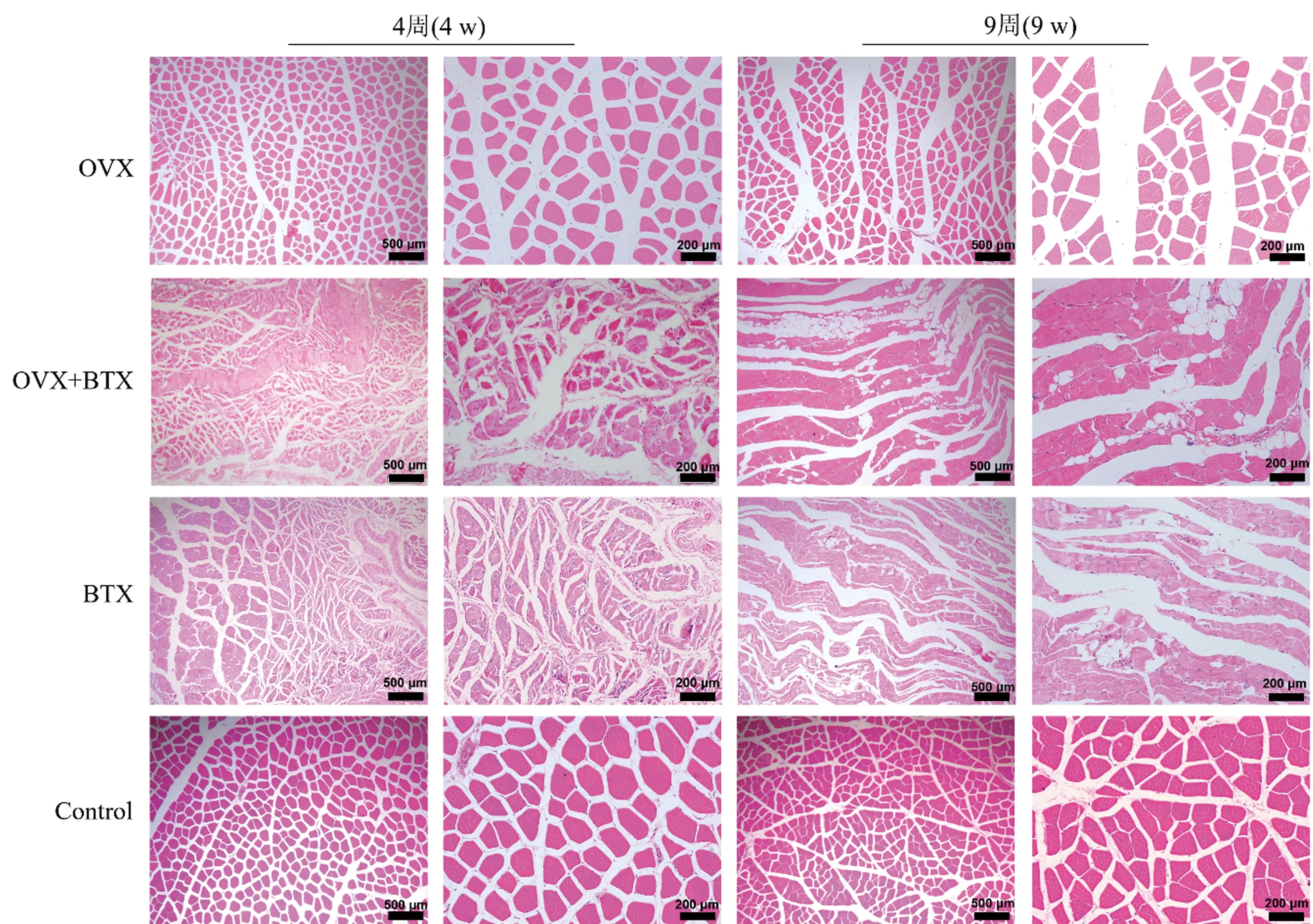
图1 各组大鼠股四头肌组织切片图
2.5 膝关节组织切片及Mankin评分
造模后第4、9周各组关节软骨切片染色如图2。各组的Mankin评分情况:OVX+BTX组和BTX组的Mankin评分[分别为(5.20 ± 0.84)、(4.60 ± 1.14)]明显大于Control组(0.60 ± 0.89),差异具有统计学意义(P=0.015、0.002,均<0.05),而与OVX组(2.80 ± 0.84)相比,差异却无统计学意义(P>0.05)。在造模后9周,各组的Mankin评分情况:OVX组为5.00 ± 0.71,OVX+BTX组为8.20 ± 1.30,BTX组为5.20 ± 0.84,Control组为0.80 ± 0.84,比较差异均具有统计学意义(P<0.05)。
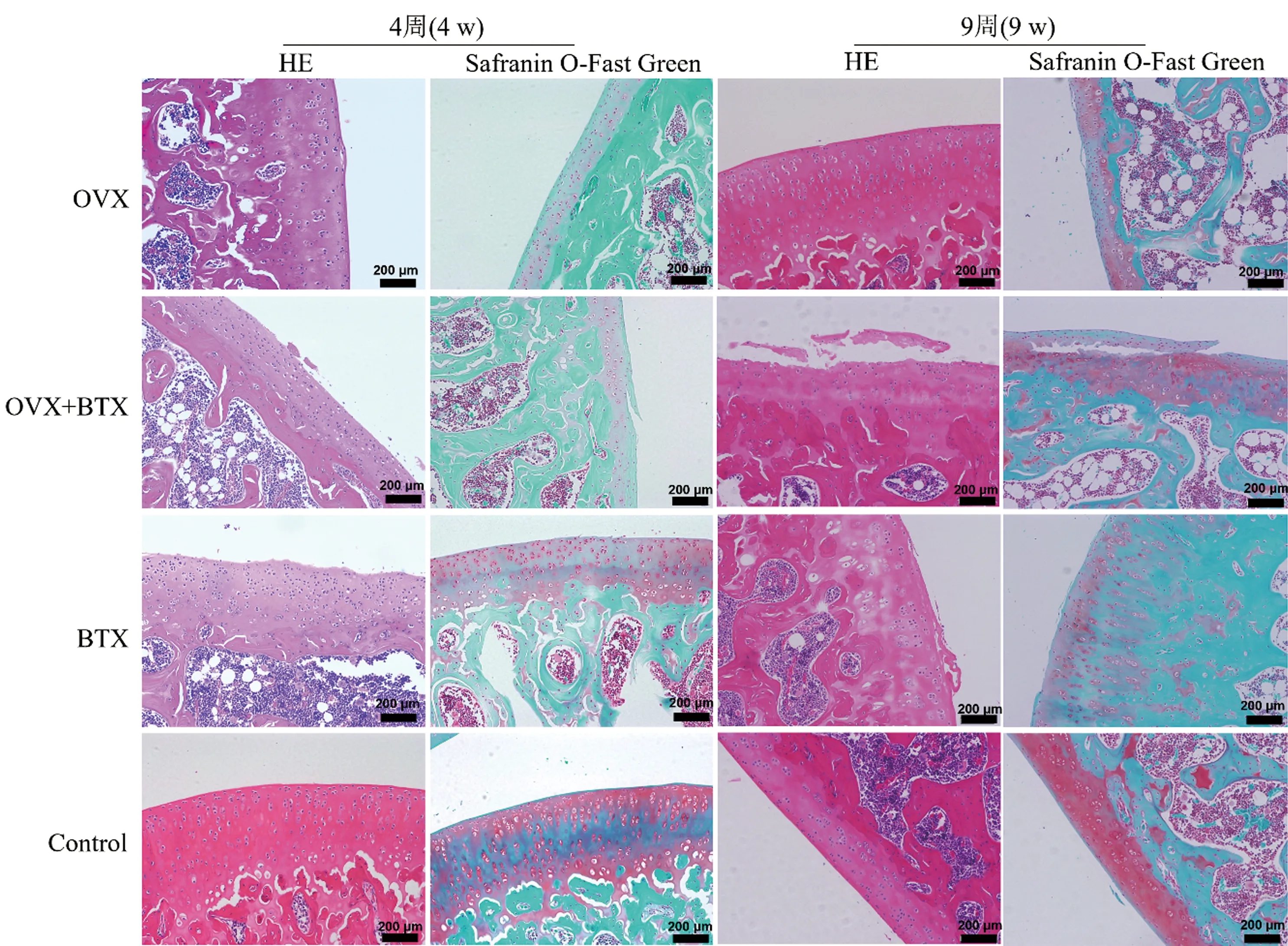
图2 各组大鼠膝关节关节软骨切片的HE和番红固绿染色图
2.6 膝关节滑膜组织切片观察及炎症评分
造模后4周,OVX组关节滑膜较无明显炎性改变,各组的滑膜评分无明显统计学差异(P>0.05)。造模后9周,模型组滑膜均出现明显炎性改变,如滑膜衬里细胞增生,层数明显增加,且滑膜组织明显纤维样改变,衬里下层出现栅栏样变化,但均为低度滑膜炎症。见图3。OVX组、OVX+BTX组和BTX组的滑膜炎性评分[分别为(3.00 ± 0.71)、(2.80 ± 0.84)、(3.20 ± 0.84)]均高于Control组(0.40 ± 0.55),比较差异有统计学意义(P均<0.05),而各模型组之间的滑膜炎性评分无显著差异(P均>0.05)。
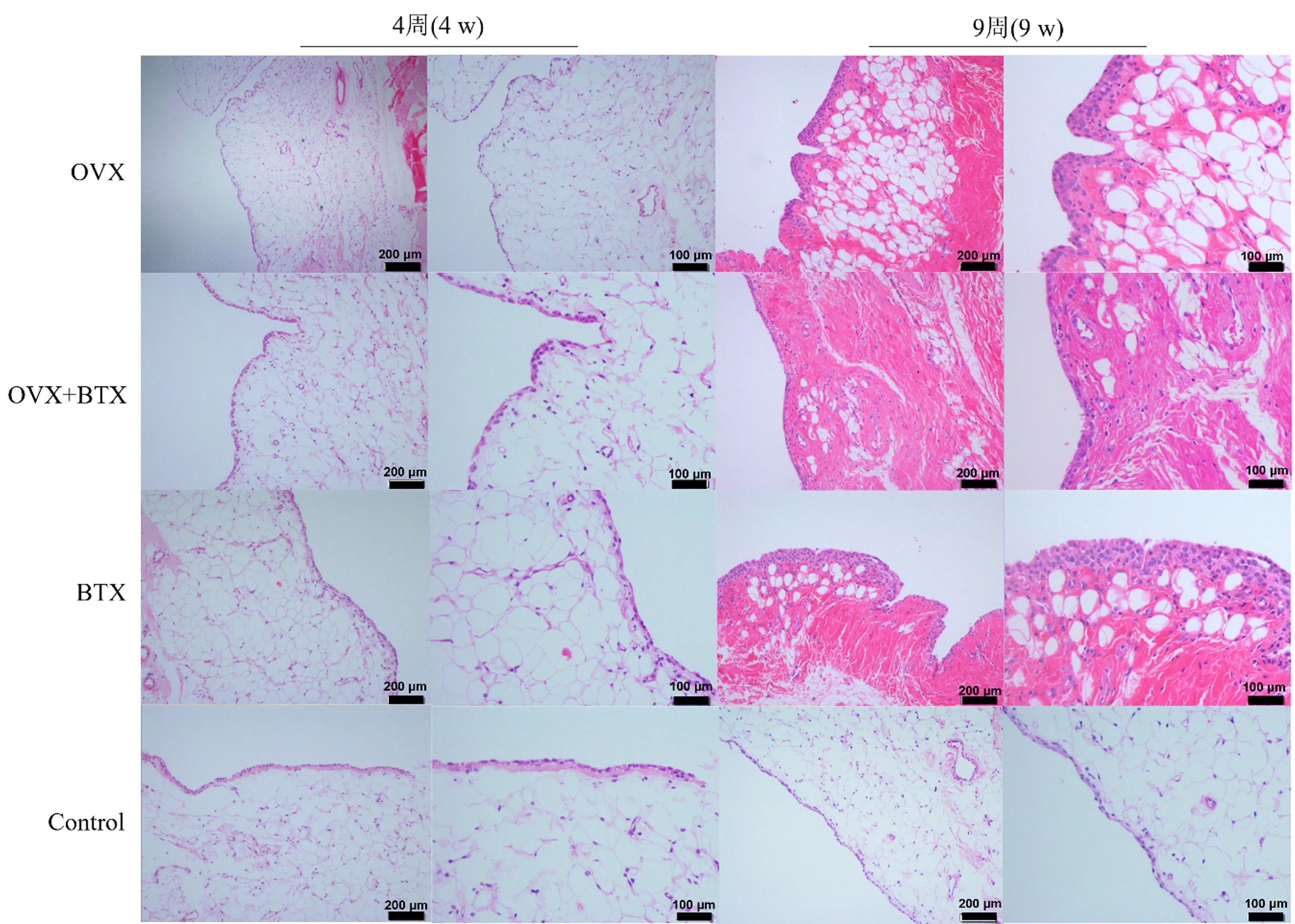
图3 各组滑膜组织切片的HE染色形态图
3 讨论
骨骼肌产生的肌动蛋白(细胞因子、肽和生长因子)在分子水平上与软骨和骨相互作用,与KOA发病密切相关[18],且肌肉具有抗炎和促软骨生成的重要作用,是影响KOA病程进展的重要因素[19]。股四头肌是膝关节主要的伸肌,股四头肌肌肉萎缩可直接影响膝关节的稳定性,引起关节软骨退化[4],增加KOA的患病风险。有实验研究也验证了肉毒素造成的股四头肌肌萎缩可导致KOA形成[11],说明肌肉与骨骼相互依存。在对伴有肌肉萎缩的KOA动物模型的干预过程中,发现单纯针对骨性变化治疗的疗效似乎不及对肌肉治疗的疗效[20]。同时大量临床研究也表明,加强股四头肌肉锻炼可明显改善KOA[21]。因此可见,改善股四头肌肌肉萎缩可能是防治KOA的关键。同时也说明在KOA的治疗过程中应重视股四头肌肌肉的修复,而进一步合理研发、改良伴有股四头肌肌肉萎缩的KOA动物模型具有重要意义。
本研究发现,采用肉毒素诱导股四肌肌肉萎缩,造模4周后膝关节软骨即出现明显破损,9周时明显加重,均以OVX+BTX组的Mankin评分最高。研究发现,肉毒素A可通过破坏生物的神经系统而形成局部神经性肌肉萎缩,KOA的肌肉萎缩主要包括废用性肌萎缩和神经源性肌萎缩,其中神经源性I型纤维萎缩约占32 %[22-23],故肉毒素A诱导的KOA形成符合KOA发病过程中肌肉萎缩的病理基础。而且在股四头肌肌注肉毒素9周后,部分肌纤维出现成脂分化,这与KOA患者股四头肌脂肪浸润尤为贴合[24]。同时,肉毒素的体外实验研究证明其对软骨细胞无明显毒副作用,膝关节内注射肉毒素A还能缓解KOA症状,这也说明KOA形成是肉毒素诱导股四头肌肌肉萎缩所致,而不是肉毒素对膝关节软骨破坏造成的[25-26]。然而,有研究发现,对雄性大鼠进行股四头肌肌注肉毒素造模8周后,膝关节软骨Mankin评分较造模后4周减小[11],这与KOA进行性加重的发病过程是不一致的。而本研究在造模9周后未见膝关节软骨Mankin评分较造模4周时减轻,这可能是由于本实验中肉毒素注射剂量较大,同时选用的雌性大鼠活动量较雄性少,股四头肌肌肉萎缩恢复相对缓慢,使得其关节软骨破坏进行性加重,Mankin评分进行性升高,这更符合KOA的发病规律。
雌激素水平的下降是导致绝经后女性KOA高发的重要原因,本研究采用肉毒素局部肌注诱导股四头肌肌肉萎缩,结合卵巢切除进行造模,以获得更贴近绝经后KOA病程变化的动物模型。卵巢切除是获得KOA大鼠模型的一种方法[27],但其造模时间长,且关节软骨破坏较轻,因此在临床应用中有一定局限性。本研究发现,在卵巢切除4周后,OVX组和OVX+BTX组的体重较Control组明显增加,在造模9周时OVX组和OVX+BTX组的体重均显著大于BTX组和Contorl组,这一结果与之前研究一致[28]。说明卵巢切除后由于雌激素缺失引起肥胖,这符合大多数绝经后女性肥胖的现象[29]。由于OVX+BTX组和BTX组在肌注肉毒素后,股四头肌发生失神经性肌萎缩,而出现右后肢明显跛行,且股四头肌肌肉萎缩诱发KOA,会导致膝关节压痛、肿胀等情况,故在造模后4周时,OVX+BTX组和BTX组的Lequesne MG评分均明显高于OVX组和Control组。随着造模时间的延长,造模后第9周时,OVX+BTX组和BTX组关节软骨破损加重,关节疼痛及肿胀随之加重,且OVX组关节软骨也发生破坏,故三个模型组的Lequesne MG评分均明显高于Control组,而OVX+BTX组Lequesne MG评分最高,说明该组大鼠KOA症状最为严重。同时,由于股四头肌肌肉萎缩导致大鼠抓力降低,故造模后第4周和第9周时OVX+BTX组大鼠四肢抓力较Control组明显降低。在排除大鼠体重和双前肢抓力对测定结果的影响后发现,造模后4周和9周时,OVX+BTX组、OVX组和BTX组大鼠的双后肢抓力体重比均小于Control组,且以OVX+BTX组最为显著。
从膝关节滑膜炎症情况来看,本研究中的三种造模方法,早期均以关节软骨退变为主,滑膜炎症并不显著。随着软骨破损的加剧、关节炎症的增加从而引发滑膜增生和滑膜炎症。同时,本研究中由肉毒素肌注联合卵巢切除建立的KOA模型,虽然很好地还原了KOA的真实病理状态,但由于叠加造模牵涉的影响因素较多,在研究KOA的发病机制及其相关干预中的应用可能会存在一定的限制。因此,在KOA相关机制的研究中,仍然需要根据实验要求选择合适的KOA动物模型。
4 结论
本研究中涉及的三种造模方法均可建立KOA模型,而通过股四头肌肌注肉毒素结合卵巢切除建立的KOA模型,则关节软骨破坏更明显,且更符合绝经后KOA肌肉和骨骼的真实病理变化,有利于进一步研究KOA发病及防治过程中肌肉和骨骼之间的关系。
