三唑环含氟芳香烃改性纳米ZnO 的制备及其在防污涂层中的应用
2023-09-12雷龙林曹黎颖汪国庆
杨 宇,雷龙林,曹黎颖,王 林,汪国庆
(1.海南大学材料科学与工程学院,南海海洋资源利用国家重点实验室,海口 570228;2.湛江宝钢新型建材科技有限公司,湛江 524000)
0 引 言
海洋生物污损被认为是微生物、藻类和动物在海水浸没结构体上的不利积累。海洋污损生物可分为微型污损生物(细菌和双原子生物膜)和大型无损生物(如大海藻、藤壶、贻贝、管虫、苔藓虫)两大类,这些生物聚集生长形成污损区[1-2],从而降低了航海效率,增加了航海成本和CO2排放量,加剧了温室效应[3-5]。防污涂层是最有效的防止海洋污损生物附着和长期防护措施。早期的防污涂层主要使用一些有毒的杀生性材料来杀死污损生物,从而达到抵御其附着的目的。这种毒害性防污涂层因污染海洋环境,给海洋生物安全和人类的健康带来风险而逐渐被淘汰[6]。
有机/无机复合涂层因其对海洋环境的影响较小而在海洋防污中受到广泛关注。利用改性纳米填料来增强涂层的力学性能和防污特性是许多环境友好型涂层研发的主要手段。表面化学改性提高了纳米颗粒在涂层中的分散性能,减小了纳米颗粒间的内应力。LEE等[7]通过在纳米SiO2表面接枝硅氧烷两性离子来减少非特异性生物分子的附着。RYU 等[8]通过缩水聚合方法将拟肽类聚合物接枝在纳米TiO2表面;拟肽类聚合物本身具备的分解蛋白质的特性,可以有效地分解附着在涂层表面的蛋白质和黏液。LI等[9]将十六烷基三甲氧基硅烷接枝在纳米ZnO 表面并添加到环氧树脂中形成超疏水表面,以此来增强防污效果。
与其他纳米无机填料相比,纳米ZnO 具有优异的抗氧化、耐腐蚀和耐老化等性能[10-11],在光照条件下能与空气中的水和氧结合生成强氧化性的离子自由基,破坏细菌的繁殖和再生能力[12-15]。然而,纳米ZnO在涂层中的分散性差,颗粒与颗粒之间的内应力大过树脂的内聚力,从而影响到所制备涂层的抗菌性能。三唑类化合物具有高活性、低毒性等特点,在生物制药领域得到广泛应用[16-19],该化合物主要作用于细菌的胞壁质,通过抑制羊毛甾醇C-14去甲基酶来抑制麦角甾醇的生物合成,从而达到杀菌的效果。目前尚未见三唑类化合物在海洋防污方面的应用研究报道。为了改善纳米ZnO 的分散性和抗菌性能,作者以纳米ZnO表面的缺陷为活性位点,采用三唑环基含氟芳香烃来改性纳米ZnO(ZnO-sTRF),利用氟元素的强电负性、类氢模拟效应[20-21]以及三唑环基的杀菌机制,获得一种轻质型纳米抗菌填料,研究了反应温度和催化剂对ZnOs TRF化学结构和元素组成的影响;将表面接枝量最高的ZnO-sTRF与聚氨酯树脂(PU)复合,研究了所制备ZnO-sTRF/PU 涂层的疏水性能、抗菌性能以及防污性能,并与纯PU 涂层、ZnO/PU 涂层、3-氨丙基三乙氧基硅烷改性ZnO(ZnO-s)/PU 涂层进行对比,以期为海洋防护用新型防污涂层的研制与开发提供试验指导。
1 试样制备与试验方法
试验原料包括纳米ZnO(平均粒径30 nm,分析纯)、三乙胺(TEA,分析纯)、4-(三氟甲基)苄溴(TBB,分析纯)、叠氮三甲基硅烷(TMSA,分析纯)、3-氨丙基三乙氧基硅烷(KH550,分析纯)、3-溴丙炔(PBE,分析纯)、溴化亚铜(CuBr,分析纯)、五甲基二乙烯三胺(PMDETA,分析纯),均由上海麦克林生化科技有限公司提供;五水合硫酸铜(CuSO4·5H2O,分析纯),由广东光华科技股份有限公司提供;L-抗坏血酸钠(NaAce,分析纯),由成都西亚化工股份有限公司提供;无水乙醇(分析纯)、四氢呋喃(THF,分析纯),由西陇科学股份有限公司提供;脂肪族聚氨酯树脂(PU,T608)、高强度环氧底漆(H541),由上海暄洋化工材料有限公司提供;活死细胞荧光染色剂LIVE/DEAD BacLightTMBacterial Viability Kits L7012,由赛默飞世尔科技(中国)有限公司提供;大肠杆菌(escherichia coli)、金黄色葡萄球菌(staphylococcus aureus)、假交替单胞菌(Pseudoalteromonas),由海南大学国家重点实验室提供。
通过KH550硅烷偶联剂对纳米ZnO表面进行预处理。在室温下将6 g ZnO粉体加入由体积比为3∶7的乙醇和去离子水组成的混合溶液中,然后置于容量为250 mL的烧瓶中以600 r·min-1的速度搅拌20 min。同时,将配制的质量分数0.8%的KH550溶液滴加入烧瓶中,反应4.5 h。反应完成后,使用容量为20 mL的离心管以8 000 r·min-1的转速离心10 min,所得离心产物用乙醇清洗过滤3次,然后放入40℃的真空干燥箱中干燥5 h,从而得到KH550改性纳米ZnO(ZnO-s)。在冰水浴条件下,取3 g ZnO-s分散于由体积比为7∶3的THF和去离子水组成的混溶剂中,取1.2 g PBE滴加入该悬浊液中,然后称取一定量的催化剂溶于悬浊液中,磁力搅拌20 min。加入2.7 g TMSA,升温至适当温度,反应5 h后,加入1.5 g TBB和1.1 mol TEA,反应2.5 h后冷却降温,淬灭反应。将产物离心过滤,用THF洗涤3次,放入40℃的真空干燥箱内干燥5 h,得到产物1,2,3-三唑环基含氟芳香烃改性纳米ZnO(ZnO-sTRF)。具体的催化剂和反应温度如表1所示。
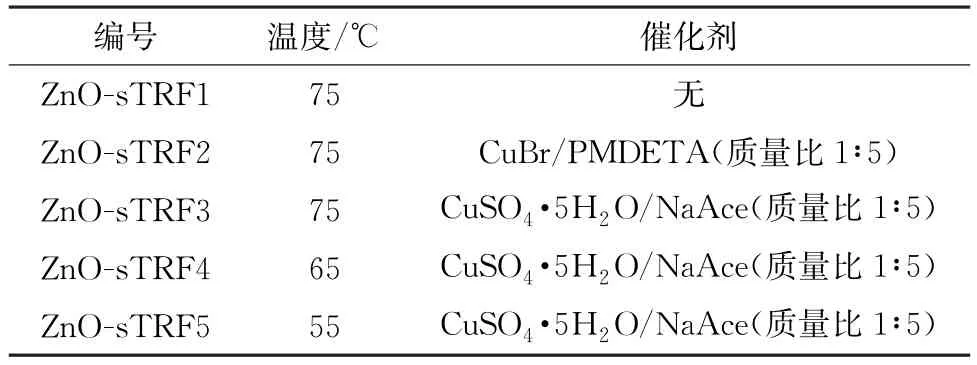
表1 制备ZnO-sTRF的反应温度及催化剂Table 1 Reaction temperature and catalyst for preparation of ZnO-sTRF
将质量均为4 g的ZnO、ZnO-s、ZnO-sTRF分别加入到40 g的PU 中,使用HM200D 型混合消泡机在室温下高速混合3 min,得到ZnO/PU、ZnOs/PU 和ZnO-sTRF/PU 涂料,将涂料涂敷在已经涂完环氧底漆的不锈钢板上制备相应的涂层。空白对照组为PU 涂层。
采用Axis Supra型X 射线光电子能谱(XPS)仪对ZnO、ZnO-s、ZnO-sTRF试样的表面化学结构和元素组成进行表征。将制备的试样与溴化钾以质量比1∶10的比例混合研磨并压成圆片状,采用DF-101Z型傅立叶变换红外光谱仪(FT-IR)对表面化学结构进行表征,分辨率为1.0 cm-1,信噪比为30 000∶1。通过SDC-100H 型水接触角测试仪对涂层表面的疏水性进行评估,每个涂层表面测5~10个点取平均值。将大肠杆菌、金黄色葡萄球菌和假交替单胞菌置于37℃的模拟海水运动的恒温细菌培养摇床中以200 r·s-1的转速培养12 h,达到108CFU·mL-1的菌落浓度;所有用于测试的工具都在121℃的灭菌锅中放置1.5 h,然后将灭菌后的测试工具和涂层均放置于紫外灯下过夜。将不同涂料施涂在面积为1 cm2的玻璃片上,放入大肠杆菌、金黄色葡萄球菌和假交替单胞菌含量均为106CFU·L-1的培养基内,再置于模拟动态海洋环境的恒温摇床中进行48 h的培养;培养结束后使用荧光染色剂进行染色,在DM5000B型正置荧光显微镜下观察涂层抗菌情况,并使用ImageJ软件定量分析菌数。按照GB/T 5370-2007在海南省海口市秀英区司南码头进行了实际海水挂片浸没试验,试验时间为120 d。试验结束后检查涂层的污损情况,拍摄照片并记录污损生物品种。
2 试验结果与讨论
2.1 ZnO-sTRF的化学结构和元素组成
由图1 可以看出,ZnO-sTRF1、ZnO-sTRF2、ZnO-sTRF3试样均在1 554,1 460,1 224,1 052,792 cm-1处存在三唑环基的特征峰[22],表明所有改性纳米ZnO表面都生成了三唑环。ZnO-sTRF1试样在2 077 cm-1处出现了炔基的特征峰,这可能是由于在无催化剂条件下叠氮炔环反应不完全,合成反应的转化效率不高导致的。在SHARPLESS和FOKIN 率先提出Cu+催化叠氮炔环反应[23-25]前,无催化剂条件下制备三唑环时的反应温度高,叠氮基团活性太强,容易引发安全事故。CuBr/PMDETA 催化体系下制得的ZnOsTRF2试样表面也存在炔基的红外振动峰,可能是因为在试验条件下,催化剂中的Cu+遇空气易氧化成Cu2+,难以全部发挥其催化作用,导致反应不完全。当催化剂是CuSO4·5H2O/NaAce时,NaAce的氧化还原作用使Cu2+还原成Cu+参与铜炔络合物的合成,完成点击化学反应,该体系在常温常压下也能正常进行反应;此时试样表面炔基的红外振动特征峰消失,说明该条件下叠氮炔环反应完全,ZnO-sTRF表面叠氮炔环转化率高。在CuSO4·5H2O/NaAce催化体系下,ZnO-sTRF4(反应温度65℃)、ZnO-sTRF5(反应温度55℃)试样在2 077 cm-1处存在振动伸缩峰,表明试样中有炔基残留,其叠氮炔环反应不完全。这是因为温度的升高会提高化合物分子反应的活性以及铜炔离子络合物形成的效率,从而促进叠氮炔环的完全反应。
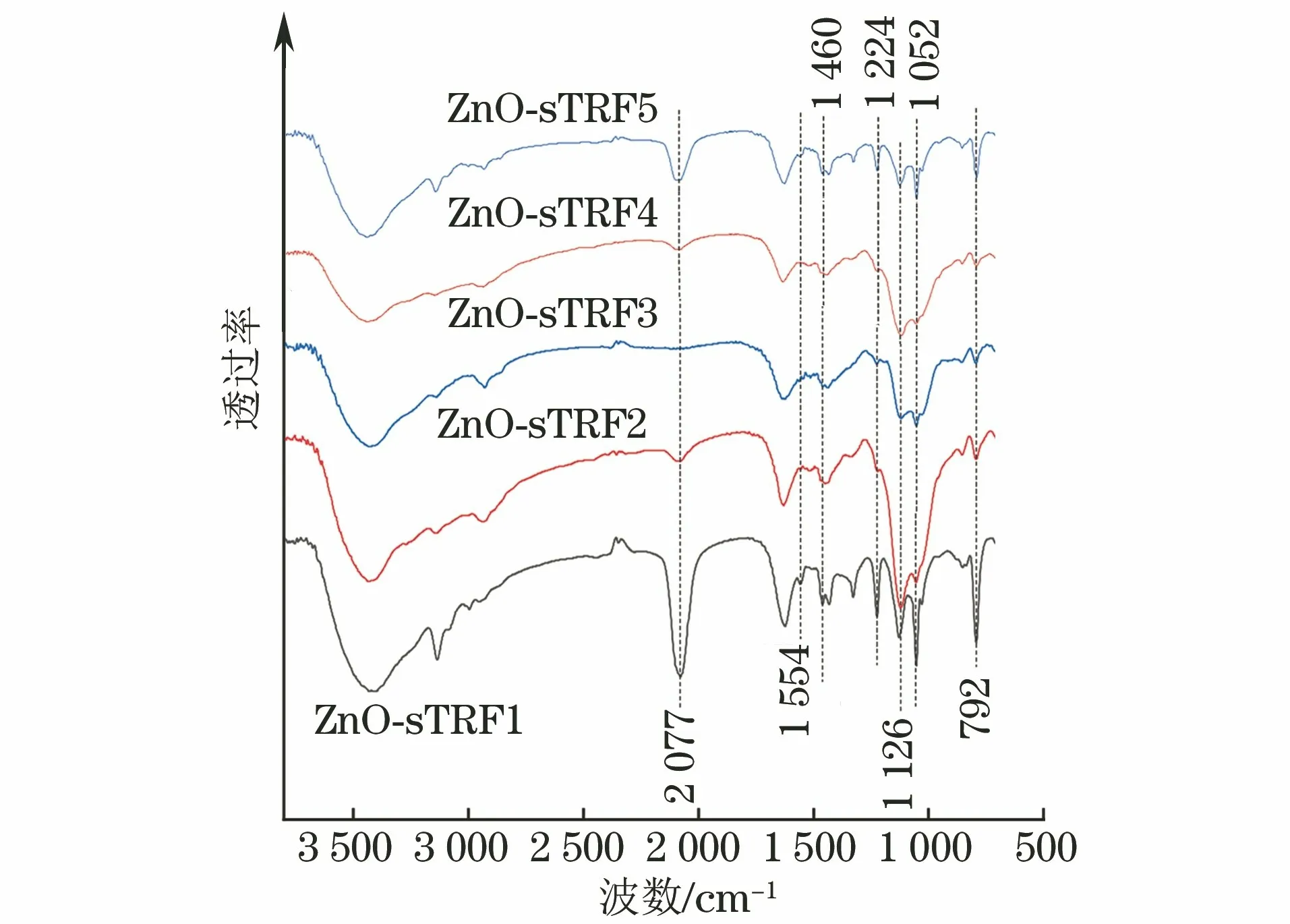
图1 不同ZnO-sTRF试样的红外光谱Fig.1 Infrared spectra of different ZnO-sTRF samples
由表2可知,ZnO-s TRF3试样表面碳元素、氮元素和氟元素的含量最高,再次证明了在反应温度为75℃,催化剂为CuSO4·5H2O/NaAce条件下,叠氮炔环反应转化效率最高,改性纳米ZnO 表面接枝量最高。
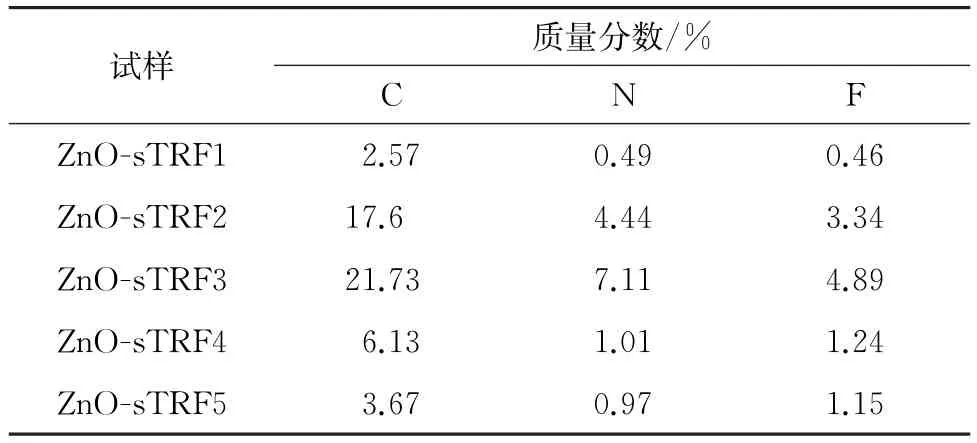
表2 不同ZnO-sTRF试样的表面元素定量分析结果Table 2 Quantitative analysis results of surface elements of different ZnO-sTRF samples
由图2可以看出,ZnO 试样不存在氮元素的信号峰,ZnO-s试样出现-NH2(399.5 eV)的信号峰。这是因为KH550硅烷偶联剂通过甲氧基水解与纳米ZnO 表面的-OH 脱水键合,使伯胺基覆盖于ZnO表面。PBE加入反应后,与ZnO-s表面伯胺基发生卤代反应生成C-NH-C(399.1 eV),端炔基同游离在溶剂中的叠氮基团键合生成三唑环结构,ZnO-sTRF3试样中出现的-N=(398.3 eV)和CN(397.9 eV)信号峰证明了三唑环结构的存在。通过氟元素的分峰拟合图对比可知,ZnO-sTRF3试样在686.5 eV处出现-CF3信号峰,证明纳米ZnO表面接枝上了含氟芳香烃。

图2 ZnO、ZnO-s和ZnO-sTRF3试样中氮元素和氟元素的XPS分峰拟合图Fig.2 XPS fitting peak diagrams of N(a-c)and F(d-f)elements in ZnO (a,d),ZnO-s( b,e),and ZnO-sTRF3(c,f)samples
2.2 涂层的疏水性能
由上述试验结果可知,在75℃下采用CuSO4·5H2O/NaAce催化剂制备的ZnO-sTRF3表面接枝率最高,因此后面对采用ZnO-sTRF3制备涂层的性能进行研究。由图3可知,纯PU 涂层、ZnO/PU涂层和ZnO-s/PU涂层表面水接触角都小于90°,而ZnO-sTRF3/PU涂层表面水接触角达到了105.4°,远大于其余涂层,可见添加了ZnO-s TRF3的PU 涂层疏水性能最优。ZnO-sTRF3试样表面氟元素质量分数大于4%,其强电负性可以促进疏水表面的形成,降低涂层表面能。
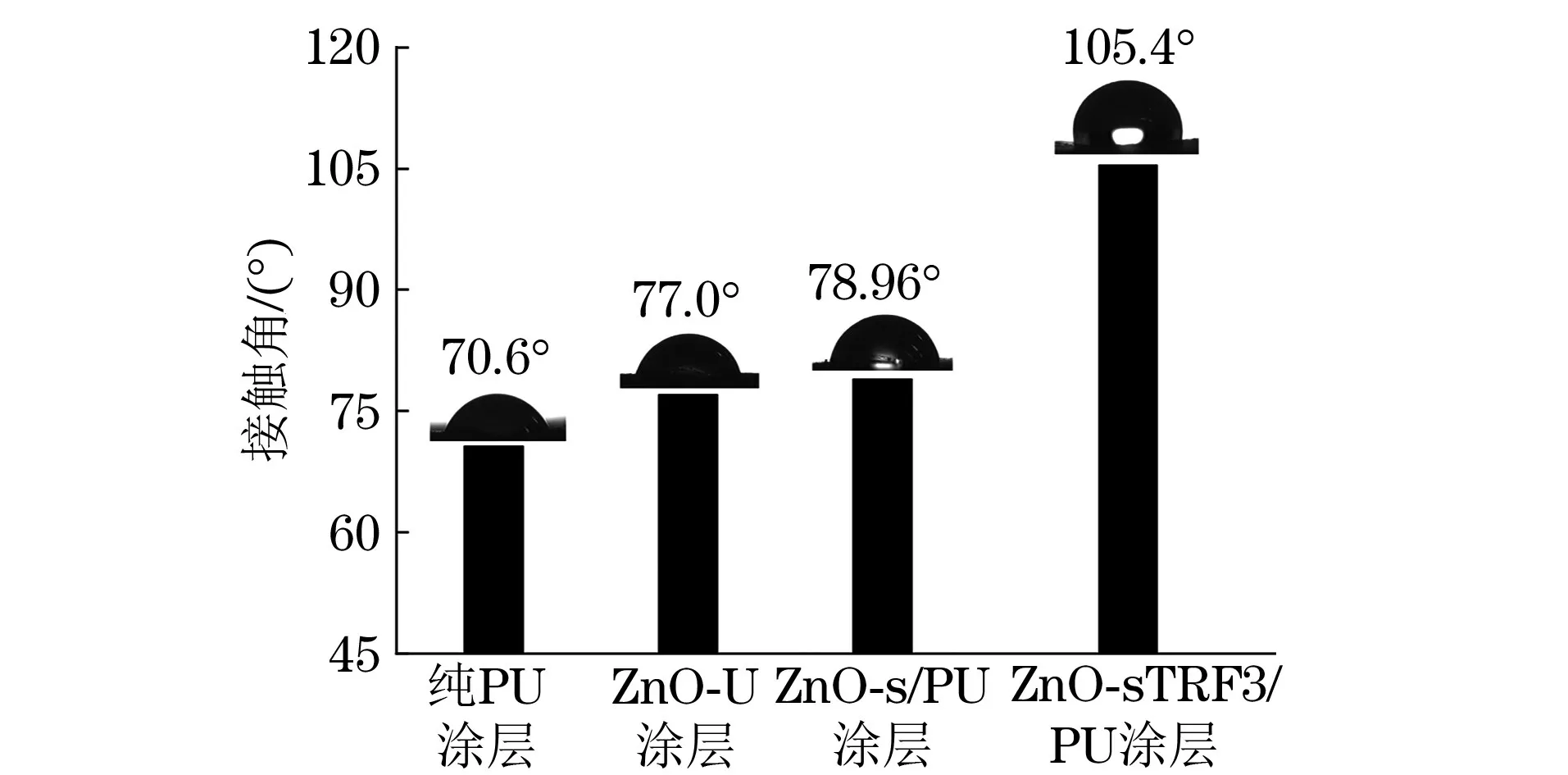
图3 不同涂层的静态水接触角Fig.3 Static water contact angles of different coatings
2.3 涂层的抗菌性能
由图4可见,纯PU 涂层表面3种细菌的死菌数量最少,活菌数量最多,ZnO/PU 涂层和ZnO-s/PU 涂层表面死菌数量高于纯PU 涂层表面,而ZnO-sTRF3/PU 涂层表面的死菌数量最多,活菌数量最少。由图5可以看出,ZnO-sTRF3/PU 涂层表面活菌面积覆盖率均少于1%,死菌面积覆盖率均高于10%,证明加入ZnO-sTRF后PU 涂层的抑菌效果优异。纯PU 涂层表面死菌面积覆盖率最小,均小于1%,当加入纯纳米ZnO后,死菌面积覆盖率稍有增加,说明涂层的抗菌能力略有提高,但纳米ZnO高表面能引起的团聚效应使其抗菌效果提升不明显。掺杂ZnO-s的涂层表面死菌面积覆盖率高于ZnO/PU 涂层,涂层的抗菌性能进一步提高,这得益于KH550硅烷偶联剂对纳米ZnO表面的修饰提高了纳米ZnO在涂层中的分散性,加大了纳米ZnO与细菌的接触面积。ZnO-s TRF3/PU 涂层的死菌面积覆盖率是其他涂层的10倍以上,可见添加了三唑环基含氟芳香烃改性后的纳米ZnO 填料后,涂层的抗菌性能得到大幅提高。ZnO 表面接枝三唑环和含氟芳香烃后,可利用三唑环作用于微生物细胞膜的抗菌机制和良好的生物相容性[26-30],同氟元素的强电负性和类氢模拟效应[31-32]相结合实现协同防污机制:一方面,三唑环对生物质膜的破坏可以彻底防止细菌的肆意繁殖;另一方面,通过氟原子的类氢模拟性能,让氟原子充当“钩子”的角色,穿透污损生物的生物质膜,同时氟元素的强电负性在其通过模拟效应进入生物质膜时,对海洋污损生物的遗传物质产生消极影响,使海洋污损生物的遗传往异常的方向发展或者阻止其繁衍。这样的一种内外双重防御机制使得ZnO-sTRF的抗菌性能相较于纯ZnO和ZnO-s大幅提高,表面死菌面积覆盖率显著增大。

图4 不同涂层表面不同细菌的荧光染色微观形貌Fig.4 Fluorescence staining micromorphology of different bacteria on different coating surfaces:(a)pure PU coating;(b)ZnO/PU coating;(c)ZnO-s/PU coating and(d)ZnO-sTRF3/PU coating
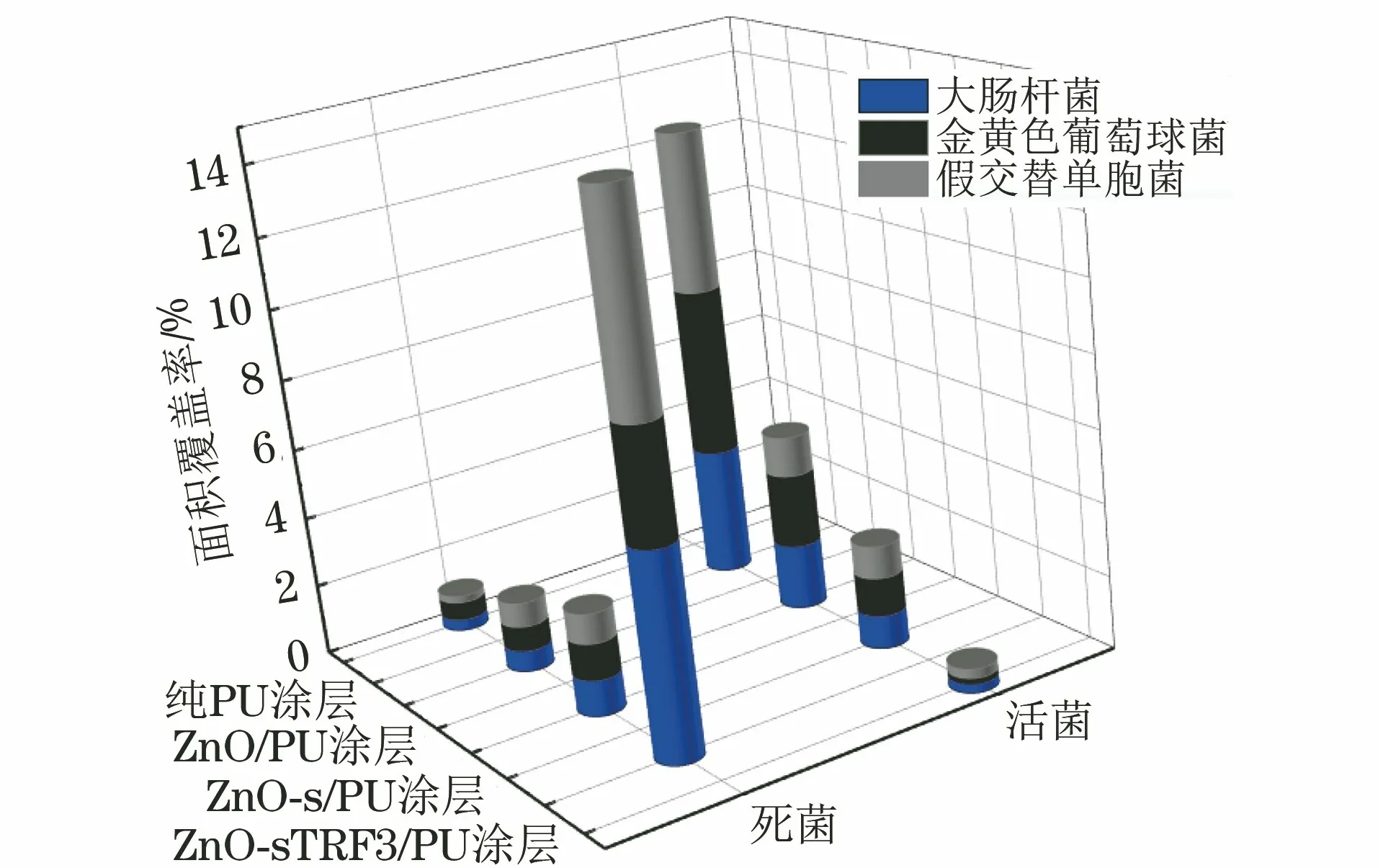
图5 统计得到不同涂层表面不同细菌的活菌和死菌面积覆盖率Fig.5 Statistic live and dead bacterial area coverage rate of different bacterium on different coating surfaces
2.4 涂层的防污性能
由图6可以看出:在实际海洋环境中浸没120 d后,纯PU 涂层表面有明显的藤壶、贻贝等海洋硬体生物附着,这表明该港口海洋环境存在着严重的生物污染;ZnO/PU 涂层和ZnO-s/PU 涂层表面也有明显的硬体生物附着迹象;ZnO-sTRF3/PU 涂层表面除了含有少量的泥沙和有机膜外,未发现其他硬体生物的附着痕迹。藤壶在基底上的附着主要依赖藤壶胶的作用,藤壶底部的外围分布有黏胶导管,黏胶导管不断地分泌藤壶胶,形成几微米的胶层将钙质底盘和附着基表面连接起来,且这些导管网络会随着藤壶的生长变得更加复杂,从而加固藤壶的附着[33-34]。掺杂ZnO-sTRF3的涂层具有低能表面,在海水剪切力的作用下具有表面自清洁的效果,从而防止藤壶胶的附着。贻贝通过足丝上的黏附蛋白实现强力附着,黏附蛋白中存在3,4-二羟基苯丙氨酸;这种物质有很强的配位能力,能与金属形成可逆的有机金属络合物[35]。而ZnO-sTRF3/PU涂层的表面能很低,其表面很难与其他物质产生键合,因此贻贝附着在该涂层表面的机会减少。虽然一些大型污损生物(藤壶、贻贝和苔藓虫等)的幼虫比较喜欢附着在疏水表面(如岩石)以增强自身的稳定性,但是在海浪冲刷的作用下,幼虫会马上脱落。同时,三唑环极易破坏附着微生物的生物质膜结构,从而阻碍软物质的培养和生长。海藻、贝壳等硬物质需要在软物质形成良好的前提下生长,ZnO-sTRF3表面三唑环和氟元素的协同防污作用破坏了软物质的生长,间接阻止了海藻、贝壳等对涂层表面的污染。

图6 在实际海洋环境中浸没120 d后不同涂层的表面形貌Fig.6 Surface morphology of different coatings after immersion in actual marine environment for 120 d:(a)pure PU coating;(b)ZnO/PU coating;(c)ZnO-s/PU coating and(d)ZnO-sTRF3/PU coating
综上可知,ZnO-sTRF3/PU 涂层良好的防污效果得益于ZnO-sTRF3表面三唑环和含氟芳香烃的协同防污机制。ZnO-sTRF3/PU 涂层较低的表面能使得海洋中的一些微生物蛋白在海水的剪切作用力下于涂层表面失去附着点,破坏生物污损附着的第一阶段(有机膜的形成);三唑环的存在破坏了微生物的生物质膜结构,与氟元素的强电负性和类氢模拟效应相协同,阻止了微生物的继续繁衍和生长。ZnO-sTRF3/PU 涂层在实际海洋环境中可以维持120 d以上的防污效果,具有良好的长期应用性。
3 结 论
(1) 当催化剂为CuSO4·5H2O/NaAce,反应温度为75℃时,ZnO-sTRF表面叠氮炔环反应完全,改性纳米ZnO表面接枝量最高,氟元素质量分数大于4%。接枝量最高的ZnO-sTRF/PU 涂层表面水接触角达到105.4°,而纯PU 涂层、ZnO/PU 涂层和ZnO-s/PU 涂层的水接触角都小于90°,ZnOsTRF/PU 涂层表现出优异的疏水特性。
(2)ZnO-sTRF/PU涂层表面的大肠杆菌、金黄色葡萄球菌和假交替单胞菌死菌面积覆盖率是其他涂层的10倍以上,这与三唑环的特殊抗菌机制以及氟元素的强电负性和类氢模拟效应相结合作用有关。
(3) 在实际海洋环境中浸没120 d后,纯PU 涂层、ZnO/PU 涂层和ZnO-s/PU 涂层表面有明显的藤壶、贻贝等海洋硬体生物附着,而ZnO-sTRF/PU涂层表面无明显硬质生物的附着,防污效果优异,这与ZnO-sTRF3表面三唑环和含氟芳香烃的协同防污机制有关。
