阳极泥中锑测定方法研究
2023-09-12关国军陈永红芦新根葛仲义
关国军,陈永红,芦新根,洪 博,葛仲义
(1.长春黄金研究院有限公司; 2.国家金银及制品质量检验检测中心(长春))
金属锑是阳极泥重要的组成部分。目前,相关标准与文献对于矿石中锑的测定方法主要有氢化物发生—原子荧光光谱法(锑品位0.010 %~0.40 %)、火焰原子吸收光谱法(锑品位0.40 %~10 %)、硫酸铈滴定法[1]3种。高品位锑采用硫酸铈滴定法测定,但砷、锑、铋之间发生的复杂化学反应影响锑的测定;含碳过高的样品在溶解过程中没有有效除碳,影响后续滴定;锑易水解,影响样品溶解与滴定;滴定过程中甲基橙指示剂的颜色突变不明显,影响滴定终点的判定。因此,本文对硫酸铈滴定法测定阳极泥中锑进行了优化实验研究,确定了最佳测定条件,取得了满意结果。
1 实验部分
1.1 试 剂
硝酸、硫酸、磷酸、盐酸、尿素、硫酸钾、过氧化氢、酒石酸。
硝酸-酒石酸混酸:称取10 g酒石酸溶于100 mL(1+3)硝酸中,混匀,备用。
(1+1)盐酸:取50 mL蒸馏水,加入50 mL盐酸,混匀。
甲基橙(5 g/L):称取0.5 g甲基橙溶于70 mL水中,用水稀释至100 mL。
亚甲基蓝(5 g/L):称取0.5 g亚甲基蓝溶于50 mL无水乙醇中,用水稀释至100 mL。
硫酸铈标准滴定溶液(0.1 mol/L):称取40.50 g四水硫酸铈,置于1 000 mL烧杯中,加入30 mL硫酸,搅拌均匀,在电热板上加热至糊状,并冒硫酸白烟约20 min,取下冷却,加入140 mL硫酸,再缓慢加入400 mL水,搅拌溶解至澄清,冷却。移入1 000 mL容量瓶中,用水稀释至刻度,混匀,备用。放置3~4 d后,采用 GB/T 7739.10—2007 《金精矿化学分析方法 第10部分:锑量的测定》,用纯锑标定。
砷锑铋溶液:称取5.000 0 g锑粒、5.000 0 g砷粒、5.000 0 g铋粒,加入40 mL王水,250 ℃溶解,待全部溶解后用20 %盐酸定容至1 000 mL容量瓶中备用。移取该溶液10 mL,当称样量为0.200 0 g时,砷、锑、铋品位均为25 %。
锑溶液:称取5.000 0 g锑粒,加入40 mL王水,250 ℃溶解,待全部溶解后用20 %盐酸定容至1 000 mL容量瓶中,备用。移取该溶液10 mL,当称样量为0.200 0 g时,锑品位为25 %。
1.2 实验方法
称取0.200 0~0.300 0 g样品于250 mL锥形瓶,用少量水润湿[2],加入2~3 g硫酸钾、50 mL水、3 mL过氧化氢、2 mL硝酸-酒石酸混酸,轻轻摇动后加入15 mL硫酸,在电热板上将水蒸干(每隔10 min轻轻晃动),蒸干水分后加盖表面皿,冒硫酸白烟计时再溶解15 min,取下冷却。如果样品含碳高,冒硫酸白烟时逐滴加入硝酸,直至样品溶解完全,取下冷却,加入1 g尿素,继续加热至溶液呈淡黄色,并冒硫酸白烟5 min,取下冷却。加入7 cm2滤纸(约1/16直径为12.5 cm滤纸),继续加热,直至溶液的暗红色消失,取下冷却至室温。缓慢加入40 mL水、40 mL(1+1)盐酸,加热至微沸(85 ℃左右),取下加入10 mL磷酸、1滴甲基橙指示剂(5 g/L),用硫酸铈标准滴定溶液滴定,临近终点,再将溶液加热至85 ℃左右,取下,加入2滴亚甲基蓝指示剂(5 g/L),继续用硫酸铈标准滴定溶液滴定至红色消失,突变为亮蓝色为终点。
锑计算公式为:
式中:w(Sb)为锑质量分数(%);c为硫酸铈标准滴定溶液浓度(mol/L);V为滴定试液消耗硫酸铈标准滴定溶液的体积(mL);V0为滴定空白消耗硫酸铈标准滴定溶液的体积(mL);m为样品质量(g);121.76为锑摩尔质量(g/mol)。
2 结果与讨论
2.1 过氧化氢用量
分别移取10 mL砷锑铋溶液,在样品溶解过程中分别加入不同量过氧化氢,并与不加入过氧化氢进行对比,实验结果见表1。

表1 过氧化氢用量对实验结果的影响
从表1可以看出:加入过氧化氢对样品进行预处理可以有效降低测定结果的相对标准偏差,原因是样品中砷、锑、铋含量高时,它们会发生一系列复杂的化学反应,影响锑的分析结果。例如:As(Ⅴ)与Sb(Ⅴ)可形成一系列不同组成与结构的砷锑酸,砷锑酸可与As(Ⅲ)、Sb(Ⅲ)、Bi(Ⅲ)进一步反应生成即使在酸性溶液中溶解度也很小的砷锑酸盐。过氧化氢具有强氧化性,尤其在酸性溶液中其氧化性要显著强于硫酸,利用过氧化氢的这一特性,破坏砷锑酸或砷锑酸盐,实现Sb(Ⅲ)完全被氧化为Sb(Ⅴ)。过氧化氢用量为3 mL时,测定结果理想且滴定终点突变明显。综上所述,为了消除样品中砷、锑、铋之间复杂的化学反应,选择在样品溶解过程中加入3 mL过氧化氢。
2.2 硝酸-酒石酸混酸用量
锑易水解,样品溶解过程中经常会出现锑水解现象,程度不一且不可控,对实验影响较大,因此选择加入硝酸-酒石酸混酸抑制锑的水解[3]。分别移取10 mL锑溶液,控制加入不同量硝酸-酒石酸混酸及不加入硝酸-酒石酸,实验结果见表2。

表2 硝酸-酒石酸混酸用量对实验结果的影响
从表2可以看出:当不加入硝酸-酒石酸混酸时,会出现锑水解现象,导致测定结果偏低。当加入硝酸-酒石酸混酸后,测定结果接近真值,且数据集中,相对标准偏差较低。实验过程中发现,当硝酸-酒石酸混酸用量过大时,样品溶解过程中会出现迸溅且溶解时间较长。综合考虑,选择样品溶解过程中加入2 mL硝酸-酒石酸混酸。
2.3 高碳处理方法
当样品中含碳过高时,样品处理不好会出现测定结果偏低的现象。实验选用3个高碳阳极泥样品,分别采用原子吸收光谱法和ICP法进行测定,平均值分别为12.36 %、25.47 %、49.89 %。实验采用3种方案处理:方案1,在样品冒硫酸白烟前加入5 mL硝酸;方案2,在样品冒硫酸白烟时逐滴加入硝酸;方案3,不加硝酸。实验结果见表3。
从表3可以看出:采用提前加入硝酸与不加硝酸处理样品时,测定结果都偏低且离散,这是由于样品含碳过高,样品溶解不完全。当冒硫酸白烟时逐滴加入硝酸,此时硝酸的强氧化性会完全溶解样品,测定结果更接近真值。综上所述,如果样品含碳高时,采用冒硫酸白烟时逐滴加入硝酸的方式处理样品。
采用硝酸除去碳后,考察了硝酸对实验是否有影响。移取10 mL锑溶液,分别加入不同量尿素及不加入尿素进行实验,结果见表4。

表4 尿素除硝酸实验结果
从表4可以看出:当溶液中有硝酸存在时,对滴定终点有影响;这是因为硝酸具有强氧化性,在此氧化还原反应中生成的既有氧化性又有还原性的亚硝酸根离子对硫酸铈滴定锑的氧化还原反应有影响。尿素可以与硝酸生成稳定的盐类,达到除去硝酸的目的,且不影响滴定终点。故采用硝酸处理高碳阳极泥样品后,需要加入1~2 g尿素除去硝酸。
2.4 指示剂
相关标准与方法中硫酸铈法滴定锑的指示剂为甲基橙,终点颜色变化为红色消失,但在实验过程中发现,对于复杂样品终点突变不明显[4]。实验采用甲基橙-亚甲基蓝双指示剂,终点颜色突变明显。分别选用5.00 mL、10.00 mL、15.00 mL、20.00 mL锑溶液,以及3个阳极泥样品(ICP法测定锑品位分别为18.88 %、23.31 %、30.56 %),考察甲基橙-亚甲基蓝双指示剂的影响,结果见表5、表6。
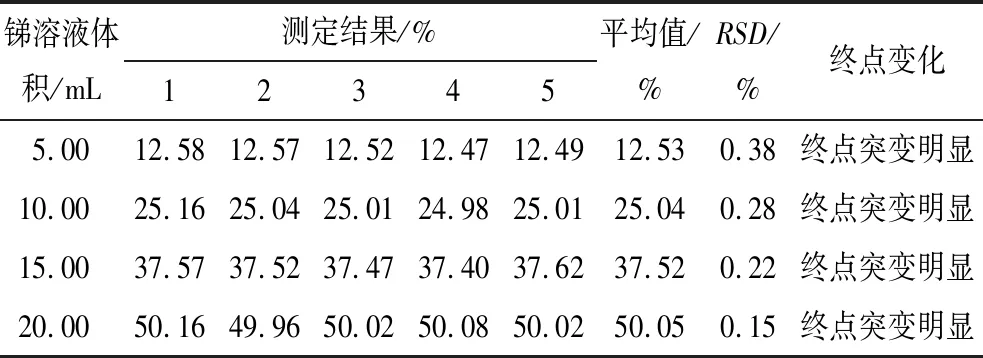
表5 锑溶液考察指示剂的实验结果

表6 阳极泥样品考察指示剂的实验结果
从表5、表6可以看出:对于锑溶液和复杂阳极泥样品,甲基橙-亚甲基蓝双指示剂显色明显,且准确度和精密度均达到满意效果,故采用甲基橙-亚甲基蓝双指示剂。
2.5 滴定温度
硫酸铈法滴定锑时,滴定温度应严格控制在80 ℃~90 ℃,但随着滴定时间的延长和硫酸铈加入量的逐渐增大,造成滴定温度不好控制[5]。实验过程中监测温度发现:煮沸时温度为98 ℃~100 ℃;硫酸铈用量为10 mL时温度为92 ℃,15 mL时温度为88 ℃,20 mL时温度为80 ℃。当滴定硫酸铈用量大于20 mL时,不能保证滴定温度在要求内。移取20 mL锑溶液,进行滴定温度考察,实验结果见表7。

表7 滴定温度对实验结果的影响
从表7可以看出:当滴定温度低于80 ℃时,反应速度较慢,终点颜色变化不明显,有延迟,测定结果偏高,且相对标准偏差较大。滴定温度为80 ℃~95 ℃时,反应速度较快,终点颜色变化明显,测定结果基本一致,相对标准偏差为0.16 %~0.27 %。因此,采用硫酸铈滴定锑的过程中,当临近终点时,需要将溶液进行二次加热,加热至85 ℃左右,保持滴定温度在80 ℃~95 ℃。
2.6 酸 度
硫酸铈滴定锑的氧化还原反应必须在盐酸介质中进行,考察了滴定过程中盐酸加入量对实验的影响。分别移取10 mL锑溶液,加入不同量(1+1)盐酸,结果见表8。
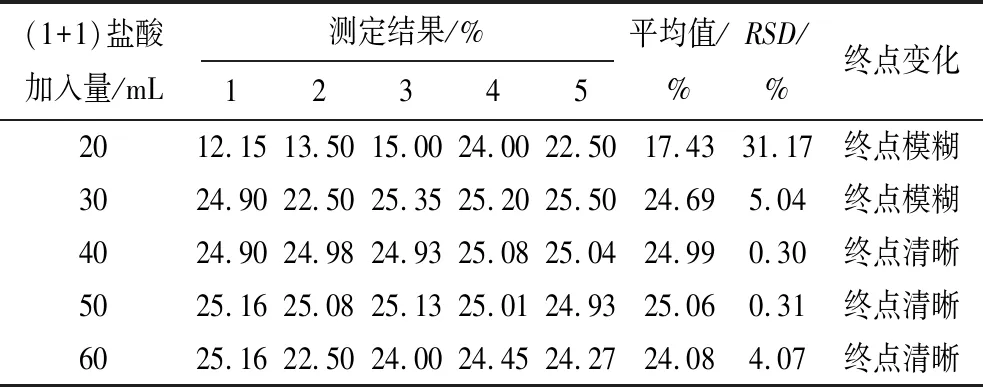
表8 盐酸加入量对实验结果的影响
从表8可以看出:当(1+1)盐酸加入量小于40 mL时,由于酸度过低,导致部分锑水解,造成测定结果偏低,相对标准偏差较大,且终点突变不明显。当(1+1)盐酸加入量为40~50 mL时,测定结果稳定,接近真值,且终点清晰。当(1+1)盐酸加入量为60 mL时,由于酸度过高,造成测定结果偏低,且相对标准偏差偏高。综上所述,当(1+1)盐酸加入量控制在40~50 mL时,可得到满意结果,但考虑到滴定过程的可操作性,确定(1+1)盐酸加入量为40 mL。
2.7 磷酸加入量
加入磷酸的作用主要是掩蔽Fe3+,因为Fe3+会消耗硫酸铈,造成结果偏高[6]。分别移取10 mL锑溶液,考察磷酸加入量为5 mL、10 mL、12 mL对测定结果的影响,见表9。

表9 磷酸加入量对实验结果的影响
从表9可以看出:磷酸加入量对测定结果的影响很小。考虑实验的可操作性,磷酸加入量确定为10 mL。
2.8 还原剂滤纸加入量
滤纸在实验过程中作为还原剂,将Sb(Ⅴ)还原为Sb(Ⅲ)。分别移取10 mL锑溶液,考察还原剂滤纸加入量对锑测定结果的影响,见表10。

表10 还原剂滤纸加入量对实验结果的影响
从表10可以看出:不同滤纸加入量对滴定终点无明显影响,且测定结果的精密度都符合要求,但滤纸加入量过高会造成还原时间过长,拖慢实验速度。故滤纸加入量确定为7 cm2(约1/16直径为12.5 cm滤纸)。
2.9 发烟时间
发烟过程为硫酸将低价离子氧化为高价离子的过程,在该实验中体现为将Sb(Ⅲ)氧化为Sb(Ⅴ)。移取10 mL锑溶液,考察不同发烟时间的影响,结果见表11。

表11 发烟时间对实验结果的影响
从表11可以看出:当发烟时间过短时,样品中的Sb(Ⅲ)不能完全氧化为Sb(Ⅴ),因此造成测定结果偏低;当发烟时间过长时,硫酸除起到氧化作用,还会进一步分解为大量的二氧化硫,从而增大体系的还原气氛,影响后续滤纸的还原,造成测定结果的相对标准偏差增大。故选择发烟时间为15 min。
2.10 加标回收率实验
移取5 mL、10 mL、20 mL锑溶液,编号为1*、2*、3*,分别加入不同量锑粒,测定加标回收率,结果见表12。

表12 加标回收率实验结果
从表12可以看出,加入标准物质回收率为98.40 %~101.20 %,方法准确度良好,满足分析要求。
2.11 方法的精密度
选用5 mL、10 mL、20 mL锑溶液进行方法的精密度验证实验,结果见表13。

表13 方法的精密度实验结果
从表13可以看出,3个样品测定结果的相对标准偏差为0.16 %~0.37 %,精密度良好,满足分析要求。
3 结 语
实验确定了硫酸铈滴定法测定阳极泥中锑的最佳条件为:过氧化氢3 mL,硝酸-酒石酸混酸2 mL,甲基橙-亚甲基蓝双指示剂,滴定温度控制在80 ℃~95 ℃,(1+1)盐酸40 mL,磷酸10 mL,滤纸7 cm2(约1/16直径为12.5 cm滤纸),发烟时间15 min。当样品含碳过高时,在冒硫酸白烟时逐滴加入硝酸,之后加入1~2 g尿素除去硝酸。研究建立的方法准确度和精密度良好,适合阳极泥中锑的准确测定。
