微生物法测定婴幼儿配方乳粉中生物素含量的不确定度评定
2023-09-11张雅伦范素芳郭丽敏
赵 盼,张 瑞,张雅伦,范素芳,王 赞,郭丽敏*
(河北省食品安全重点实验室,国家市场监管重点实验室(特殊食品监管技术),特殊食品安全与健康河北省工程研究中心,河北省食品检验研究院,河北 石家庄 050227)
婴幼儿配方乳粉是在乳类中添加适量的维生素、矿物质等,用物理方法制成,供婴幼儿食用的产品[1]。生物素,又称VH、辅酶R,分子式C10H16N2O3S,是水溶性B族维生素,可合成VC,用于脂肪和蛋白质正常代谢,无法经由人工合成[2-5],它具有维持人体自然生长发育、增强机体免疫力和抵抗力、有助于脂肪代谢、预防白发和脱发、维持皮肤正常功能等作用。食品中生物素的检测[6]通常使用生物法,近年来微生物法已成为食品安全国家强制标准,是婴幼儿配方食品标准中指定的检测方法,具有检出限低[7]、精确度高等优点。生物素是植物乳杆菌生长所必需的营养素,在生物素测定培养基中,植物乳杆菌的生长与待测试样中生物素含量呈线性关系,利用这一特性,根据透光率与标准工作曲线进行比较,即可计算出试样中待测物质的含量[2-3]。
由于检测过程可能受方法、人员、样品、量器、标准物质、仪器设备及环境条件等的影响,容易造成检测结果出现分散性。对检测过程中可能存在的不确定度进行评定,以提高检测结果的准确度,避免因实验人员操作及检测方法的不足对检测结果造成影响,可得到更加真实、客观的检测结果[8-10]。本研究按照GB 5009.259—2016《食品安全国家标准 食品中生物素的测定》,采用微生物法测定婴幼儿配方乳粉中生物素含量,通过分析和评定实验中的不确定度来源,计算出测量值的扩展不确定度,为婴幼儿配方乳粉中生物素的检测结果评定提供一定的指导,同时为生物法测定其他维生素的不确定度评定提供参考。
1 材料与方法
1.1 材料与试剂
样品A、B、C是从乳粉生产企业经湿法工艺定制而成的不同生物素含量婴幼儿配方乳粉。
生物素标准品(规格100 mg/瓶,纯度99.9%)天津阿尔塔科技有限公司;生物素测定培养基(规格100 g/瓶) 北京陆桥技术股份有限公司。
1.2 仪器与设备
ME204/02电子天平 梅特勒-托利多仪器(上海)有限公司;UV-2700紫外分光光度计(精确度1 mg)日本岛津公司;MIR-254低温恒温培养箱 日本三洋公司;HVE-50自动高压灭菌器 日本Hirayama公司;AC2-4S1生物安全柜 新加坡艺思高科技有限公司。
1.3 方法
1.3.1 标准溶液配制
生物素标准储备液(100 µg/mL)、生物素标准中间液(1.0 µg/mL)、生物素标准工作液(10 ng/mL)、标准使用液(Ⅰ:0.2 ng/mL,Ⅱ:0.1 ng/mL)分别按照GB 5009.259—2016《食品安全国家标准 食品中生物素的测定》配制。
1.3.2 接种液的制备
按照GB 5009.259—2016《食品安全国家标准 食品中生物素的测定》制备。
1.3.3 样品前处理
分别称取样品A、B、C各10 份,精确至0.001 g,于250 mL锥形瓶中,加入体积分数3%硫酸溶液100 mL,121 ℃水解30 min,冷却后用10 mol/L氢氧化钠溶液调节pH值至4.5,转到250 mL容量瓶中,用自制的超纯水定容,充分混合。用滤纸过滤,弃去最初几毫升。吸取滤液5 mL,加入约20 mL水,用1 mol/L氢氧化钠溶液调节pH值为6.8,转至100 mL容量瓶中,用水定容至刻度,作为待测液备用。
1.3.4 检测过程
取4 只试管,分别加入1、2、3、4 mL试样待测液,补水至5 mL,加入5 mL生物素测定用培养基,混匀,121 ℃灭菌5 min,快速冷却至室温,在无菌操作条件(通过自动高压灭菌器灭菌,然后在生物安全柜操作)下,向每支测定管接种1 滴(约50 µL)接种液,其中标准曲线管未接种,空白和样品空白除外。(37±1) ℃恒温培养箱培养20 h,获得最大混浊度,再培养2 h透光率无明显变化[11-12]。
用紫外分光光度计测定吸光度,绘制标准曲线,测定试样中生物素含量。
1.3.5 数学模型建立
试样消化液中生物素的质量浓度用紫外分光光度计测定,试样中生物素含量按式(1)计算。
式中:X为试样中生物素的含量/(µg/100 g);ρ为试样中生物素质量浓度平均值/(ng/mL);f为样液的稀释倍数;m为称取试样质量/g;100、1 000均为换算系数。
2 结果与分析
2.1 不确定度来源分析
根据检测过程对影响生物素检测结果的各不确定度分量来源进行分析评估,不确定度的来源主要有样品重复性检测、标准物质及标准溶液配制、样品称量及稀释制备、标准曲线拟合、紫外分光光度计产生的不确定度等[7,13-16]。具体鱼骨图见图1。
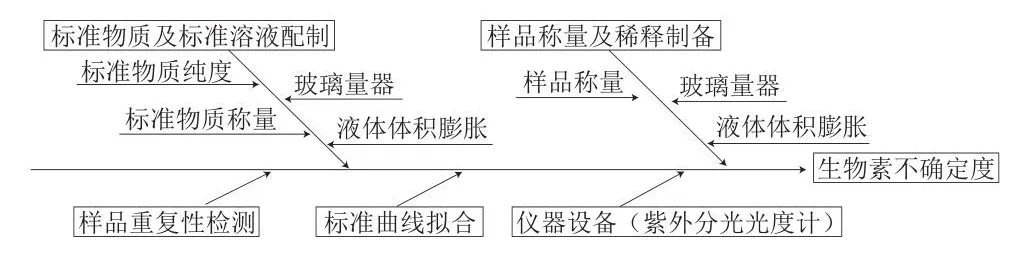
图1 婴幼儿配方乳粉中生物素检测不确定度来源Fig.1 Sources of uncertainty in the detection of biotin in infant formula
2.2 不确定度评定
2.2.1 重复性检测产生的不确定度urel(x)
样品A、B、C分别测定10 次,检测结果见表1。

表1 样品重复性检测结果Table 1 Results of sample repeatability testµg/100 g
按A类不确定度[17-20],根据贝塞尔公式(2)计算重复检测标准偏差(s),2 次重复测定产生的不确定度(u)按式(3)计算,相对标准不确定度(urel)按式(4)计算。
式中:n表示测定次数。
样品A重复检测标准偏差s(xA)=0.893 µg/100 g,重复性检测产生的不确定度u(xA)=0.632 µg/100 g,相对标准不确定度urel(xA)=0.031 8。
样品B重复检测标准偏差s(xB)=0.875 µg/100 g,重复性检测产生的不确定度u(xB)=0.618 µg/100 g,相对标准不确定度urel(xB)=0.020 4。
样品C重复检测标准偏差s(xC)=2.345 µg/100 g,重复性检测产生的不确定度u(xC)=1.658 µg/100 g,相对标准不确定度urel(xC)=0.031 2。
2.2.2 标准溶液配制产生的不确定度urel(C)
2.2.2.1 标准物质纯度产生的不确定度urel(p)
根据生物素标准品证书,其纯度为99.9%,扩展不确定度为±0.5%,包含因子k=2,取正态分布[21],则由生物素标准品纯度产生的不确定度按式(5)计算,相对标准不确定度按式(6)计算。
2.2.2.2 天平称量产生的不确定度urel(m)
用电子天平准确称取生物素标准品100.3 mg,不确定度主要来源于天平称量,电子天平检定证书给出的天平示值误差(称量范围为0~50 g)为0.3 mg,产生的不确定度为u(m1),天平重复性为0.3 mg,产生的不确定度为u(m2),取均匀分布[15,17,22],均按式(7)计算,天平称量误差产生的不确定度按式(8)计算,天平称量产生的相对不确定度按式(9)计算。
2.2.2.3 标准溶液移取、定容产生的不确定度urel(c)
生物素标准溶液移取、定容时产生的不确定度来源主要是使用的玻璃量器和液体体积膨胀[23-24]。标准溶液移取、定容使用250、500、1 000 mL容量瓶各1 次,100 mL容量瓶、1、5 mL分度吸量管各2 次,容量瓶、分度吸量管为A级,均计量检定合格,根据JJG 196—2006《玻璃仪器检定规程》查得容量允差[25],欧盟分析化学中心认为服从三角分配[26-29],由玻璃器皿容量允差产生的相对不确定度按计算,详见表2。

表2 玻璃量器产生的不确定度Table 2 Uncertainty arising from volumetric glassware
玻璃量器产生的相对标准不确定度按式(10)计算。
实验室温度变化介于(20±3) ℃,因温度效应导致的试液体积变化为±αVΔT,α为水的膨胀系数,在20 ℃时为2.1×10-4,温度差ΔT为3 ℃,V为定容体积。最大允许误差的不确定度服从矩形分布,按照B类评定,定容液体积膨胀产生的相对不确定度按式(11)计算。
全部定容液体积膨胀产生的相对标准不确定度按式(12)计算。
标准溶液移取、定容产生的不确定度按式(13)计算。
标准溶液配制产生的不确定度按式(14)计算。
2.2.3 样品称量及稀释制备产生的不确定度urel(T)
2.2.3.1 样品称量产生的不确定度urel(m)
样品称量产生的不确定度主要来源于天平称量,样品A、B、C称样量分别为2.500 4、1.500 0、1.000 4 g,天平称量误差产生的不确定度u(m)=0.244 9 mg,天平称量产生的相对不确定度urel(mA)=0.000 098,urel(mB)=0.000 163,urel(mC)=0.000 245(计算方法同2.2.2.2节)。
2.2.3.2 样品稀释制备产生的不确定度urel(V)
样品稀释制备产生的不确定度来源主要有标准溶液移取、定容使用的玻璃量器和液体体积膨胀,其中使用250、100 mL容量瓶、5 mL分度吸量管各1 次,产生的不确定度按式(15)计算(计算方法同2.2.2.3节的玻璃量器)。
温度波动±3 ℃,因温度波动液体体积膨胀产生的标准不确定度按式(16)计算。
样品稀释制备产生的相对不确定度按式(17)计算。
样品称量及稀释制备产生的相对不确定度按式(18)计算。
计算得urel(TA)=0.002 19,urel(TB)=0.002 19,urel(TC)=0.002 20。
2.2.4 标准曲线拟合产生的不确定度urel(ρ)
用100 µg/mL生物素标准溶液配制系列标准溶液,其含量分别为0.0、0.1、0.2、0.3、0.4、0.5、0.6、0.8、1.0 ng。实验采用8 个浓度水平标准溶液,得出吸光度,结果见表3。
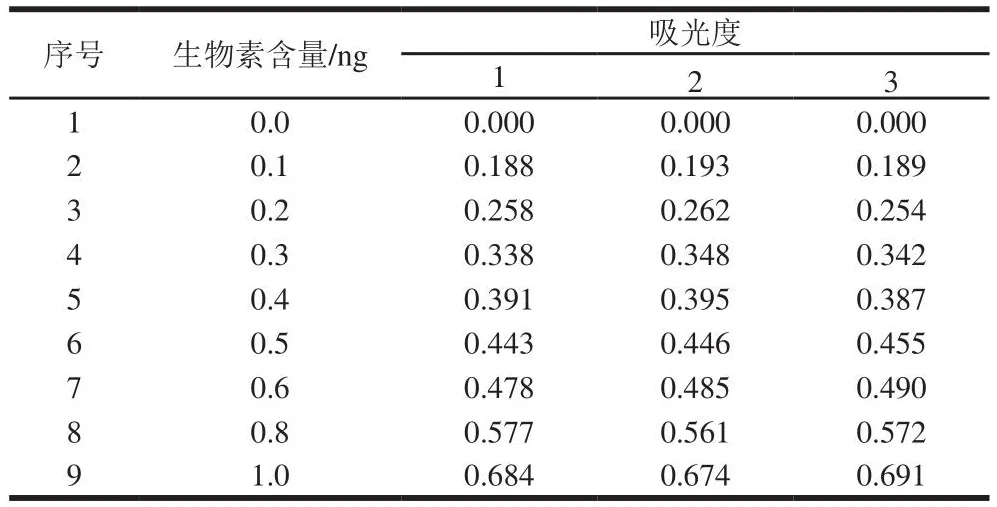
表3 生物素标准曲线数据表Table 3 Data for preparation of biotin standard curve
表3采用最小二乘法线性回归求得R2=0.987 5,斜率B1=0.527 1,截距B0=0.163 9,回归曲线方程为式(19)。标准曲线拟合的不确定度按式(20)~(22)计算。
式中:SY/C为回归曲线的强度测量标准差;B0为截距;B1为斜率;Yij为仪器测得的吸光度(生物素含量为Ci时);B0+B1Ci为按标准曲线计算的理论吸光度(生物素含量为Ci时);m为生物素含量点数;n为每个点测量次数;为标准系列管各管生物素含量的平均值/ng,Cj为标准系列管中各生物素含量/ng;Cx为样品测试系列管中生物素含量的平均值/ng;p为样品系列管测定次数[7,15,30]。
按照GB 5009.259—2016检测各试样测试管的吸光度,依据标准曲线查得各试样测试管中生物素含量,数据见表4。
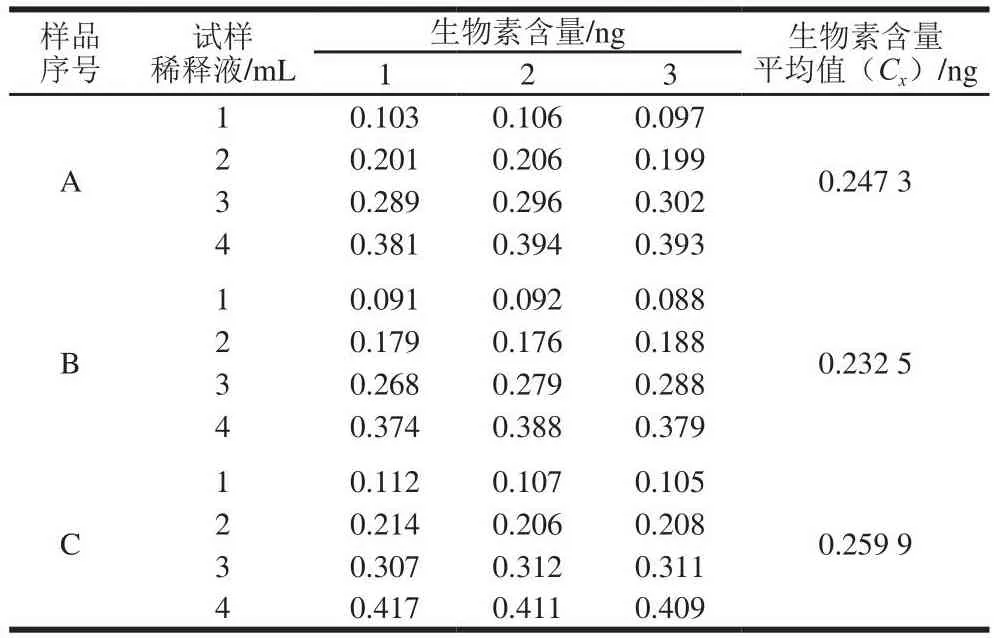
表4 试样系列管中生物素含量Table 4 Results of determination of biotin contents in dilutions of three samples
样品A标准曲线拟合的不确定度和相对不确定度分别按式(23)~(24)计算。
同理计算,样品B标准曲线拟合的不确定度u(ρB)=0.016 12 ng,相对不确定度urel(ρB)=0.069 3,样品C标准曲线拟合的不确定度u(ρC)=0.015 37 ng,相对不确定度urel(ρC)=0.059 1。
2.2.5 扩展不确定度及结果表示
根据上述各相对不确定度分量,合成相对标准不确定度urel按式(25)计算,合成标准不确定度u按式(26)计算,扩展不确定度U按式(27)计算。
计算得:urel(A)=0.071 4,urel(B)=0.072 6,urel(C)=0.067 2。
计算得:u(A)=1.418 µg/100 g,u(B)=2.203 µg/100 g,u(C)=3.573 µg/100 g。
计算得:U(A)=2.837 µg/100 g,U(B)=4.406 µg/100 g,U(C)=7.146 µg/100 g。
各相对不确定分量的贡献率见表5。
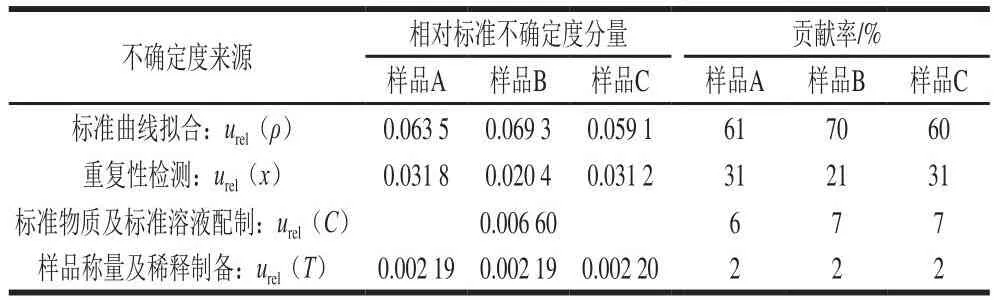
表5 相对不确定度分量的贡献率Table 5 Contribution of uncertainty components
3 结 论
通过对婴幼儿配方乳粉中生物素含量的检测结果进行不确定度评定,得出在95%置信区间内,当检测结果为19.87 µg/100 g时,扩展不确定度为2.84 µg/100 g,当检测结果为30.35 µg/100 g时,扩展不确定度为4.41 µg/100 g,当检测结果为53.15 µg/100 g时,扩展不确定度为7.15 µg/100 g。可见,随着样品中生物素含量的增高,检测结果的扩展不确定度也随之增大。在各个不确定度分量中,标准曲线拟合的影响最大,其次为重复性检测,其影响大小依次为标准曲线拟合urel(ρ)>重复性检测urel(x)>标准物质及标准溶液配制urel(C)>样品称量及稀释制备urel(T)。因此,建议在日常检验时,增加标准曲线及重复性检测的次数,提高检测技术人员的水平,以提高检测结果准确性,更好地为食品质量安全检测技术服务提供保障。
