不同贮藏期对鲜切菜山药和铁棍山药货架期品质的影响
2023-09-10赵雅琦秦占军时文林左进华袁树枝岳晓珍封碧红
田 甜,赵雅琦,王 清,秦占军,潘 媛,时文林,左进华,袁树枝,岳晓珍,封碧红,
(1.广西大学农学院,广西南宁 530004;2.北京市农林科学院农产品加工与食品营养研究所,农业农村部蔬菜产后处理重点实验室,果蔬农产品保鲜与加工北京市重点实验室,北京 100097)
山药(Dioscorea oppositaThunb.)又名土薯、山芋等,是薯蓣科、薯蓣属一年或多年生缠绕草质藤本植物的块茎部分,在我国广泛种植。山药富含多种营养物质,除多糖、蛋白质与氨基酸、金属微量元素外,还含有皂苷、多酚、尿囊素等成分[1],同时山药也是重要药材,在治疗糖尿病、抗肿瘤、保护肝肾功能、免疫调节等方面发挥着重要作用[2]。因鲜切果蔬干净新鲜、营养卫生且方便快捷,受到越来越多消费者的关注与喜爱。在鲜切加工时,山药的细胞组织结构会遭到不同程度的破坏,暴露于空气中,和氧气结合后,山药鲜切产品会发生一系列生理生化反应,导致其颜色褐变,营养物质流失,商品及食用价值丧失,货架期缩短,限制山药产业的发展[3]。
目前,关于山药鲜切产品的保鲜研究,主要有物理方法如低温贮藏[4]、涂膜包装[5]等;化学方法如1-甲基环丙烯[6]等。李佩艳等[7]发现,0.3%草酸浸泡处理能够抑制褐变关键酶活性,降低酚类物质含量,从而抑制鲜切山药褐变。马卓云[8]将鲜切山药置于冰温4、14 和25 ℃条件下贮藏发现,冰温贮藏可有效延缓鲜切山药褐变速度。低温贮藏是一种有效维持果蔬品质,延长保鲜期的方法。然而关于不同山药品种及贮藏时间对鲜切产品及其货架品质变化规律研究报道不多。
‘长山细毛山药’是中国山药之乡——山东省济宁地区传统的栽培品种,济宁栽培山药的历史悠久,栽培面积为333.3~400 hm2,年产量1 万~1.5 万t[9]。而铁棍山药是河南省温县特产,被国家质检准为“国家地理标志保护产品”,全县常年种植3.5 万亩左右,年产值在20 亿元左右[10]。因此本试验选择北方典型的两个山药品种‘长山细毛山药’菜山药及‘河南温县’铁棍山药作为试验材料,在4 ℃下贮藏0 d、30 d 和60 d,对两个品种山药进行鲜切处理,以筛选出最适合鲜切加工的山药品种及贮藏时间,为山药鲜切加工行业提供理论依据。
1 材料与方法
1.1 材料与仪器
‘长山细毛山药’菜山药 产自山东省滨州市邹平县,4 月种植,9 月收获;‘铁棍山药’ 产自河南省焦作市温县,3 月种植,11 月收获。选择大小相近、无机械损伤、无病虫害的新鲜菜山药和铁棍山药作为试验材料;浓盐酸、甲醇、冰醋酸 天津市光复科技发展有限公司;愈创木酚、磷酸氢二钠 西陇化工股份有限公司;次氯酸钠、邻苯二酚 国药集团化学试剂有限公司,上述试剂均为分析纯;芦丁(≥98%)标准品 德思特生物技术有限公司;没食子酸(≥98%)标准品 合肥博美生物科技有限责任公司;PE 保鲜塑料袋,40 cm×25 cm,厚度为0.04 mm 北京鑫雄纸塑包装材料有限公司。
LY-QCJ-GS 高速切菜机 宁波香山绿缘轻工机械制造厂;CR400 色差计 日本 Konica Minolta公司;UV-1800 紫外分光光度计 上海精密科学仪器有限公司;TGL-20M 高速台式冷冻离心机 湖南湘仪离心机仪器有限公司;F-940 便携式气体分析仪美国FELIX 公司。
1.2 实验方法
1.2.1 山药分组及鲜切加工方法 将山药贮藏于4 ℃,湿度80~85%条件下,用0.03 mm PE 膜覆盖,分别于贮藏第0 d、30 d 和60 d 进行取样鲜切处理[11]。山药切分处理前用清水洗净后去皮,用高速切菜机切成约5 mm 厚的圆片。将山药片放入浓度为0.06%的次氯酸钠溶液浸泡2 min 杀菌,用纱布擦去表面水分,然后装入0.03 mm PE 保鲜袋(长约43 cm,宽约27 cm)中,每袋放9 片,折口包装,贮藏于4 ℃,相对湿度80~85%的条件下8 d,每2 d 进行观察、测定呼吸速率、乙烯释放速率和色差等指标,并取样保存于-80 ℃冰箱。每组试验进行3 次重复。
1.2.2 褐变指数、呼吸强度和乙烯释放量的测定褐变指数(browning index,BI):用CR400 色差计测定L、a和b值,参考Palou 等[12]的计算方法如下,
呼吸强度:采用 F-940 便携式气体分析仪测定。将山药切片放入密闭呼吸室,置于4 ℃的冷库中30 min 后用仪器测定呼吸强度,每组样品重复测定3 次。
乙烯释放量测定采用气相色谱法。将约50 g 山药切片(菜山药约10 片,铁棍山药约30 片)置于500 mL的密闭容器中1 h,抽取1 mL 气体,将气体注入安捷伦7820A 气相色谱仪中,将仪器设定为载气压力及流量0.5 MPa,30 mL/min,辅助器压力、流量为氢气压力0.4 MPa,检测器室温为200 ℃;采用无分流的进样方式,1 min 后打开分流阀。
1.2.3 代谢产物的测定
1.2.3.1 总酚含量的测定 参考Hagen 等[13]的方法,根据Folin-Ciocalteu 方法测定总酚。将苯酚提取物适当稀释并与Folin-Ciocalteu 试剂混合,然后加入碳酸钠(7.5%,w/v)。将混合物在室温下放置90 min。在760 nm 波长处测吸光度,以没食子酸质量浓度为x(mg/L)、吸光度为y 制作标准曲线,得到线性回归方程y=0.938x+0.038(R2=0.9947),总酚含量单位为
mg/g。
1.2.3.2 类黄酮含量的测定 类黄酮含量的测定:参考徐冬颖等[14]的方法,用1.5 mL 水稀释0.5 mL 提取液,并加入0.5 mL 10%(w/v)氯化铝。适当混合后,加入0.1 mL 乙酸钾(1 mol/L)和2.8 mL 水。室温静置30 min 后在510 nm 波长处测吸光度,以芦丁质量浓度为x(mg/L)、吸光度为y 制作标准曲线,得到线性回归方程为y=0.0378x+0.0323(R2= 0.999),单位为mg/g。
1.2.3.3 酚类物质的测定 各酚类物质的测定:参考Xu 等[15]的方法。取3.0 g 样品,加入3 mL 的甲醇(70% ),超声处理40 min(40 kHz),在10000×g 下离心15 min。取上清液经 0.22 μm 微孔滤膜过滤,外标法进行HPLC 分析。使用YMC-C18色谱柱(250 mm×4.6 mm,5 μm)进行 HPLC 分析。进样量为20 μL,流速为0.4 mL/min,柱温25 ℃,检测波长280 nm,流动相为甲醇(A)和1%的甲酸水(B)溶液,梯度洗脱模式:0~10 min,75%~60% A;10~60 min,60%~40% A;60~65 min,40%~75% A,重复测定3 次。
1.2.3.4 木质素含量的测定 木质素的测定:参考Yin 等[16]的方法。称取2.0 g 样品,加入95%乙醇5 mL,于12000×g,4 ℃条件下离心20 min,用95%乙醇冲洗沉淀物3 次,再用乙醇-己烷(1:2,v/v)冲洗3 次,收集沉淀物,干燥过夜后溶解于1 mL 含25%冰醋酸的溴化乙酰(v/v)溶液,在70 ℃条件下温育30 min,然后加入2 mol/L 的NaOH 溶液1 mL 终止反应。加入冰醋酸2 mL 和7.5 mol/L 的盐酸羟胺,并将其置于4 ℃,12000×g 条件下离心10 min。取上清500 μL 用冰醋酸稀释10 倍,于280 nm 波长处测定吸光值,重复测定3 次。
1.2.4 酶活测定 苯丙氨酸解氨酶(Phenylalnine ammonialyase,PAL)、多酚氧化酶(Polyphenol oxidase,PPO)和过氧化物酶(Peroxidase,POD)的测定:参考徐冬颖等[14]的方法。于290 nm(PAL)、420 nm(PPO)、470 nm(POD)波长处测定吸光值,重复测定3 次。将一个PAL、PPO 活性单位U 定义为,每克样品在1 min 内吸光度增加0.01 所需的酶量。将一个POD 活性单位U 定义为,在1 min 内吸光度增加1 所需的酶量。
肉桂酸-4-羟化酶(Cinnamic acid 4-hydroxylase,C4H)和4-香豆酰辅酶A 连接酶(4-Coumaryl coA ligase,4CL)的测定:参考范存斐等[17]的方法。于340 nm(C4H)、333 nm(4CL)波长处测定吸光值,重复测定3 次。C4H、4CL 活性单位U 定义为,每克样品在1 min 内引起吸光度增加0.01 所需的酶量。
1.3 数据处理
利用软件SPSS 17.0 对本试验数据进行统计与分析,并进行显著性差异检验(P<0.05),图中数据间的差异性用不同小写字母表示;利用Origin 软件作图,试验重复3 次。
2 结果与分析
2.1 不同贮藏期对山药鲜切产品外观品质及褐变指数的影响
褐变直接影响鲜切山药的外观品质和商品价值,褐变指数反映了鲜切产品的褐变程度[18]。如图1A和图1B 示,随着鲜切山药货架期的延长,两个品种的褐变程度加重。贮藏后菜山药鲜切产品的褐变程度较低,各处理组到第6 d 为止仍具商品性;而铁棍山药鲜切产品的褐变程度较高,贮藏0 d 和贮藏30 d,有效货架期均为6 d;贮藏60 d,有效货架期为4 d。

图1 不同贮藏期对鲜切菜山药(A)和铁棍山药(B)褐变的影响Fig.1 Effects of different storage stages on browning of freshcut vegetable yam (A) and iron stick yam (B)
如图2A 和图2B 示,两个品种鲜切山药货架期的褐变指数均呈上升趋势。贮藏0 d 菜山药褐变指数显著(P<0.05)高于另两处理组,贮藏30 d 菜山药的褐变指数仅比贮藏60 d 的低4.6%,差异不显著。各处理组菜山药在鲜切山药货架期第8 d 时,褐变指数分别上升11.57%(贮藏0 d)、48.46%(贮藏30 d)和33.60%(贮藏60 d);而各处理组铁棍山药在鲜切山药货架期第8 d 时,褐变指数分别上升了62.12%(贮藏0 d)、61.01%(贮藏30 d)、45.36%(贮藏60 d),各处理组差异显著(P<0.05),表明随着贮藏期延长,菜山药鲜切产品货架期内的褐变程度较低,铁棍山药鲜切产品货架期内的褐变程度较高。此外,从两个品种的比较中可以看出,鲜切山药货架期第0 d 时两种山药的褐变指数差异不明显,鲜切山药货架期第8 d时,菜山药的褐变指数小于铁棍山药。
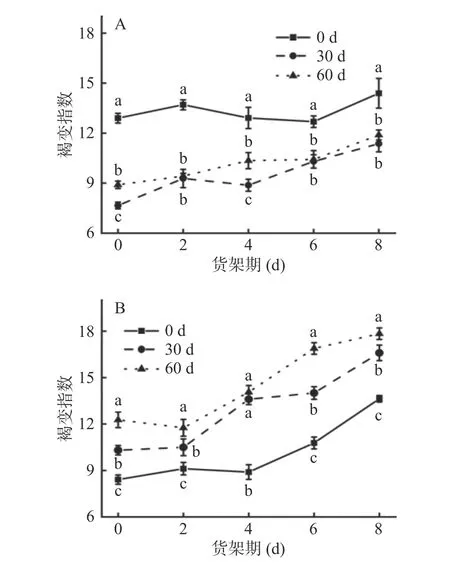
图2 不同贮藏期对鲜切菜山药(A)和铁棍山药(B)褐变指数的影响Fig.2 Effect of different storage periods on the browning index of fresh-cut vegetable yam (A) and iron stick yam (B)
2.2 不同贮藏期对山药块茎鲜切产品呼吸强度、乙烯释放量的影响
呼吸作用消耗营养物质,直接影响鲜切产品营养品质[19]。如图3A 示,贮藏0 和30 d 的菜山药鲜切山药货架初期呼吸强度大于贮藏60 d 的菜山药,随着贮藏期的延长呼吸速率呈先下降后再上升趋势,而60 d 贮藏期菜山药呼吸速率则先上升再下降,这可能是因为经过切分处理,山药细胞组织结构遭到破坏,呼吸速率加快,呈现出上升的现象,后低温贮藏抑制了呼吸,且在贮藏过程中呼吸代谢消耗,呈现出下降的现象[11]。如图3B 示,铁棍山药各处理组的呼吸速率呈先下降后上升趋势,鲜切山药货架期2~8 d,贮藏30 和60 d 的铁棍山药呼吸强度显著大于贮藏期0 d 组(P<0.05)。第8 d 货架期时,贮藏0、30 及60 d 菜山药的鲜切产品呼吸强度分别为51.94、66.01 和8.30 mg/(kg·h)。可见菜山药贮藏时间长短与其鲜切产品货架期内呼吸强度未表现出明显相关性。第8 d 货架期时,各组铁棍山药的鲜切产品呼吸强度由高到低依次为60、30 和0 d,可以推断,与菜山药不同,铁棍山药的呼吸速率随着贮藏时间的延长而增大。
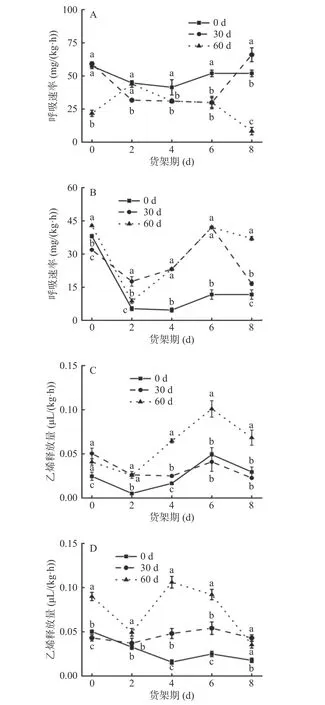
图3 不同贮藏期对鲜切菜山药(A、C)和铁棍山药(B、D)呼吸速率与乙烯释放量的影响Fig.3 Effects of different storage stages on respiration rate and ethylene release of fresh-cut vegetable yam (A, C) and iron stick yam (B, D)
果蔬受到机械损伤后,会释放大量乙烯,加速产品衰老,降低产品品质[19]。如图3C 和图3D 所示,两个品种山药的乙烯释放量均表现为先下降,再上升,然后下降的趋势,其中贮藏30 d 铁棍山药的乙烯释放量在货架期内无明显变化,贮藏60 d 各处理组表现出较高乙烯释放量且变化剧烈。货架期第8 d时,贮藏0、30 和60 d 菜山药的鲜切产品乙烯释放量分别为0.029、0.023、0.068 μL/(kg·h);铁棍山药鲜切产品各处理组乙烯释放量分别为0.017、0.043和0.035 μL/(kg·h),相较于鲜切山药货架期0 d,各处理组分别下降了64.60%、60.02%和60.71%。总体而言,经过60 d 的贮藏处理,两个品种山药的鲜切产品在货架期内生成较多乙烯,而贮藏了0 或30 d后,两个品种山药的鲜切产品乙烯释放量总体上处于一个较低水平。
2.3 不同贮藏期对鲜切山药酚类物质含量影响
在酶的催化下,酚类物质氧化生成醌,引起褐变,直接影响鲜切产品的色泽、风味、品质[20]。如图4A和图4B 所示,货架期内,各组菜山药的鲜切产品总酚含量呈先下降再上升的趋势;而各组铁棍山药鲜切产品的总酚含量总体呈上升趋势。鲜切产品货架期第8 d 时,贮藏0 d 菜山药的总酚含量最低,比贮藏30 d 和60 d 的分别低24.63%和18.33%;贮藏60 d铁棍山药的总酚含量比贮藏0 d 的高22.85%,而贮藏0 d 和贮藏30 d 的铁棍山药差异不明显。综上所述,经过一定时间的贮藏,两个品种山药在鲜切山药货架期内酚类物质含量保持较高水平,这可能是由于衰老,次生代谢物不断累积所致[3]。此外,从品种间比较可以看出,菜山药酚类物质的含量总体上低于铁棍山药。
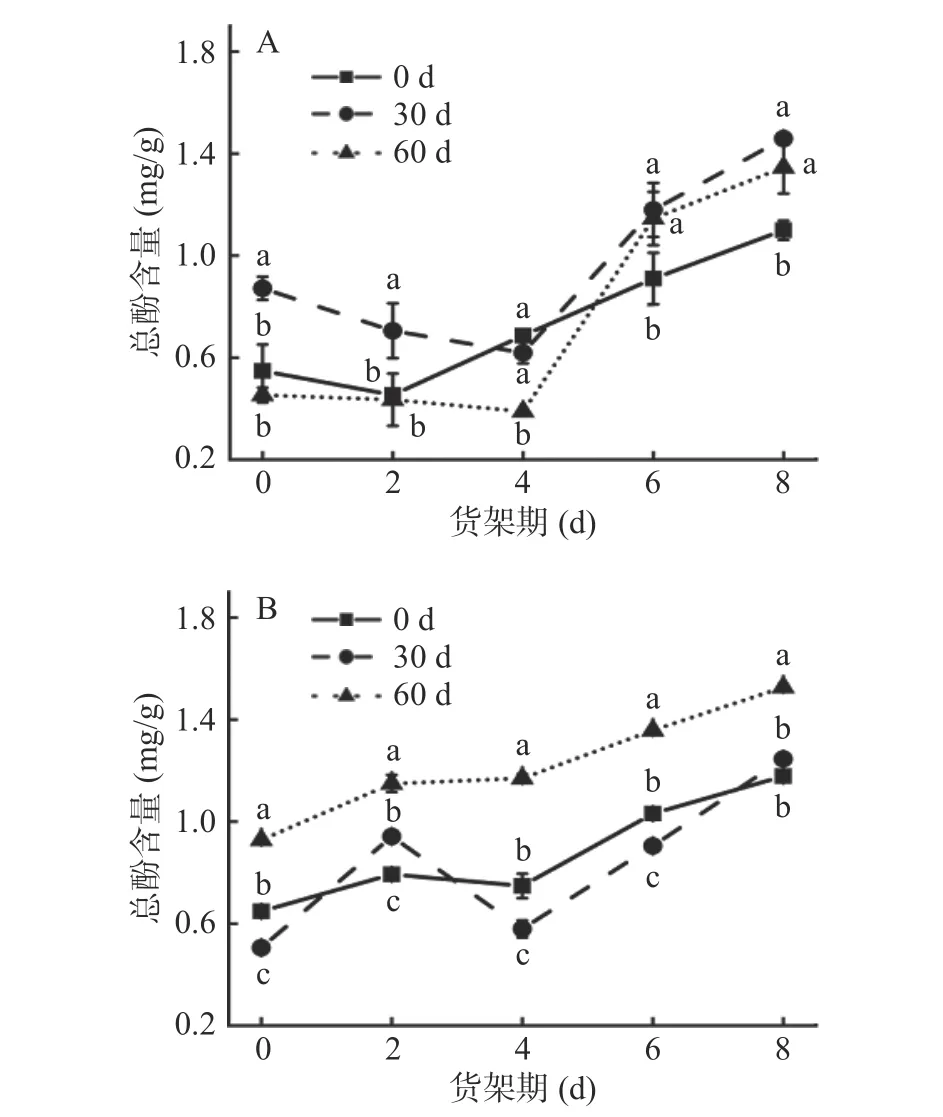
图4 不同贮藏期对鲜切菜山药(A)和铁棍山药(B)总酚含量的影响Fig.4 Effects of different storage stages on total phenolics of fresh-cut vegetable yam (A) and iron stick yam (B)
引起山药褐变的酚类物质主要是绿原酸[21]。从表1 可知,两个品种山药含量最高的酚类物质均为绿原酸,菜山药中未检测到对香豆酸。随着贮藏期的延长,在鲜切产品货架期第0 d 时,菜山药中绿原酸含量在3.992~4.042 mg/kg 之间波动,而铁棍山药中绿原酸含量的变化较大,且贮藏60 d 时,增幅为288%,显著高于菜山药(P<0.05),这也与图1 中两种山药褐变趋势相一致。此外,在鲜切产品货架期第0 d,贮藏60 d 时铁棍山药中的肉桂酸和没食子酸含量增幅分别为277%和125%,均显著高于同期的菜山药(P<0.05),且菜山药无类似的大幅增加的变化趋势,由此推测随着贮藏期的延长,铁棍山药鲜切产品中酚类物质含量变化最为明显。
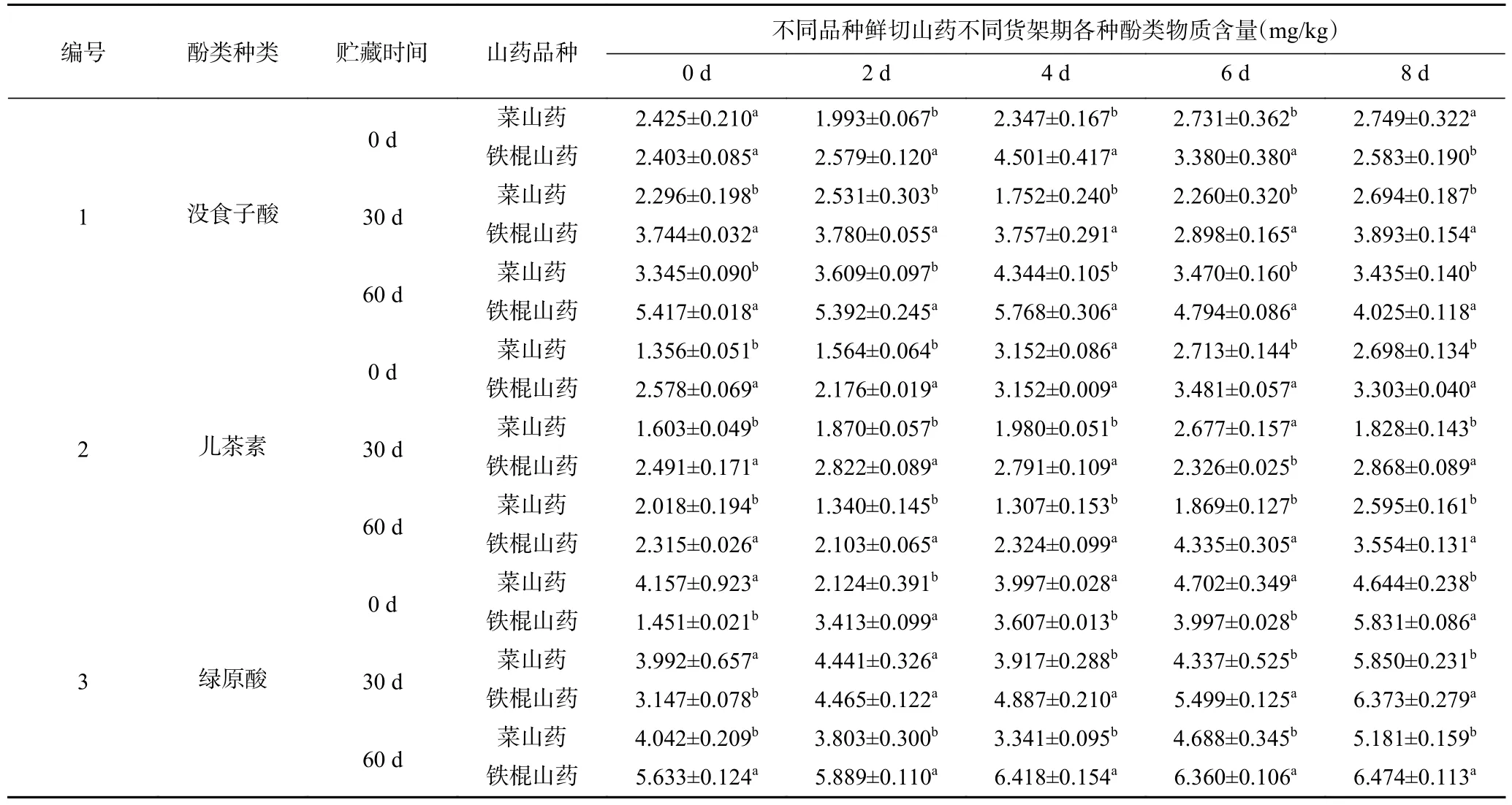
表1 不同贮藏期对鲜切菜山药和铁棍山药酚类物质含量的影响Table 1 Effects of different storage stages on phenolics content of fresh-cut vegetable yam and iron stick yam
2.4 不同贮藏期对鲜切山药类黄酮和木质素含量的影响
黄酮类物质抗氧化活性强,清除活性氧与自由基能力突出,是一种重要的次级代谢物[22]。如图5A和图5B 所示,在鲜切产品货架期内各组菜山药和铁棍山药类黄酮含量均呈上升趋势,但铁棍山药贮藏30 d 内呈现出先升高后下降再升高的趋势,可能是因为山药鲜切后,进一步生物合成用于保护作用,导致类黄酮含量上升,又由于山药中微生物发酵产生乳酸,导致pH 下降,抑制了类黄酮的合成,再次上升可能是低温诱导鲜切山药中类黄酮的积累[23]。贮藏期长短对菜山药类黄酮含量的影响不显著(P>0.05),但贮藏0 d 菜山药黄酮类物质含量略低。与菜山药不同,经60 d 贮藏处理后,铁棍山药类黄酮含量显著高于另两个处理组(P<0.05),鲜切产品货架期第8 d时,贮藏0 和30 d 铁棍山药类黄酮含量仅相差0.02 mg/g,差异不显著。可见经过一定时间的贮藏处理,两个品种山药在鲜切产品货架期内会累积较多类黄酮,且铁棍山药中类黄酮的含量高于菜山药。
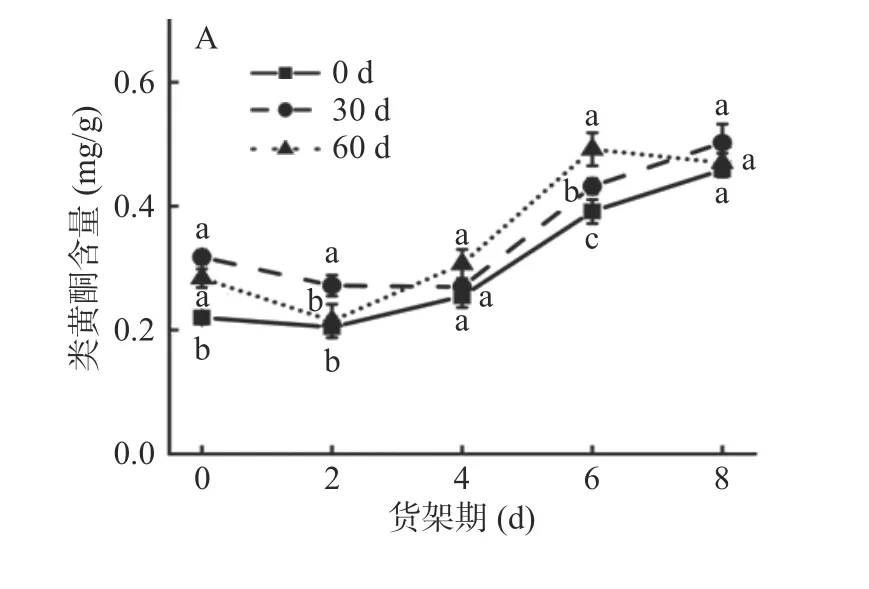
图5 不同贮藏期对鲜切菜山药(A、C)和铁棍山药(B、D)类黄酮及木质素含量的影响Fig.5 Effects of different storage stages on flavonoid and lignin contents of fresh-cut vegetable yam (A, C) and iron stick yam (B, D)
木质素在细胞壁的累积,造成产品木质化,导致产品品质下降[24]。如图5C 示,菜山药各处理组鲜切产品货架期内的木质素含量呈先上升再下降趋势,可能是因为机械损伤会诱导木质素合成,促进木质素的积累,加速组织木质化[11],后下降可能是因为在木质素生物合成过程中,PAL、POD、PPO 三个酶的活性受到了一定的抑制,抑制了木质素的合成[25]。如图5D 示,随着鲜切产品货架期的延长,铁棍山药木质素含量呈上升趋势。菜山药分别于贮藏0 d 鲜切产品货架期第6 d、贮藏30 d 和鲜切产品60 d 货架期第4 d 达到峰值。鲜切产品货架期第8 d 时,贮藏0、30 和60 d 的菜山药木质素含量分别为103.05、79.38 和73.58 mg/g,相较于峰值降了38.26%、40.06%和40.23%,贮藏0 d 菜山药木质素显著高于另两个处理组(P<0.05);鲜切产品货架期第8 d 时,贮藏60 d的铁棍山药与贮藏30 和0 d 的相比,木质素含量分别增加了41.78%和159.51%,各处理组差异显著(P<0.05)。表明随着贮藏期的延长,菜山药鲜切产品货架期木质素含量降低,铁棍山药鲜切产品货架期内木质素含量上升,木质化程度增加。
2.5 不同贮藏期对鲜切山药货架期褐变相关酶活性的影响
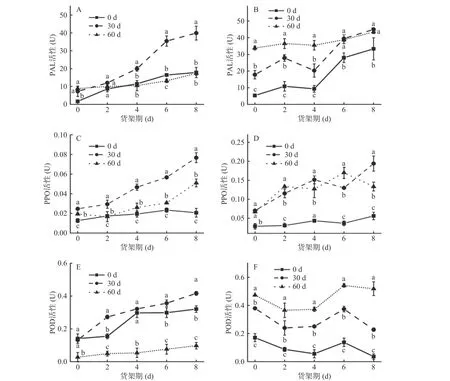
2.5.1 不同贮藏期对鲜切山药货架期PAL、PPO、POD 活性的影响 植物受到机械损伤后通过苯丙烷代谢产生酚类物质,PAL 是苯丙烷代谢过程中的关键酶[26]。PAL 将苯丙氨酸分解成反式肉桂酸和黄酮类物质。如图6A 和图6B 示,鲜切产品货架期内两个品种山药的PAL 活性均呈上升趋势,与木质素含量变化正相关。贮藏60 d 铁棍山药的鲜切产品PAL 活性维持在一个较高水平,货架期内变化不大。菜山药在鲜切产品货架期第2 d 时,各处理组的PAL 活性无显著差异。鲜切产品货架期第8 d时,贮藏30 d 的菜山药PAL 活性分别是贮藏0 d 和60 d 的2.2 和2.3 倍;铁棍山药各处理组分别是第0 d时6.25 倍、2.5 倍和1.3 倍,说明经过30 d 贮藏处理,菜山药鲜切产品在货架期的PAL 活性得到了有效提高,贮藏60 d 后的铁棍山药鲜切产品在货架期内有较高的PAL 活性,促进酚类物质的合成。
PPO 是催化山药发生酶促褐变的重要物质。如图6C 和图6D 示,两个品种山药鲜切产品货架期内PPO 活性均呈上升趋势。经60 d 贮藏后,菜山药的PPO 活性显著高于贮藏0 和30 d(P<0.05);贮藏0 d后,铁棍山药鲜切产品货架期内的PPO 活性维持在一个较低水平,整体变化不大。在鲜切产品货架期第8 d 时,菜山药各处理组的PPO 活性分别上升了0.01、0.05 和0.06 U;铁棍山药贮藏30 和60 d 的PAL 活性分别是贮藏0 d 的3.5 和2.4 倍。此外,比较两个品种可以看出,菜山药鲜切产品的PPO 活性整体上低于铁棍山药。
POD 能够和酚类物质反应,与PPO 协同作用引起褐变[27]。如图6E 示,菜山药鲜切产品货架期内POD 活性整体呈上升趋势,而铁棍山鲜切产品在货架期内POD 活性呈先下降再上升,然后下降的趋势(图6F)。贮藏60 d 的菜山药POD 活性在货架期内处于一个较低水平,鲜切产品货架期第8 d 时,各组菜山药POD 活性分别为0.32、0.42 和0.10 U,各组间差异显著(P<0.05)。鲜切产品货架期第6 d 时,铁棍山药各处理组POD 酶活性分别0.04、0.13 和0.17 U,至货架期第8 d,各处理组分别下降了74.05%、39.08%和4.21%,各处理组铁棍山药差异显著(P<0.05),可见贮藏期长短对铁棍山药POD 酶活性的影响显著。
2.5.2 不同贮藏期对山药货架期C4H、4CL 酶活性的影响 C4H 参与了木质素的合成,催化肉桂酸转化为木质素单体的前体[28]。如图7A 和图7B 所示,在鲜切产品货架期内,两个品种山药的C4H 活性总体呈上升趋势。贮藏0 d 铁棍山药的C4H 活性明显高于另两个处理组(P<0.05)。菜山药鲜切产品货架期第2 d 时,各处理组的C4H 活性无明显差异,鲜切产品货架期第2 d 后,贮藏30 d 菜山药C4H 活性开始剧烈上升,并于第6 d 达到峰值,酶活性为0.043 U,至鲜切产品货架期第8 d 时,菜山药各处理组的C4H 活性分别为0.011、0.030 和0.026 U。铁棍山药鲜切产品货架期第8 d 时,贮藏0 d 的C4H 酶活性分别是另两个处理组的1.3 倍(贮藏30 d)和1.5 倍(贮藏60 d)。表明30 d 贮藏可有效促进菜山药C4H 活性上升,0 d 未贮藏时铁棍山药鲜切产品在货架期内C4H 活性提高。
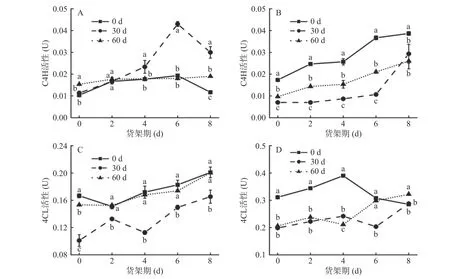
图7 不同贮藏期对鲜切菜山药(A、C)和铁棍山药(B、D)C4H、4CL 活性的影响Fig.7 Effects of different storage stages on C4H and 4CL activity of fresh-cut vegetable yam (A, C) and iron stick yam (B, D)
4CL 是木质素合成过程中的关键酶,在木质素合成过程中发挥重要作用[29]。如图7C 所示,在鲜切产品货架期内,菜山药各处理组4CL 活性呈上升趋势。如图7D 示,铁棍山药贮藏期30 和60 d 组整体呈上升趋势,而0 d 组则先上升再下降,这可能与4CL 参与苯丙烷类代谢物的生物合成有关[30]。贮藏30 d 菜山药货架期内4CL 活性显著低于另两个处理组(P<0.05),鲜切产品货架期第8 d 时,贮藏0 和60 d的菜山药4CL 活性仅相差0.00067 U。铁棍山药鲜切产品货架期第4 d 时,贮藏0 d 的4CL 酶活性达到峰值,此时铁棍山药各处理组酶活性分别为0.172、0.113 和0.168 U,至鲜切产品货架期第8 d时,贮藏0 d 的铁棍山药酶活性下降了33.99%,贮藏30 d 和60 d 的铁棍山药酶活性分别上升了28.58%和6.145%。此外,从两个品种间对比发现,菜山药的4CL 酶活性显著低于铁棍山药。
2.6 不同贮藏期鲜切山药各指标皮尔森相关性矩阵
通过对不同处理组的各项指标相关性分析发现,不同品种山药经过不同时间贮藏处理后各项指标相关性差异较大。随着贮藏时间的延长,贮藏30 d菜山药的鲜切产品褐变指数与4CL 活性、阿魏酸含量呈极显著正相关(P<0.01),与PAL、PPO、POD 活性呈显著正相关(P<0.05)(图8C);贮藏60 d 菜山药的鲜切产品褐变指数与木质素含量、4CL 活性呈极显著正相关,与PAL、PPO、POD 活性呈显著正相关(P<0.05)(图8E)。与菜山药相比,铁棍山药的变化情况不同,贮藏0 d 铁棍山药的鲜切产品褐变指数与总酚、类黄酮含量呈极显著正相关(P<0.01),与C4H、PAL、PPO 活性及绿原酸、对香豆酸含量呈显著正相关(P<0.05)(图8B),贮藏30 d 铁棍山药的鲜切产品褐变指数与PAL、PPO、POD 及肉桂酸含量呈显著正相关(P<0.05)(图8D);贮藏60 d 铁棍山药的鲜切产品褐变指数与总酚、类黄酮含量呈极显著正相关(P<0.01),与C4H、PAL、PPO 活性及绿原素、对香豆酸含量呈显著正相关(P<0.05)(图8F)。综上可知,随着贮藏时间的延长,铁棍山药中酚类物质和酶活性变化较大,且与褐变指数呈正相关;而菜山药随着贮藏时间的变化,褐变指数只与酶活性之间成正相关性。
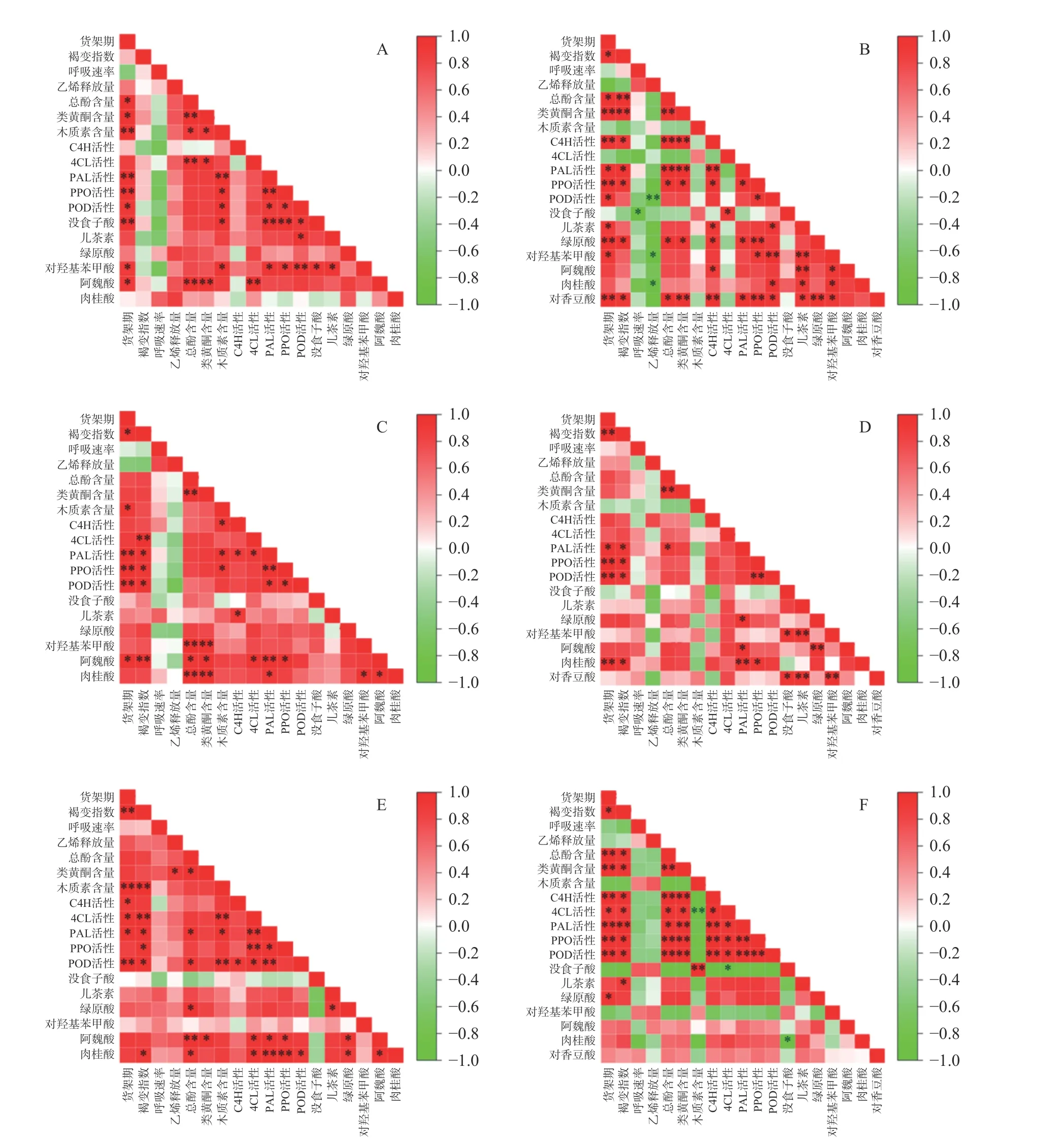
图8 菜山药(A-0 d、C-30 d、E-60 d)和铁棍山药(B-0 d、D-30 d、F-60 d)各指标皮尔森相关性矩阵Fig.8 Pearson correlation matrix of each indicator of vegetable yam (A-0 d, C-30 d, E-60 d) and iron stick yam (B-0 d, D-30 d, F-60 d)
3 讨论与结论
山药鲜切加工后色泽、质地的变化,导致营养品质下降,商品价值降低,货架期缩短[3]。本试验测定了不同贮藏期两个典型山药品种在鲜切产品8 d 货架期内的褐变程度,发现随着贮藏期的延长,菜山药鲜切产品的褐变程度较低;而贮藏后铁棍山药鲜切产品的褐变程度较高。此外,通过对比两个品种山药发现,货架前期,菜山药和铁棍山药的褐变指数差异不明显,随着货架期延长,菜山药的褐变速度低于铁棍山药,说明随着贮藏时间的延长,菜山药的鲜切产品能够在货架期内更好的维持其外观品质。
酚类物质是果蔬褐变的底物,山药因鲜切加工而受到机械损伤,酚类底物发生氧化褐变,严重影响产品品质[31]。有研究表明,引起山药发生褐变的关键酚类底物是绿原酸[21],本试验发现绿原素是山药鲜切片中含量最高的酚类物质,两个品种山药各贮藏时间的绿原酸含量均与总酚含量表现出正相关,进一步从底物角度说明山药发生褐变的原因与绿原酸关系密切,且随着贮藏时间的延长,铁棍山药中绿原酸含量的变化高于菜山药,这可能是铁棍山药褐变程度高于菜山药的原因之一。
鲜切加工导致果蔬细胞结构被破坏,诱发山药组织合成酚类物质,酚类物质发生酶促氧化是褐变现象发生的重要原因[32]。本试验测定了不同贮藏期的菜山药和铁棍山药在货架期内多种酶活性,结果表明两个品种山药鲜切产品的褐变指数与酶活性表现出较强相关性。随着贮藏时间的延长,菜山药贮藏60 d后表现出较低的褐变关键酶活性,这可能是其鲜切产品酚类物质含量变化小于铁棍山药的主要原因,从而导致其褐变程度低于铁棍山药。
综上,随着贮藏时间的延长,不同品种山药其鲜切产品褐变的程度也不同,菜山药的褐变指数较低,而铁棍山药的褐变指数则较高。鲜切铁棍山药随着贮藏期和货架期的延长,其货架期内呼吸速率、乙烯释放量、木质素含量、酚类物质、绿原酸和褐变关键酶活性均增加;然而,鲜切菜山药呼吸速率、木质素含量随贮藏期的延长而下降,褐变关键酶活性随贮藏期的延长而呈现出先升后降的趋势,酚类物质货架后期有所上升,其他指标与铁棍山药的变化规律比较一致。本研究发现菜山药鲜切产品酚类物质含量和褐变关键酶活性总体上低于铁棍山药,鲜切产品的褐变速度和严重程度低于铁棍山药,菜山药是更适合作为鲜切加工的山药品种,贮藏60 d 其鲜切产品货架期可达8 d,而铁棍山药贮藏60 d 鲜切产品货架期只有4 d。
