糖基化改性制备核桃分离蛋白-菊粉共轭物及其性质分析
2023-09-10曹诗诺沈乙杰王丰俊
陈 宇,曹诗诺,沈乙杰,李 畅,杜 建,王丰俊,
(1.北京林业大学生物科学与技术学院,林业食品加工与安全北京市重点实验室,北京 100083;2.阿克苏浙疆果业有限公司,新疆阿克苏 843000)
核桃是我国主要农产品之一,2020 年我国核桃产量达到479.59 万吨,居世界首位[1]。核桃分离蛋白(walnut protein isolate,WPI)是制备核桃油脂的副产物,但因为其溶解性较低,通常被用做生产经济价值较低的饲料、肥料和其他材料,应用非常有限[2],但是核桃分离蛋白营养价值高,具有巨大发展潜力[3]。
为了提高WPI 的溶解度,改善蛋白质的结构和功能特性,增加其加工利用度,需要对WPI 进行改性处理。常见的物理改性方法效果不明显,酶解改性利用不同类型的酶使蛋白质适度、精准水解,虽然酶法改性反应条件温和、副反应较少,但是酶法反应条件苛刻,生物酶价格较高导致经济成本较高,另外会产生令人不愉快的风味物质。化学改性操作简单效果明显,但可能会因为化学物质的添加产生新的安全问题[4],而糖基化改性不同于一般的化学改性,该反应在控制糖蛋白比例、加热温度、湿度以及反应时间等条件下即可进行,不需要添加额外的化学试剂,反应过程温和,安全性高[5-6]。糖基化主要是还原糖链上的羰基与蛋白分子上的氨基发生羰氨缩合,形成较为稳定的蛋白质-糖共轭物。糖基化改性后的蛋白质结合了天然蛋白大分子特性及多糖的亲水特性,功能特性得到明显改善[7-8]。研究表明糖基化改性可使花生蛋白[9]、豌豆蛋白[10]、苦杏仁蛋白[11]、小麦蛋白[12]、大豆蛋白[13]等蛋白质的功能特性和营养性均得到明显的改善。但目前对糖基化改性WPI 的研究较少。
本研究以WPI 为主要原料,选用具有调节肠道微生态、降血糖、降血脂等功能的菊粉[14],用糖基化改性的方法研究蛋白与糖质量比、反应温度、反应时间对WPI 溶解度的影响,通过单因素实验与响应面优化实验确定最优的核桃分离蛋白-菊粉共轭物,即菊粉改性蛋白(Inulin modified protein,IMP)的制备工艺,对糖基化改性蛋白的结构特性及功能特性进行研究,以期获得高溶解的核桃蛋白,提高WPI 的利用率,为WPI 的精深加工利用提供有力支撑。
1 材料与方法
1.1 材料与仪器
核桃分离蛋白(87%) 实验室前期实验制备[15];菊粉 食品级,上海鑫泰实业有限公司;邻苯二甲醛、考马斯亮蓝G-250、20%十二烷基硫酸钠溶剂钠、牛血清蛋白 分析纯,北京蓝弋科技有限公司;β-巯基乙醇 分析纯,北京津同乐泰化工产品有限公司;其他试剂 均为分析纯。
LGJ-12 型真空冷冻干燥机 北京松源华兴科技发展有限公司;524G 型磁力搅拌器 上海梅颖浦仪器仪表制造有限公司;GL20G-II 型冷冻离心机 上海安亭仪器有限公司;L6 型紫外可见分光光度计上海仪电分析仪器有限公司;FM-200A 型高剪切分散乳化机 上海弗鲁克科发展有限公司;VERTEX70型傅里叶红外光谱仪 德国Bruker 公司;GeminiSEM 300 型扫描电子显微镜 德国蔡司公司;FLS1000 型荧光分光光度计 英国爱丁堡仪器公司。
1.2 实验方法
1.2.1 WPI-菊粉共轭物(Inulin modified protein,IMP)的制备 称取0.5 g WPI 溶于50 mL 离子水中,于25 ℃室温下搅拌1 h,以不同比例加入一定量的菊粉混合均匀后,使用恒温磁力搅拌器,在不同的时间、温度条件下,反应结束后立即用冰浴处理,使其快速冷却至室温,使用高速冷冻离心机设置转速8000 r/min,离心时间10 min,将上清液于-4 ℃条件下置于食品级双层透析袋中(60 mm×70 mm×0.22 mm)透析24 h 后冷冻干燥制得IMP。同时以未处理的WPI 和相同条件下只加热处理的核桃分离蛋白(Heat treated walnut protein isolate,H-WPI)为对照。
1.2.2 单因素实验
1.2.2.1 不同反应温度条件下制备IMP 准确称取0.5 g WPI 溶于50 mL 去离子水中,在反应时间60 min、pH7.0、WPI 与菊粉质量比1:1 的条件下,以溶解度为指标,考察反应温度在50、60、70、80、90、100 ℃条件下对IMP 溶解度的影响。
1.2.2.2 不同反应时间条件下制备IMP 准确称取0.5 g WPI 溶于50 mL 去离子水中,在反应温度90 ℃、pH7.0、WPI 与菊粉质量比1:1 的条件下,以溶解度为指标,考察反应时间在20、40、60、80、100、120 min 条件下对IMP 溶解度的影响。
1.2.2.3 不同蛋白与糖质量比对IMP 溶解度的影响准确称取0.5 g WPI 溶于50 mL 去离子水中,在反应时间60 min、反应温度90 ℃、pH7.0 的条件下,以溶解度为指标,考察WPI 与菊粉质量比为3:1、2:1、1:1、1:2、1:3、1:4 条件下对IMP 溶解度的影响。
1.2.3 响应面试验 响应面试验因素与水平见表1。
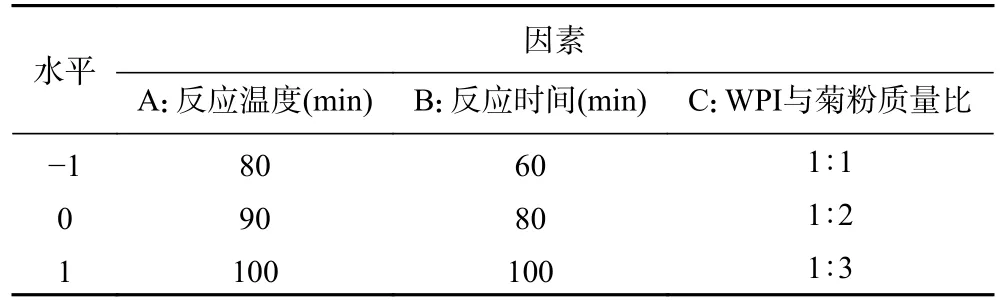
表1 响应面试验因素与水平设计Table 1 Response surface test factor level table
1.2.4 接枝度(degree of grafting,DG)的测定 按照Jiang 等[16]改进的OPA 试剂法测定,根据公式(1)计算。
式中:A0为反应前样品吸光度;A1为反应后样品吸光度。
1.2.5 褐变程度的测定 取适量IMP 样品溶于离心管中,使用高速冷冻离心机设置转速8000 r/min 离心时间10 min 除去不溶物,设定波长为420 nm,测定上清液的吸光度,以蒸馏水做空白对照。以此表示体系的褐变程度。
1.2.6 结构特性的测定
1.2.6.1 扫描电子显微镜 取适量样品直接粘到导电胶上,喷淋金45 s,喷金为10 mA。通过ZEISS Gemini SEM 300 扫描电子显微镜对镀金试样进行分析。在电子加速电压为3 kV、放大倍数为3000×时对样品进行观察,并拍摄图像。
1.2.6.2 傅里叶变换红外(FTIR)光谱 取1 mg 样品与100 mg 干燥后的KBr 混合后研磨,放入压片机上压成透明薄片,通过VERTEX 70 红外光谱仪进行测定,扫描波长4000~400 cm-1,扫描次数为32 次,分辨率为4 cm-1。
1.2.6.3 内源荧光光谱 用10 mmol/L 的pH7 的磷酸盐缓冲溶液溶解样品,制备成浓度为0.1 mg/mL的溶液。使用FLS1000 荧光分光光度计扫描样品。激发波长290 nm,扫描范围300~400 nm,狭缝宽5 nm,扫描速度200 nm/min,扫描间隔20 ms,反应时间0.1 s。
1.2.7 功能特性
1.2.7.1 溶解度的测定 采用牛血清蛋白配制标准蛋白溶液,绘制标准曲线为y=7.34x+0.1536,R²=0.9995。根据Horax 等[17]的方法稍作改动,准确称取0.1 g 冻干后的样品分散于10 mL 去离子水中,在磁力搅拌器上搅拌均匀,用盐酸溶液或氢氧化钠溶液调节溶液pH,使用高速冷冻离心机设置转速8000 r/min 离心10 min,收集上清液;取1 mL 上清液和5 mL 考马斯G-250 染液于试管中,振荡混匀,避光放置3 min 后,在波长595 nm 处测定吸光度。以同体积去离子水作为对照。按照公式(2)计算溶解度。
式中:m0为样品中蛋白质含量,mg/g;m1为上清液中蛋白质含量,mg/g。
1.2.7.2 起泡性(FC)和泡沫稳定性(FS)的测定 参考金凤[15]的测定方法,记录溶液和泡沫的总体积V1,将溶液静置30 min 后,再次读取量筒内液体和泡沫的总体积V2。按照公式(3)、(4)计算FC 和FS。
1.2.7.3 乳化性(EAI)及乳化稳定性(ESI)的测定准确称取0.30 g WPI 溶于30 mL 去离子水中,混合均匀后,参考金凤[15]的方法进行测定,按照公式(5)、(6)计算EAI 和ESI。
式中:DF为稀释因子(100);c 为样品的浓度(g/mL); Φ为光路(1 cm);θ为油相在乳液的分散系数(0.25);A0是样品在0 min 的吸光值;A10是样品在10 min 的吸光值。
1.3 数据处理
通过Design Expert 8.0.6 分析实验数据;采用Origin 8.0 软件作图。使用SPSS 20.0 软件进行方差分析,显著性差异的分析选择Duncan 法多重比较,结果表示为平均值±标准差,P<0.05 为显著性差异。实验均重复3 次,结果用平均值±标准误差表示。
2 结果与分析
2.1 单因素实验结果
2.1.1 不同反应条件对IMP 溶解度的影响 如图1a所示,随着反应温度的升高,IMP 的溶解度先上升后趋于平缓,在温度为90 ℃时达到最大溶解度82.00%。有研究表明,适度的热处理有利于蛋白质和多糖的相互结合,对WPI 的溶解性起到促进作用。但是当加热温度过高或加热时间过长有可能会使蛋白质分子内部的疏水基团暴露,结构疏水性增强,溶解度降低[18]。此外,温度过高使WPI 发生变性、聚集和沉淀,结合水的能力降低。因此,选择温度80~100 ℃进行响应面试验。
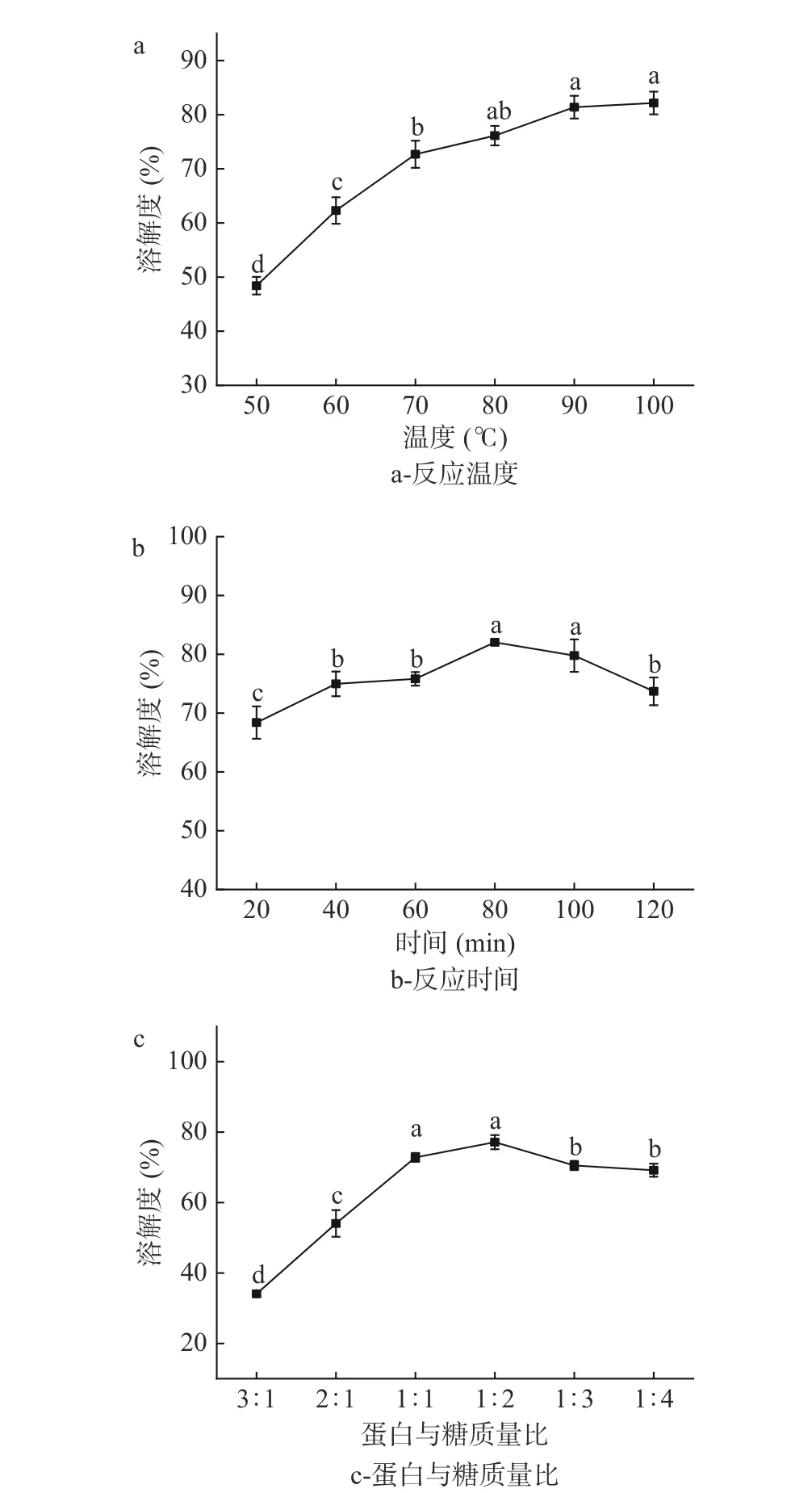
图1 反应条件对IMP 溶解度的影响Fig.1 Effect of reaction conditions on the solubility of IMP
由图1b 可知,随着反应时间的延长,IMP 的溶解度总体呈现先增加后降低的趋势,在反应时间为80 min 时溶解度达到最高值81.00%。随着反应时间的继续增加,原本断裂的肽键重新聚合,蛋白的疏水基团变多,不溶于水的大分子聚合物增多,从而导致溶解度下降[19]。因此,选择反应时间为60~100 min进行响应面试验。
由图1c 可知,随着菊粉占比增加,IMP 的溶解度先上升后降低,这是由于随着菊粉浓度的不断提高,多糖提供的反应位点逐渐变多,蛋白与多糖碰撞结合的可能性逐渐变大,在WPI 与菊粉质量比为1:2 时,溶解度达到最大值79.00%。菊粉比例增加过多时,溶液黏度不断增强,反而不利于糖基化反应的发生,这与王棋等[20]的研究结果一致。因此,选择WPI 与菊粉质量比为1:1、1:2、1:3 进行响应面试验。
2.2 响应面试验结果
2.2.1 方差分析 利用Design-Expert 8.0 软件的中心组合设计,以A、B、C 为响应变量,IMP 溶解度为响应值,开展响应面试验,试验结果和回归分析分别见表2、表3。得到回归方程为:

表2 响应面试验方案及结果Table 2 Design of response surface test scheme and results
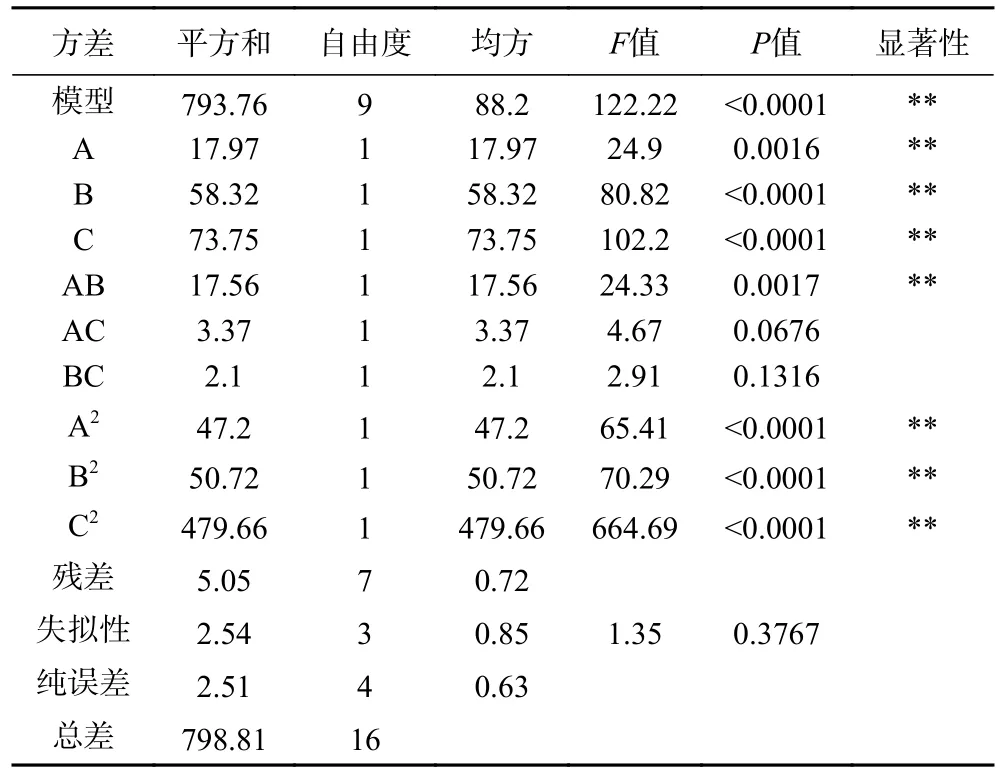
表3 响应面回归方程方差分析结果Table 3 Results of variance analysis of response surface regression equation
由表3 可知,该模型P<0.0001,R2=0.9736,失拟项不显著(P>0.05),说明该模型的显著性较高,方程的可行性较好,该模型可用来预测制备IMP 的最优条件。根据表3 可知,各因素对IMP 溶解度影响的大小顺序为C>B>A,模型中一次项A、B、C 对IMP溶解度的影响达到极显著水平(P<0.01)。
2.2.2 交互作用对IMP 溶解度的影响 由图2 可知,在因素较低水平条件下响应值随着每个因素的增大而增大,当响应值增大到极值后,又逐渐减小。溶解度与AB、AC、BC 等高线均为椭圆形,AB 的交互作用图椭圆形更明显、曲面最陡,在两两因素的交互作用对溶解度大小的影响中,PAB=0.0017<0.01,即AB 对IMP 溶解度的交互作用影响有极显著影响。利用Design-Expert 8.0 软件对反应条件进行优化组合,得到最佳工艺参数:反应温度88.73 ℃、反应时间75.09 min、蛋白与糖质量比1:2.08,在此条件下菊粉修饰WPI 制备IMP 的溶解度为83.00%。考虑到实际实验条件,最终调整工艺参数:蛋白与糖质量比1:2、反应温度89 ℃、反应时间75 min。实验进行3 次取平均值,得到的溶解度为83.00%±0.37%,与模型相符,说明通过响应面优化IMP 的制备条件是可行的,所得优化工艺条件可靠。
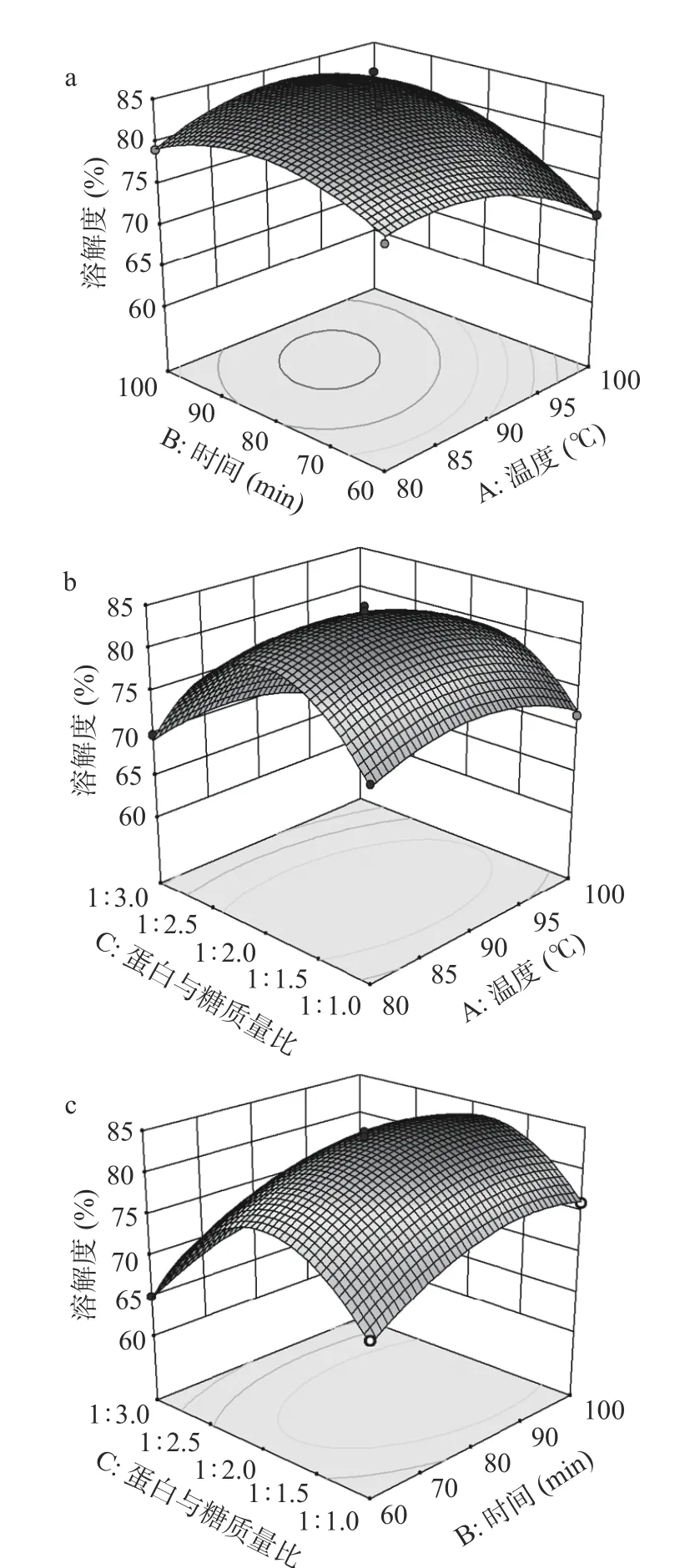
图2 影响IMP 溶解度的各个因素之间的交互作用图Fig.2 Interaction between factors affecting the solubility of modified protein of inulin
2.3 接枝度与褐变度的测定
接枝度和褐变度可以用来判断糖基化反应发生的程度。由表4 可知,经工艺优化后IMP 的接枝度为41.73%,IMP 的褐变度为0.29。说明WPI 与菊粉发生的糖基化反应较为充分。同时糖基化反应伴随着褐色产物的产生,但褐变程度低,糖基化反应生成的高级产物较少。反应结果与Zhang 等[21]的研究结果相似。

表4 IMP 的接枝度与褐变程度Table 4 Grafting degree and browning degree of IMP
2.4 结构性质
2.4.1 扫描电镜 从图3 可以看出,相同放大倍数下,WPI 呈大小不一的散落小颗粒状堆积结构或块状结构,H-WPI 呈现破碎的细小片状结构,出现大量不规则碎片,这主要是因为原来包埋在WPI 内部的疏水基团外露,表面疏水性增加,蛋白质分子间会发生聚集反应,形成热聚集体,从而导致表面结构的变化[22]。IMP 的结构变得更加规整,呈更大更厚的片状结构。推测原因为WPI 与菊粉通过共价键结合形成大分子的共轭物,表面疏水性降低,亲水的糖链和疏水的蛋白质部分整齐排列,发生大量的结合聚集现象,因此接枝物呈大块状,本实验结果与张桢玉[23]的研究结果相似。

图3 不同改性方法对WPI 微观结构的影响Fig.3 Effect of different modification methods on the microstructure of walnut protein
2.4.2 红外光谱分析 由图4 可知,在3700~3200 cm-1波数范围内IMP 相比于WPI 透过率下降,光谱强度明显增强,表明糖分子与蛋白以共价键形式结合,-OH 的数量增多,游离-OH 的伸缩振动引起透过率的下降[24]。在1600~1700 cm-1波数范围内,H-WPI、IMP 都发生了明显的振动(主要是由C=O 伸缩振动),说明加热处理和糖基化改性处理都使WPI 的二级结构发生了变化[25]。从图中可以看出在1050 cm-1波数附近IMP 的透过率下降,吸收峰光谱强度明显增强,是糖环存在的典型特征,这与李灵诚[26]的研究结果一致,表明菊粉与WPI 通过共价键结合,生成了糖环,发生了糖基化反应,因此导致蛋白分子侧链振动。
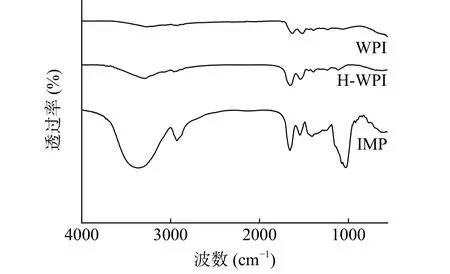
图4 不同改性方法对WPI 二级结构的影响Fig.4 Effect of different modification methods on the secondary structure of walnut proteins
2.4.3 内源荧光光谱分析 蛋白与糖发生糖基化反应会生成有色物质,而荧光物质是有色物质的前体物,在290 nm 的荧光激发波长下,以色氨酸为发射基团的荧光光谱可以准确地描述蛋白结构的改变以及氨基酸的损失[27]。由图5 可以看出,在320 nm处WPI 与荧光反应最剧烈,H-WPI、IMP 的内源荧光光谱都低于WPI,这可能是由于核桃分离蛋白经过加热处理后,使蛋白质的三级结构发生了改变,导致荧光强度降低[28]。IMP 的荧光光谱峰值波长出现明显的红移(2~3 nm)且IMP 荧光强度减弱程度最大,这可能是因为多糖链的存在,糖分子和蛋白分子之间发生了共价结合等相互作用,蛋白表面引入羟基对荧光产生屏蔽,导致其荧光减弱程度大[29]。
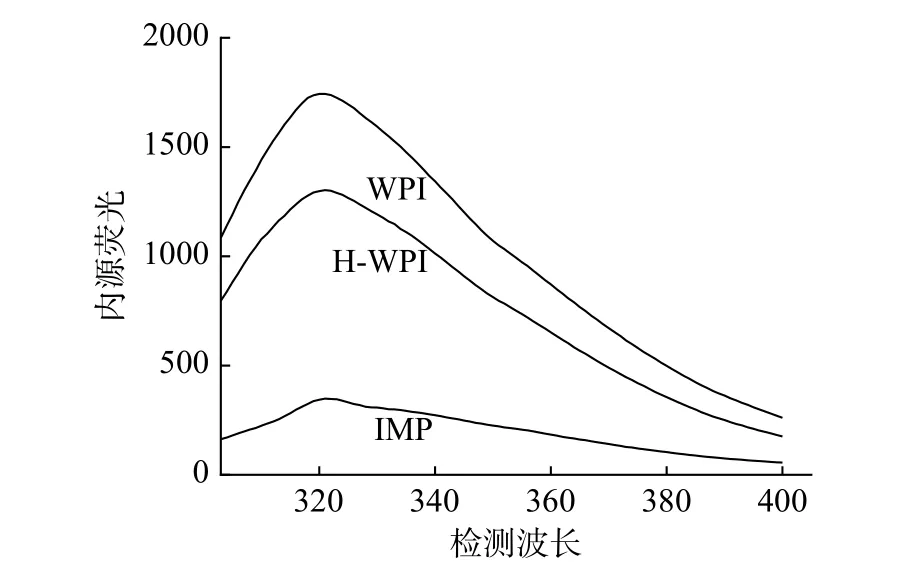
图5 不同改性方法对WPI 内源荧光谱图的影响Fig.5 Effect of different modification methods on the endogenous fluorescence spectra of walnut protein
2.5 功能特性
2.5.1 溶解度 由图6 可知,WPI、H-WPI、IMP 在酸性环境中溶解度的变化不明显,随着pH 不断增加,WPI、H-WPI、IMP 的溶解度都得到明显的改善,这主要是因为碱性环境下提高了蛋白质与水分子的亲和力,从而增加了溶解度。在pH 6~11 环境下,IMP、H-WPI 溶解度均明显高于WPI,WPI 经过加热处理后使得蛋白质内部结构暴露,结构更加疏松,从而H-WPI 溶解度变大。菊粉的加入使溶解度得到进一步提高,结果表明糖基化反应可以有效改善WPI 的溶解度,在pH 6~10 环境下效果改善最明显。
2.5.2 起泡性、泡沫稳定性 由图7 可知,WPI 改性后的起泡性和泡沫稳定性均显著提升。IMP 的起泡性明显增加,这主要是因为糖基化反应使产物溶解性提高,蛋白溶解性提高能够促使大量蛋白分子扩散至气/液界面,导致其起泡能力增加[27]。同时IMP 的泡沫稳定性也得到改善,这主要是因为添加的菊粉本身具有粘性,在空气与水交界处会更容易形成薄膜从而减缓了水分的流失,增强了泡沫的稳定性[30]。

图7 不同改性方法对WPI 起泡性、泡沫稳定性的影响Fig.7 Effect of different modification methods on foamability and foam stability of walnut protein
2.5.3 乳化性、乳化稳定性 由图8 可知,H-WPI 的乳化性及乳化稳定性对比WPI 都得到较大程度的改善。说明加热处理可以使蛋白分子的空间结构变的松散,溶解度得到提高,较高的溶解度可促进蛋白质在乳化相中的分散和吸附[31],H-WPI 的乳化稳定性略高于IMP 主要原因可能是多糖的加入使界面的膜的机械强度增加,提高了粘弹性,但较H-WPI 不足够支撑空间稳定。IMP 的乳化特性对比WPI 也得到较大程度的改善。随着菊粉的加入,蛋白与糖形成了分子量更大的共价复合物,分散在油水界面上,产生了空间位阻效应,糖基化产物不易聚集,使液滴短时间内无法快速聚集,糖链的加入也增加了蛋白膜厚度,从而增加了IMP 的乳化性指数[32]。并且由于菊粉为多糖,分子量大,抑制蛋白分子聚集的能力更强,蛋白质的部分吸附能力和糖的高亲水性相结合,导致在油水界面附近形成强溶剂化层,从而使乳液油滴具有空间稳定性[33],所以乳化稳定性较WPI 提高显著。
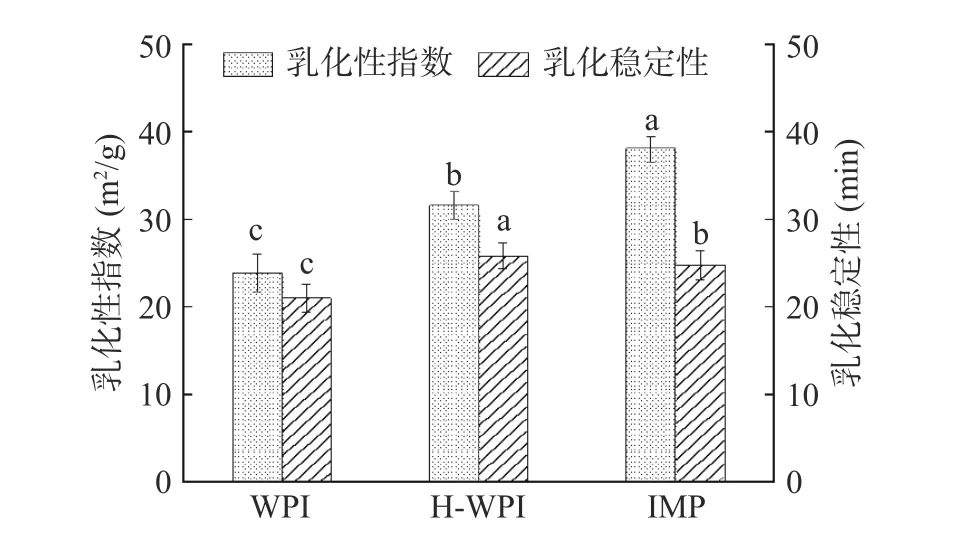
图8 不同改性方法对WPI 乳化性、乳化稳定性的影响Fig.8 Effect of different modification methods on emulsifying property and emulsion stability of walnut protein
3 结论
糖基化改性可以改变核桃分离蛋白的结构,有效改善核桃分离蛋白在溶液中的分散性,增强蛋白质与水的结合作用并改善功能特性。本研究通过响应面优化制备条件后,制备的IMP 溶解度可达到83%,显著提高了核桃蛋白的溶解性。同时,通过对IMP结构特性研究发现,其红外光谱图出现明显特征峰的波动,内源荧光光谱图出现明显的红移,荧光强度明显降低,说明糖基化改性技术能够改变WPI 的结构,并且使其功能特性获得改善。以上试验结果为研究糖基化改性制备核桃蛋白菊粉共轭物的结构及功能特性研究奠定了理论基础,该研究有利于拓宽WPI 在食品工业应用范围,有利于核桃产业的发展。然而目前关于糖基化改性核桃分离蛋白的研究还不够深入,单糖、二糖以及其他多糖对WPI 的影响尚不全面,在未来可加强不同糖对糖基化改性WPI 的研究,运用超声波或者微波等方法辅助糖基化改性进行研究以期获得更高功能特性的产品,开发新型功能性食品。
