乳酸菌对羊乳酸奶体外降血糖和抗氧化功能的影响
2023-09-10孙晓琛夏依旦买买提刘小莉范琳琳夏秀东
张 会,孙晓琛,夏依旦·买买提,刘小莉,范琳琳,夏秀东,王 英,
(1.江苏大学食品与生物工程学院,江苏镇江 212013;2.江苏省农业科学院农产品加工研究所,江苏南京 210014)
活性氧自由基过多会引起氧化应激,氧化应激能引起体内一系列疾病如心血管疾病,动脉粥样硬化、糖尿病等[1]。而由糖尿病引起的健康问题已经成为全世界关注的问题,2 型糖尿病(T2DM)是一种最常见的胰岛素抵抗类型,即由于体内胰岛素分泌异常而引起的疾病[2]。糖尿病会引起一系列健康问题,对人体造成严重危害,如增加动脉粥样硬化患病率,肾功能逐渐减退及视网膜血管损伤等问题。研究表明乳酸菌具有多种益生功能,其自身及其代谢产物能促进机体消化、缓解氧化应激反应、增强机体免疫力、调节肠道微生物菌群、增加胰岛素敏感性来改善糖尿病症状[3-4]。前人的研究表明利用乳酸菌发酵食品对人类健康有着积极影响[5]。
羊奶及其制品在人类的饮食中占有重要地位,因其具有丰富的营养成分和易于消化的动物源蛋白而广受欢迎[6]。与牛奶相比,羊奶含有较低的过敏源—酪蛋白,且其脂肪颗粒较小,因此更容易被人体胃肠道消化吸收[7-8]。研究表明,羊奶具有抗氧化、免疫调节、调节肠道菌群等多种功能活性[9-10]。由于羊奶具有合理的营养比例、良好的功能特性及可发展的商业价值,正成为乳制品行业的新市场。近年来,有研究人员将羊奶作为发酵基质,采用乳酸菌发酵,降低羊奶自身膻味,并提高其风味口感[11-12]。陈慧[13]研究益生菌发酵对羊奶食用品质和脂肪酸的影响,表明益生菌能够协同嗜热链球菌和保加利亚乳杆菌降解羊奶脂肪酸,提升发酵羊奶品质。Chen 等[14]研究发现植物乳杆菌发酵后的羊酸奶能够保持高血管紧张素转化酶抑制活性,Slačanac 等[15]的研究结果也显示了羊酸奶能够减少胃肠道不适。Guo 等[16]利用动物双歧杆菌-M8 发酵羊奶,提升了发酵羊奶的感官、理化和功能特性。因此,利用不同的益生菌发酵羊奶能够对羊奶的不同功能特性产生不同的影响。
本研究以羊奶为原料,用课题组前期筛选的3 株具有体外降血糖功能和抗氧化功能的乳酸菌单菌发酵羊奶,研究乳酸菌对羊酸奶体外抗氧化和降血糖活性的影响。通过测定发酵羊奶的DPPH 自由基清除率、PTIO 自由基清除率及还原活性评估体外抗氧化功能活性,测定羊酸奶的α-葡萄糖苷酶活性抑制率和α-淀粉酶活性抑制率评价其体外降血糖功能活性。前期的预实验结果显示,单菌发酵羊奶的凝乳时间超过14 h,商业发酵菌株保加利亚乳杆菌和嗜热链球菌是酸奶发酵生产中的常用发酵剂,联合商业发酵剂发酵羊奶可以缩短发酵时间,因此研究中采用单菌发酵和联合商业发酵剂复合发酵两种方式发酵羊奶。研究结果将为后续开发功能性羊酸奶提供可靠菌株资源,同时为新型功能性发酵羊奶产品提供理论依据和技术支持。
1 材料与方法
1.1 材料与仪器
羊奶粉 南京浩明乳业有限公司提供;白砂糖购于南京苏果超市;发酵剂保加利亚乳杆菌(Lactobacillus bulgaricus,LB)、嗜热链球菌(Streptococcus thermophilus,ST) 购于微康益生菌(苏州)股份有限公司;商业菌株Lactobacillus rhamnosusATCC53103(对照菌株) 购于美国菌种保藏中心ATCC,被证实具有抗氧化、降血糖、提高免疫力等多种功能作用;Pediococcus acidilacticiGC215、Lactobacillus brevisPC-2、Liquorilactobacillus maliL31 均来源于江苏省农业科学院农产品加工研究所食品生物工程研究室,具有抑制α-葡萄糖苷酶活性和α-淀粉酶活性的能力,同时也具有清除DPPH 自由基和PTIO 自由基的能力;1,1-二苯基-2-三硝基苯肼(DPPH) 北京克瑞斯生物技术有限公司;2-苯基-4,4,5,5-四甲基咪唑啉-3-氧代-1-氧(PTIO) 北京华威锐科化工有限公司;α-葡萄糖苷酶(10 units/mg ) 青岛百奥百斯特化学试剂有限公司;α-淀粉酶(50 U/mg) 西格玛奥德里奇(上海)贸易有限公司;对硝基苯基-α-D-吡喃葡萄糖苷(PNPG) 北京华越洋生物科技有限公司。
3K15 型冷冻高速离心机 美国Sigma 公司;LRH-150 型生化培养箱 上海一恒科学仪器有限公司;Epoch 酶标仪 济南好来宝医疗器材有限公司;DSX-18L-1 型手提式高压蒸气灭菌器 上海申安医疗机械厂;SW-CJ-1C 型双人单面净化工作台 苏州净化设备有限公司;HH-4 型数字恒温水浴锅 国华电器有限公司;WH-3 型漩涡混合仪 上海跃进医疗器械有限公司。
1.2 实验方法
1.2.1 发酵剂准备 将乳酸菌分别以3%接种量接种到MRS 肉汤中,在37 ℃条件下培养18 h,继续培养两次后于4 ℃,6000 r/min 条件下离心10 min,去除液体培养基,用0.85%无菌生理盐水清洗菌体两次,再用无菌生理盐水重悬,将其菌密度调整为1×108CFU/mL 用作发酵羊奶的发酵剂。参照杨敏[17]发酵羊奶的保加利亚乳杆菌乳杆菌和嗜热链球菌间的比例,选择添加益生菌的发酵时间和纯商业发酵的凝乳时间无显著差异,同时考虑益生菌添加比例对混合发酵产品的生物活性有显著影响,综合比较,混合接种比例按照表1 混合。
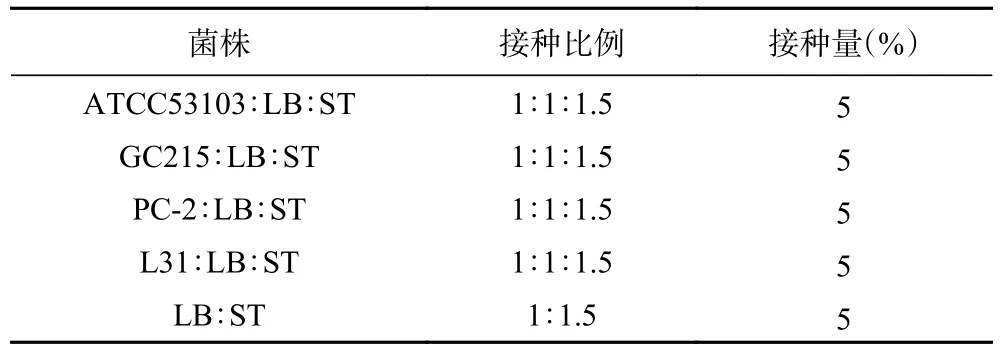
表1 混合发酵组菌株的混合比例Table 1 Mixing ratio of starter in mixed fermentation group
1.2.2 羊酸奶的发酵工艺 参考陈慧[13]的方法并稍加修改,具体如下:将羊奶粉溶解于温水中使其乳固形物浓度为14%(w/v),加入6.5%(w/v)的白砂糖,并充分搅拌。在21 MPa、60 ℃下进行均质处理5 min。然后105 ℃、15 min 条件下灭菌处理,待冷却到常温条件时,将发酵剂以5%的接种量接种到羊奶中,在37 ℃条件下发酵15 h,并在4 ℃条件冷藏12 h,每种发酵处理做3 个重复。
1.2.3 羊酸奶活菌数的测定 根据GB 4789.2-2016《食品安全国家标准 食品微生物学检验菌落总数测定》中的方法检测羊酸奶中活菌数[18]。
1.2.4 羊酸奶上清液的制备 参考Abdel-hamid 等[19]的方法制备羊酸奶上清液。将样品在10000 r/min、4 ℃条件下离心30 min。用0.45 μm 滤膜过滤样品得到羊酸奶上清液用于后面的实验。
1.2.5 羊酸奶抗氧化活性的测定
1.2.5.1 DPPH 自由基清除能力的测定 按照Singh等[20]描述的方法测定羊酸奶上清液DPPH 自由基清除能力,稍作修改。将羊酸奶上清液与 0.2 mmol/L的无水乙醇配制的DPPH 溶液1:1 涡旋混匀,常温下避光反应30 min,在517 nm 处测定吸光度A0,用无水乙醇替换上清液溶液,测定其吸光度记为A1,根据公式(1)计算DPPH 自由基清除能力:
1.2.5.2 PTIO 自由基清除能力的测定 按照Li等[21]描述的方法测定羊酸奶上清液对PTIO 自由基清除能力,稍作修改,具体操作是将羊酸奶上清液与0.1 mg/mL PTIO 溶液1:7 充分混匀,在37 ℃条件下水浴2 h,在557 nm 处测定吸光度A0,用蒸馏水替换上清液,测定其吸光度记为A1,根据公式(2)计算PTIO 自由基清除能力:
1.2.5.3 还原活性测定 按照Lin 等[22]的方法测定酸奶上清液还原活性,稍作修改。取0.5 mL 羊酸奶上清液,加入等体积0.2 mol/L 且pH 为6.6 的PBS缓冲溶液以及0.5 mL 的1%(w/v)铁氰化钾溶液,摇匀后在50 ℃水浴锅中反应20 min,置于冰水中冷却。再加入0.5 mL 的10%(w/v)TCA,4000 r/min 离心5 min,取1 mL 离心后的上清液,加入1 mL 生理盐水,1 mL 的0.1%(w/v)三氯化铁溶液,混匀,反应10 min 后,测定700 nm 处其吸光值,结果采用L-半胱氨酸当量(μmol/L)作为标准表示还原活性,L-半胱氨酸标准曲线方程为y=0.0034x-0.0228,R2=0.9927。
1.2.6 羊酸奶降血糖活性的测定
1.2.6.1α-葡萄糖苷酶抑制活性 参考Zhang 等[23]的方法并进行修改。将50 μL 的0.1 mol /L PBS 缓冲液(pH 6.8)与1.5 mmol/L 的PNPG 溶液等体积混合,再加入25 μL 羊酸奶上清液,在37 ℃条件下反应10 min后加入30 μL 的0.2 U/mL 的α-葡萄糖苷酶溶液继续在37 ℃条件下反应30 min,最后用50 μL 的0.2 mol/L的Na2CO3溶液终止反应。在酶标仪405 nm 处测定吸光值为A,样品空白组用PBS 缓冲液替换α-葡萄糖苷酶溶液测其吸光度为B,对照组用PBS 缓冲液替换样品测其吸光度为C,对照空白组用PBS 缓冲液替换样品和α-葡萄糖苷酶溶液测其吸光度为D。根据公式(3)计算α-葡萄糖苷酶活性抑制率:
1.2.6.2α-淀粉酶抑制活性 参考龙楚媚等[24]的方法并稍加修改。将0.25 mL 羊酸奶上清液与1 mg/mL的α-淀粉酶溶液以1:1 体积混合,在37 ℃条件下反应10 min 后加入0.5 mL 的1.5%的可溶性淀粉溶液,继续反应5 min,再加入1 mL DNS 显色剂,在沸水浴中反应5 min 后迅速冷却至室温,加入8 mL的PBS 缓冲液静置30 min,在540 nm 处测定吸光值为A。样品空白组用PBS 缓冲液替换α-淀粉酶溶液测其吸光度为B,对照组用PBS 缓冲液替换样品测其吸光度为C,对照空白组用PBS 缓冲液替换样品和α-淀粉酶溶液测其吸光度为D。根据公式(4)计算α-淀粉酶活性抑制率:
1.3 数据处理
采用SPSS 26.0 和Origin 2021 软件分析试验数据,结果的差异性用单因素方差分析中的最小显著差异法检验,P<0.05 为有显著性差异。所有试验重复3 次,用平均值±标准差表示结果。
2 结果与分析
2.1 不同乳酸菌发酵羊酸奶中活菌数分析
根据国家标准规定,1 mL 酸奶中所含乳酸菌活菌数不低于1×106CFU/mL,才能保证乳酸菌在人体肠道中发挥正常作用[25]。表2 反映了发酵结束后羊酸奶中所含乳酸菌活菌数,单菌发酵和混合发酵组的羊酸奶活菌数超过国家标准所需最低活菌数1×106CFU/mL。ATCC53013 发酵的羊酸奶15 h 后活菌数达到8.44 lg CFU/mL。GC215 和PC-2 发酵的羊酸奶中的活菌数分别为8.41 lg CFU/mL 和8.40 lg CFU/mL,相比之下,L31 发酵后羊奶中所含活菌数相对较少,但也达到8.03 lg CFU/mL,表明4 株乳酸菌在羊奶中均具有良好的生长性能。这与刘荔等[26]发酵普通酸羊奶的乳酸菌活菌数为8.42 lg CFU/mL的结果相似。本研究混菌发酵的羊酸奶中,4 株乳酸菌分别与LB: ST 混合发酵羊酸奶活菌数最低可达8.48 lg CFU/mL,与商业发酵剂LB: ST 发酵羊奶的活菌数相比,均有不同程度的提高。但无论单菌发酵还是混合发酵,不同发酵组羊酸奶中活菌数差异不显著(P>0.05)。本研究结果表明,功能发酵菌株与商业发酵剂之间存在良好的共培养特性。

表2 单菌发酵组和混合发酵组发酵羊酸奶活菌数Table 2 The number of viable bacteria in fermented goat yoghurt in single fermentation group and mixed fermentation group
2.2 不同乳酸菌对发酵羊酸奶DPPH 自由基清除能力的影响
新陈代谢会产生自由基,当体内自由基含量显著增加时,会对周围的酶、蛋白质和核内DNA 造成损害,导致衰老和色素沉着等现象[27]。本研究利用不同乳酸菌发酵羊奶,探究不同乳酸菌对羊酸奶的DPPH 自由基清除能力的影响,结果如图1 所示。与未发酵羊奶相比,经过乳酸菌发酵的羊酸奶对DPPH自由基清除能力显著提高(P<0.05)。GC215、PC-2和L31 单菌发酵羊酸奶的DPPH 自由基清除能力比混合发酵羊酸奶的DPPH 自由基清除能力显著提高(P<0.05),ATCC53103 单菌发酵的羊酸奶对DPPH自由基清除率达到51.78%±0.54%,显著低于其与商业发酵剂混合发酵的DPPH 自由基清除率(P<0.05),GC215、PC-2、L31 单发酵的羊酸奶显著高于其与商业发酵剂混合发酵的羊酸奶(P<0.05),这可能由于3 株功能菌株单发酵产生清除DPPH 自由基物质含量高;单菌发酵羊奶组相比,GC215、PC-2 和L31 发酵的羊酸奶对DPPH 自由基清除能力均显著高于ATCC53103 组羊酸奶(P<0.05),其中GC215 组羊酸奶对DPPH 自由基清除率可达87.35%±0.08%。研究结果表明乳酸菌发酵羊奶之后,可提高其DPPH 自由基清除能力,但不同乳酸菌提高发酵羊奶的DPPH 自由基清除能力不同。这是因为羊奶经乳酸菌发酵后,蛋白分解活性增加,蛋白分解后与自由基反应形成了更稳定的化合物增加了发酵乳的抗氧化活性[28]。Eundeok 等[29]用植物乳杆菌NK181 和德氏乳杆菌KU200171 发酵牛奶的DPPH 自由基清除率显著增加;Ayyash 等[30]用La.DSM 和Lc.K782分别发酵骆驼奶和牛乳,发酵结束后DPPH 自由基清除能力也显著增加。本研究也表明利用乳酸菌发酵羊奶可提高羊酸奶的DPPH 自由基清除率,且不同乳酸菌发酵羊奶提高DPPH 自由基清除能力不同。
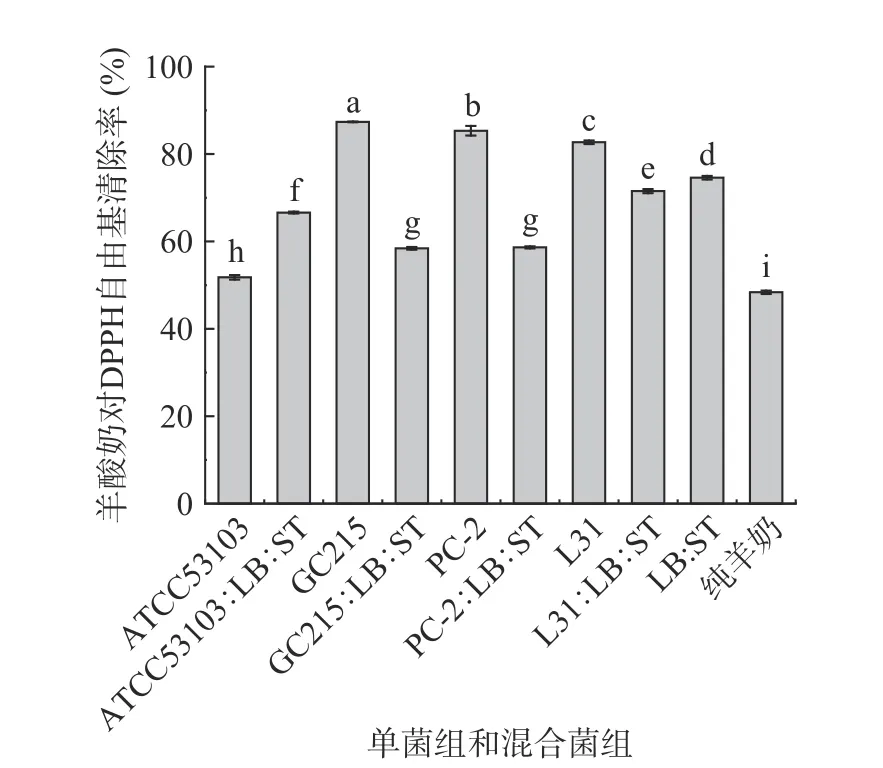
图1 单菌发酵和混合发酵组发酵羊酸奶DPPH自由基清除率Fig.1 DPPH free radical scavenging rate of fermented goat yogurt by single bacteria and mixed bacteria fermentation groups
2.3 不同乳酸菌对发酵羊酸奶PTIO 自由基清除能力的影响
PTIO 是一种常用的一氧化氮清除剂,这是一种新的抗氧化实验[21]。目前关于发酵乳对PTIO 自由基清除率报道尚少。由图2 可知,与未发酵羊奶相比,不同乳酸菌发酵羊酸奶对PTIO 自由基清除率具有显著性提高(P<0.05)。单菌发酵组中,PC-2 发酵羊奶的PTIO 自由基清除率显著高于ATCC53103菌株单独发酵羊奶的清除率(P<0.05),但PC-2、GC215 和L31 发酵羊酸奶之间无显著性差异(P>0.05)。乳酸菌与商业发酵剂混合发酵组羊酸奶对PTIO 自由基清除率无显著性差异(P>0.05),但显著高于商业发酵剂组(P<0.05)。结果表明,功能菌的添加可以提升羊酸奶对PTIO 自由基清除能力;整体上单菌发酵组羊酸奶对PTIO 自由基清除率比混合发酵组低。这个结果与本研究中不同乳酸菌发酵羊酸奶对DPPH 自由基清除能力相反,这是因为发酵过程中蛋白质分解并释放出生物多肽对两种自由基产生了不同的影响。从整体来看,未发酵与发酵酸奶对PTIO 自由基清除率较低,这可能是因为具有抗氧化活性的生物活性多肽区域的水解度和裂解程度较高,活性多肽对PTIO 自由基不敏感,无法具有较高的清除率[31]。
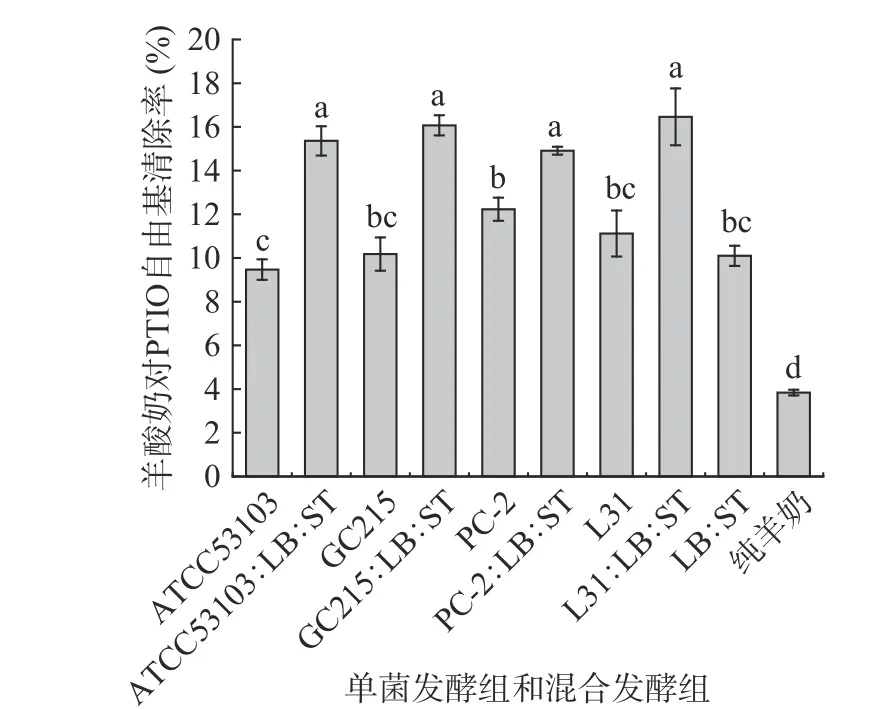
图2 单菌发酵和混合发酵组发酵羊酸奶PTIO自由基清除率Fig.2 PTIO free radical scavenging rate of fermented goat yogurt by single bacteria and mixed bacteria fermentation groups
2.4 不同乳酸菌对发酵羊酸奶还原活性的影响
酶类和非酶类化合物可以减少活性氧(ROS)的产生以防止氧化反应,这被称为还原活性,通常以L-半胱氨酸的还原力作为标准衡量物质的还原力,本文研究不同乳酸菌发酵羊酸奶的还原活性,结果如图3 所示。由图可知,羊奶自身具有较高还原活性,相当于(158.51±1.50) μmol/L L-半胱氨酸还原当量。单菌发酵和混合发酵羊奶均不同程度的提高了羊酸奶还原活性。单菌发酵组中,GC215 和PC-2 发酵的羊酸奶还原能力强,分别为(359.17±7.52) μmol/L和(345.41±5.53) μmol/L L-半胱氨酸还原当量,分别比未发酵羊奶提高了2.27 和2.18 倍。与未发酵羊奶相比,除ATCC53103 单菌发酵组羊酸奶外,其他发酵组羊酸奶还原活性均有显著提高(P<0.05),增加L-半胱氨酸还原当量在25.12~200.66 μmol/L 范围内。单菌发酵羊奶和混合发酵羊奶对羊酸奶还原活性影响趋势与清除DPPH 自由基影响趋势相同,经过乳酸菌发酵的羊奶,在发酵过程中增加了发酵酸奶的蛋白质的水解度,导致了小分子肽物质的形成,这有助于促进还原过程中的氢的传递作用。此外,乳酸菌发酵过程中也会产生具有功能特性的代谢物质,如多糖、有机酸等,从而可能增加了发酵羊酸奶的还原活性。乳酸菌自身的抗氧化活性与发酵过程中代谢物质所产生的活性物质协同增强了乳酸菌发酵酸奶的抗氧化活性[32]。
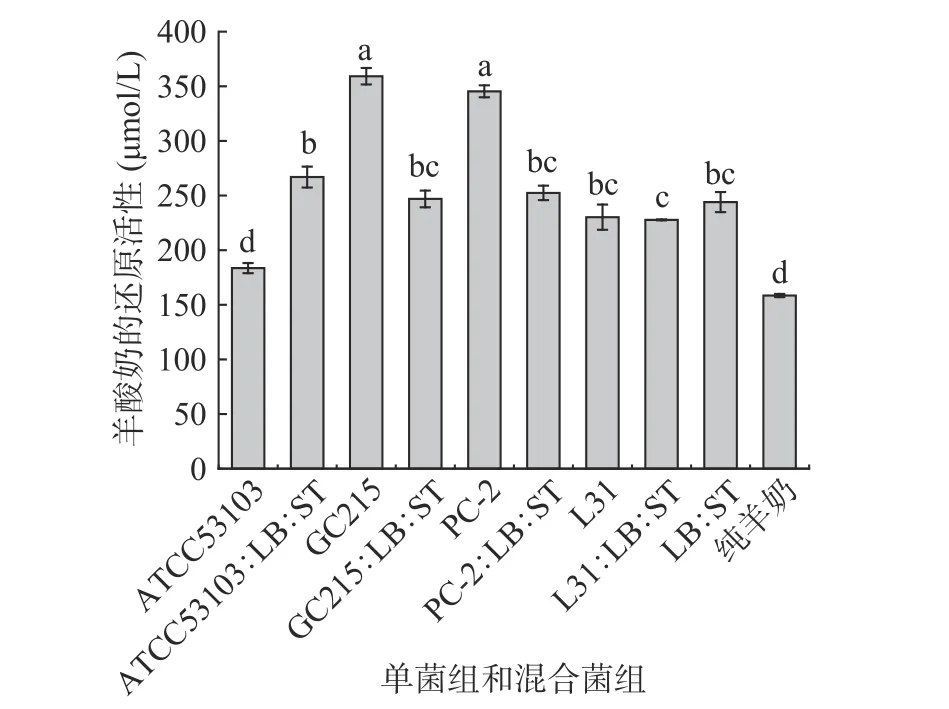
图3 单菌发酵和混合发酵组发酵羊酸奶的还原活性Fig.3 Reductive activity of goat yogurt fermented by single bacteria and mixed bacteria fermentation groups
本研究根据DPPH 自由基清除率、PTIO 自由基清除率和还原活性3 个抗氧化性指标的测定评估不同乳酸菌发酵对羊酸奶体外抗氧化活性的影响,从整体结果来看,与未发酵羊奶相比,经乳酸菌发酵后,其体外抗氧化活性有显著提高(P<0.05);与商业发酵剂发酵羊奶相比,添加功能性益生乳酸菌,其体外抗氧化活性也有显著提升(P<0.05)。从DPPH 自由基清除率和还原活性结果可以看出,GC215 和PC-2 单菌发酵羊奶的抗氧化活性最高;PTIO 自由基清除率结果表明,GC215、PC-2 和L31 发酵羊奶的抗氧化活性无显著差异(P>0.05)。这是由于DPPH 自由基清除、PTIO 自由基清除和还原活性的物质基础不同所导致,但羊酸奶中具体的物质基础还有待进一步研究。
2.5 不同乳酸菌对发酵羊酸奶α-葡萄糖苷酶抑制活性的影响
糖尿病与人体血糖水平有关,血糖水平与葡萄糖代谢调控紧密相关。α-葡萄糖苷酶和α-淀粉酶是药物改善葡萄糖代谢的关键靶点[33]。抑制此两种酶会减缓肠道中多糖和淀粉的分解,从而降低小肠对葡萄糖的吸收速度,有助于控制的餐后血糖[34]。不同乳酸菌对发酵羊酸奶α-葡萄糖苷酶抑制结果见图4。由图可知,发酵羊酸奶的α-葡萄糖苷酶抑制活性显著提高(P<0.05),不同菌株之间和不同发酵方式的羊酸奶的α-葡萄糖苷酶抑制活性表现出不同程度的差异。单菌发酵羊奶的α-葡萄糖苷酶抑制活性显著高于混菌发酵(P<0.05)。单菌发酵羊奶结果显示,L31 发酵的羊酸奶抑制α-葡萄糖苷酶活性最高,抑制率为45.14%±1.61%。GC215 和PC-2 单菌发酵羊奶的抑制α-葡萄糖苷酶活性之间没有显著差异(P>0.05),ATCC53103 发酵的羊酸奶对α-葡萄糖苷酶抑制活性为6.91%±0.43%,这可能是由于菌株不同,代谢途径不同,生成产物不同所致。乳酸菌发酵分为同型乳酸发酵、异型乳酸发酵和双歧杆菌发酵[35],三种发酵类型产生的代谢物质并不完全相同,含量也不同。Ayyash 等[30]的研究中用LC.K782 和La.DSM 发酵的骆驼奶和牛奶,LC.K782 发酵的两种乳α-葡萄糖苷酶抑制率在30.00%~40.00%之间,La.DSM 发酵的骆驼奶中α-葡萄糖苷酶的抑制率均小于30%。本研究中,不同乳酸菌对发酵羊奶的α-葡萄糖苷酶抑制率提高程度不同,说明不同功能菌株发酵对发酵产品的体外的降血糖活性影响不同。

图4 单菌发酵和混合发酵组发酵羊酸奶α-葡萄糖苷酶抑制活性Fig.4 Inhibitory activity of α-glucosidase in goat yogurt fermented by single bacteria and mixed bacteria fermentation groups
2.6 不同乳酸菌对发酵羊酸奶α-淀粉酶抑制活性的影响
不同乳酸菌发酵羊酸奶的α-淀粉酶活性抑制结果如图5 所示。由图可知,与纯羊奶相比,乳酸菌发酵可以提高羊奶对α-淀粉酶活性抑制率。与商业发酵剂发酵羊酸奶相比,功能益生菌单菌发酵和添加功能乳酸菌的混菌发酵羊奶的α-淀粉酶活性抑制率均显著提高(P<0.05),α-淀粉酶活性抑制率在58.80%~82.30%;与商业发酵剂发酵羊酸奶的α-淀粉酶活性抑制率相比,添加功能性益生菌GC215、PC-2 和L31的羊酸奶的酶活抑制率显著提高(P<0.05),其中GC215 和PC-2 与商业发酵剂混合发酵羊酸奶对α-淀粉酶活性抑制效果最高,分别达到78.22%和82.3%,两者之间无显著差异(P>0.05)。对照菌株ATCC53103 单菌发酵羊酸奶和混合发酵羊酸奶对α-淀粉酶活性抑制率也显著增加(P<0.05),说明对照菌株ATCC53103 与功能菌株GC215、PC-2 以及L31 与商业发酵剂之间存在协同增效作用。

图5 单菌发酵和混合发酵组发酵羊酸奶对α-淀粉酶抑制活性Fig.5 Inhibitory activity of α-amylase in goat yogurt fermented by single bacteria and mixed bacteria fermentation groups
目前,关于降血糖酸奶主要通过添加一些辅料提高酸奶降血糖效果,生物碱和水溶性膳食纤维等功能活性物质[36]。肖凯等[37]通过向发酵乳加入蛋白桑和黄秋葵研制的酸奶对α-葡萄糖苷酶的抑制能力较强,其抑制率可达70%左右。Shori 等[38]向酸奶中添加大蒜辅料可有效提高酸奶对α-葡萄糖苷酶和α-淀粉酶活性抑制率。本文用具有降血糖功能的乳酸菌发酵羊奶,在发酵结束后,提高了羊酸奶的体外降血糖功能。因此,在提高羊酸奶的体外降血糖功能也可通过不同功能乳酸菌进行混合发酵提高酸奶的降血糖功能活性。这可能在发酵过程中产生了能降低血糖物质,如有机酸、酶系等,提高了羊酸奶对α-葡萄糖苷酶和α-淀粉酶活性的抑制,但具体哪些物质起到关键作用,还需要进一步的研究。
3 结论
以3 株具有降血糖、抗氧化功能的乳酸菌和酸奶商业发酵剂株LB 和ST 为发酵菌株,采用功能菌株单菌发酵和联合商业发酵剂混合发酵两种方式发酵羊奶,研究不同乳酸菌发酵对羊酸奶体外抗氧化和降血糖功能活性的影响。体外抗氧化结果表明,单菌发酵和混合发酵羊酸奶都提高了发酵酸奶的体外抗氧化功能,但不同菌株发酵羊酸奶在同一抗氧化指标不一定都具有显著性差异。3 株乳酸菌单菌发酵羊奶对DPPH 自由基清除能力及还原活性均比单菌与商业发酵剂混合发酵羊酸奶高,但对于PTIO 自由基清除能力,3 株乳酸菌单菌发酵羊酸奶均比混合发酵羊酸奶低。降血糖结果表明,3 株乳酸菌单菌发酵羊酸奶的α-葡萄糖苷酶抑制率均比对应的混合发酵羊酸奶α-葡萄糖苷酶抑制率显著提高,但对α-淀粉酶活性抑制率结果呈相反趋势。整体结果表明添加功能菌株发酵能提升羊酸奶体外抗氧化和降血糖功能,但具有菌株特异性。本研究结果可为功能性发酵羊奶提供可靠的菌株资源,同时为新功能性羊酸奶开发提供新思路。
