拟南芥叶绿体分裂蛋白PARC6影响子叶与真叶的生长
2023-09-09江转转宋亚玲
江转转 龚 莉 宋亚玲
(安庆师范大学生命科学学院皖西南生物多样性研究与生态保护安徽省重点实验室,安庆 246133)
叶绿体是植物所拥有的一种特殊类型的质体,也是发生光合作用的重要场所。目前的研究普遍认为叶绿体是通过内共生机制从现代蓝藻的近缘物种中衍生出来的细胞器[1],但叶绿体并非一直从头合成。部分叶绿体通过分裂过程从已经存在的质体中繁殖出来,从而使它们在分裂后能够由子细胞继续继承[2]。叶绿体通常以二元裂变繁殖,但在一些物种和组织中也观察到多重裂变。有些原始藻类每个细胞只有一个或几个叶绿体,并且叶绿体随细胞周期同步分裂[3]。然而,在高等植物中,一个细胞通常包含大量的质体,而且同一个细胞中质体分裂是不同步的。此外,质体可在细胞扩张但不分裂的发育组织中继续分裂[4]。许多早期的研究表明,每个细胞的质体数量随细胞类型、发育阶段和环境条件的不同而有很大的差异。然而,在进化过程中,大多数来自细菌祖先的基因要么丢失,要么转移到宿主的核基因组中,导致叶绿体的基因组缺乏足够的基因信息来介导自身的生物发生以及分裂。因此,与原始祖先蓝藻不同,植物叶绿体的分裂是细胞核的核基因组执行和控制的[5]。近年来,结构和分子遗传学研究推动着质体分裂机制和分裂装置的解析,参与质体分裂的一些蛋白分子逐步被鉴定出来。目前已知,质体分裂是由一种称为质体分裂机制的超级环状分子进行,它主要包含3 种特异的环状结构:质体分裂环,构成分裂机制的主要框架,包括相应细胞器的外包膜胞质一侧的环形纳米丝束;FtsZ(Filamenting temperature-sensitive Z)环,一个由细菌裂变蛋白FtsZ 的同源物构成的单环,位于分裂位点的内包膜之下;动力蛋白环是由动力蛋白超家族成员在细胞器分裂部位的外膜胞质一侧形成的不连续环状结构[5-11]。这3类环状结构周围存在大 量 的 分 裂 调 控 蛋 白,其 中PARC6(Paralog of ARC6)蛋白已充分被证明是一种参与叶绿体分裂的调控蛋白。PARC6 蛋白插入叶绿体内膜,作为叶绿体分裂机器的一个组分。在PARC6蛋白缺失的突变株中,叶肉细胞叶绿体表现为不对称分裂或多重分裂[12-15]。
在幼苗发育过程中,子叶最初作为一个储能器官,在缺乏光照的情况下为幼苗提供营养。一旦幼苗从土壤中冒出来并暴露在阳光下,就会迅速形成叶绿体[16]。遗传和生化试验表明,对于诸如拟南芥(Arabidopsis thaliana)双子叶植物而言,子叶叶绿体的发育与真叶叶绿体的发育存在不同的调控路径。一方面,子叶中的前质体存在于所有细胞中,在光感受器网络调节下,子叶中的前质体受光照后立即通过光形态建成途径发育为叶绿体。与子叶相比,真叶的叶绿体发育主要发生在茎尖分生组织和叶片的原基,随后的增殖是经由叶绿体的分裂而并非重新从头组装[2,17-18]。另一方面,目前已发现大量子叶叶色白化或褪绿而真叶叶色正常的突变株[19-21],或者真叶叶色白化或褪绿而子叶叶色正常的突变株[22-23],这说明子叶叶绿体与真叶叶绿体存在不同的发育途径。
虽然双子叶植物的子叶和真叶叶绿体存在不同的发育途径,但是两者叶绿体均以二分裂的方式进行增殖。本课题组在前期的研究中鉴定到一种新的拟南芥多基因突变株sl2(seeding lethal 2),该突变株表现为子叶白化,真叶叶绿体分裂异常,植株矮小且生长受限[24]。进一步研究发现sl2突变株为PARC6基因及SCO2基因双重突变株。已有的研究认为子叶白化会影响植株的生长,而异常的叶绿体分裂对子叶和真叶生长的影响目前还并不清楚。本研究以拟南芥叶绿体异常分裂突变株parc6为试验对象,子叶白化突变株sco2(snowy cotyledon 2)及真叶异常分裂同时子叶白化突变株sl2为对照,探究叶绿体分裂对于拟南芥子叶和真叶生长的影响。
1 材料与方法
1.1 试验材料
以哥伦比亚0 型(Columbia-0)生态型拟南芥为野生型对照,拟南芥T-DNA 插入突变体parc6(SALK_100009)及单碱基突变体sco2(CS68145)购自拟南芥生物资源中心,多重突变株sl2为自发突变[24]。拟南芥种子用体积分数75%乙醇进行表面消毒,点播于添加10 g·L-1蔗糖和8 g·L-1琼脂的½MS培养基上。在黑暗中4 ℃低温春化2 d后,置于温度为23 ℃、光照强度为90 μmol·m-2·s-1环境下生长。
1.2 DNA的提取、PCR扩增及测序
采用CTAB 法抽提植物基因组DNA,使用Primer3(https://bioinfo.ut.ee/primer3-0.4.0/)网站设计基因特异性扩增引物,具体序列参见表1。特异性PCR 扩增程序:95 ℃预变性3 min;95 ℃变性30 S;58 ℃退火1 min;72 ℃延伸1 min;共循环32次,最后72 ℃延伸5 min。PCR产物电泳后切胶回收,回收后的条带送基因测序公司(Tsingke,北京)进行测序,对测序后的序列进行比对分析。
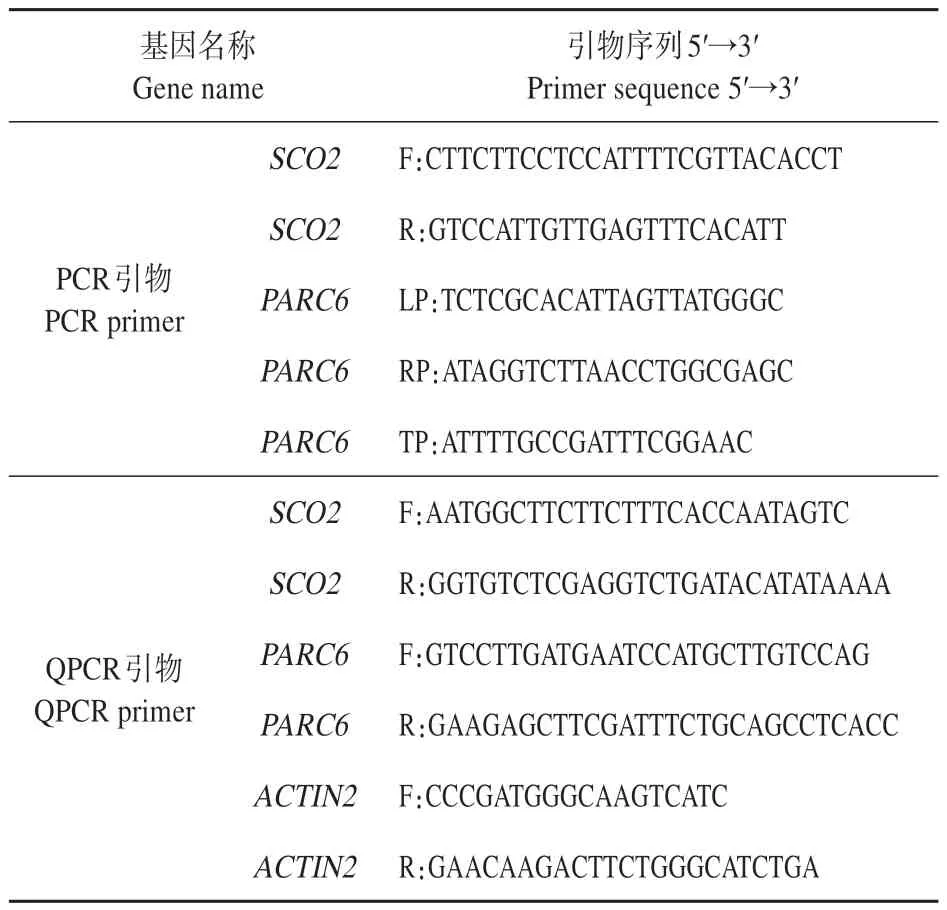
表1 研究中所用引物序列Table 1 Primer sequences involved in this study
1.3 RNA的抽提及QPCR分析
根据试剂说明书,使用TRIZOL(TransGen,北京)从植物叶片中提取总RNA,用EasyScript 逆转录酶(TransGen,北京)从1 g 总RNA 中合成第一链cDNA,并作为模板进行后续PCR 扩增。QPCR 采用ABI 7300 plus real-time PCR 系统和SYBR Green Mix(TaKaRa,日本)对每个样品进行3 次重复试验,反应体系为20 μL,其中包括10 μL SYBR Green Mix,正向引物与反向引物各1 μL,DNA模板2 μL,并采用相对定量法(ΔΔCT)评价重复间的定量变异。特异性QPCR 扩增程序为:95 ℃预变性30 s;95 ℃变性5 s;60 ℃退火30 s;共循环40 次。最后,进行融解曲线扩增(60~95 ℃)。所使用的PCR特异性引物参见表1,ACTIN2作为内参基因。
1.4 共聚焦显微镜及叶绿素荧光观察
使用激光共聚焦显微镜(Leica SP8,德国)在激发光为488 nm处观察生长14 d的拟南芥幼苗子叶和真叶的叶绿体形态;使用Fluor Cam800-C(Photon System Instruments,捷克)型叶绿素荧光仪测定在黑暗中适应30 min 的拟南芥幼苗的光系统II光合荧光参数。
1.5 叶绿素含量测定
称取2 g 新鲜植物叶片,浸泡于2 mL 80%丙酮溶液中,置于37 ℃环境中过夜,待叶片变为透明无色后,常温下12 000 r·min-1离心5 min。取1 mL离心后上清液于石英比色皿中,使用Nanodrop 2 000(Thermo,美国)分光光度计测量上清液在663 nm 及645 nm 处的吸收峰,根据测量数值计算样品叶绿素含量。每个样品测量3 次,并进行3 次生物学重复。
1.6 不同质量浓度蔗糖梯度设置
向含有8 g·L-1琼脂的½MS 培养基中分别添加0、10、20、40 g·L-1的蔗糖以设置不同的蔗糖梯度。
1.7 叶绿体蛋白的提取,蓝色温和凝胶电泳及二向聚丙烯酰胺凝胶电泳分析
称取20 g 新鲜植物叶片于破碎机中,倒入50 mL 缓冲液1(50 mmol·L-14-羟乙基哌嗪乙磺酸,0.33 mol·L-1山梨醇,10 mmol·L-1乙二胺四乙酸,0.5 g 牛血清白蛋白),破碎植物组织。将破碎后的混合液用2 μm 滤膜(Millipore,美国)进行过滤,弃滤后植物残渣,上清液置于4 ℃条件下7 500 r·min-1离 心10 min,弃 去 上 清 液。使 用50 mL 缓冲液2(50 mmol·L-14-羟乙基哌嗪乙磺酸,0.33 mol·L-1山梨醇)将离心后沉淀进行重悬,4 ℃条件下7 500 r·min-1离心10 min,弃去上清液。使用50 mL缓冲液3(10 mmol·L-14-羟乙基哌嗪乙磺酸)将离心后沉淀进行重悬,4 ℃条件下7 500 r·min-1离心10 min,弃去上清液。使用适量的缓冲液2将沉淀重悬至均匀状态,转移至离心管中保存备用。按照文献[25]中指示的方法将提取得到的叶绿体蛋白进行蓝色温和凝胶电泳(BN-PAGE)及二向聚丙烯酰胺凝胶电泳分析(2D×SDS-PAGE)。
1.8 进化树的构建
以AtPARC6 和AtSCO2 蛋白的氨基酸序列作为目标,利用BLAST 在国家生物技术信息中心(NCBI)数据库中搜索各物种中的同源蛋白序列。以各物种中的同源蛋白全序列在MEGA11[26]软件中采用最大似然法生成系统发育树。生成的系统进化树采用Adobe Illustrator软件进行美化修饰。
1.9 统计分析
使用GraphPad Prism 9(GraphPad Software,美国)进行t检验分析野生型植株与突变型植株各参数间的显著性差异。使用Adobe Illustrator 软件对生成的图表进行格式调整。
2 结果与分析
2.1 sco2与parc6突变株基因型鉴定
为了确认sco2与parc6突变株基因型的纯合,对其进行了基因组普通PCR 及QPCR 的鉴定。SCO2基因包含3 个外显子、2 个内含子及5′非翻译区和3′非翻译区。sco2突变株在第1 个外显子的124 位碱基处存在1 个C 碱基突变为T 碱基,使原本编码的精氨酸突变为终止密码子,导致蛋白编码序列提前终止(图1A~B),同时QPCR 结果显示SCO2基因的表达量显著降低(图1C)。以上结果表明,在sco2突变株中,SCO2基因被完全敲除,并且与同时期野生型对照相比,sco2 突变株表现为子叶白化,生长受阻(图1B)。PARC6基因包含12个外显子,11个内含子及5′非翻译区和3′非翻译区(图1E)。parc6突变株在第2 个外显子处存在1 个T-DNA 插入,利用T-DNA 特异性引物从分离的植株中鉴定出纯合的parc6突变株(图1G),纯合的parc6突变株中PARC6基因的表达量显著降低(图1H)。在表现型方面,parc6突变株与同时期野生型对照相比,叶色上无显著性差异(图1F)。
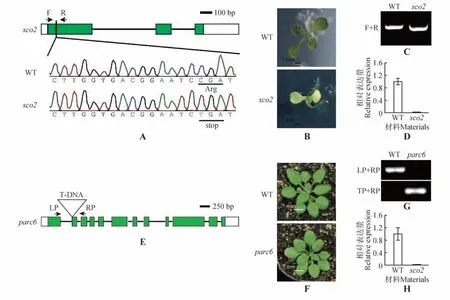
图1 sco2、parc6突变株基因分型及表达量A.SCO2 基因结构模型及DNA 序列突变位点(白色方框代非翻译区,绿色方框代表外显子,线条代表内含子);B.生长8 d 的野生型与sco2突变株的表型;C.野生型和sco2突变株基因组的基因分型及PCR 分析,引物位置在图A 中指示;D.SCO2基因在野生型、sco2突变株中的表达量;E.parc6中T-DNA插入位置及基因结构示意图(白色方框代非翻译区,绿色方框代表外显子,线条代表内含子);F.生长24 d的野生型与parc6突变株的表型;G.野生型和parc6突变株基因组的基因分型及PCR分析,引物位置在图D中显示;H.PARC6基因在野生型、parc6突变株中的表达量Fig.1 Identification of sco2 and parc6 mutants and expression levels A.Model of gene structures and DNA mutation sites of sco2.Exon(sgreen),introns(black line),and untranslated region(swhite)were indicated;B.henotypes of wild type and sco2 mutant after 8 d;C.Genotyping and PCR analysis of genomic DNA isolated from WT and sco2 mutants,primer positions were indicated in figure A;D.Expression of SCO2 gene in WT and sco2 mutants;E.Model of gene structures and positions of T-DNA in the parc6 mutants.Exon(sgreen),intron(sblack line),and untranslated region(swhite)were indicated;F.Phenotypes of wild type and parc6 mutant after 24 d;G.Genotyping and PCR analysis of genomic DNA isolated from WT and parc6 mutants,primer positions were indicated in figure D;H.Expression of PARC6 gene in WT and parc6 mutants
2.2 parc6突变株真叶与子叶叶绿体形态鉴定
为了进一步确认sco2与parc6突变株真叶与子叶的叶绿体形态,利用激光共聚焦显微镜观察叶绿体的自发荧光以显示叶绿体的形态特征。结果显示,sco2与sl2突变株子叶叶绿体异常发育,无法观察其叶绿体形态。与野生型对照相比,sco2突变株真叶叶绿体呈现为正常的椭圆形,sl2突变株真叶叶绿体呈现为巨大的哑铃型,而parc6突变株子叶及真叶的叶绿体都呈现为巨大的哑铃型(图2)。以上结果说明,PARC6基因不仅参与调控真叶的叶绿体分裂,也影响子叶的叶绿体分裂。

图2 激光共聚焦显微镜对不同株系的真叶、子叶叶肉细胞叶绿体形态可视化A.WT子叶;B.WT真叶;C.sco2真叶;D.parc6子叶;E.parc6真叶;F.sl2真叶Fig.2 Visualization of chloroplast morphology of mesophyll cells of leaf and cotyledon in different lines by confocal laser microscopy A.WT cotyledon;B.WT true leaf;C. sco2 true leaf;D.parc6,cotyledon;E.parc6,true leaf;F.sl2,true leaf
2.3 parc6突变株同时影响子叶与真叶的生长
为了确认异常叶绿体分裂是否会同时影响子叶和真叶的发育,利用子叶白化突变株sco2,子叶白化和叶绿体分裂异常双重突变株sl2作为对照,以探究异常叶绿体分裂对子叶和真叶生长的影响程度。结果显示,生长5 d的parc6突变株子叶的大小显著小于其野生型对照,但其子叶生长优于sco2及sl2突变株(图3),同时parc6突变株子叶的鲜质量、叶绿素含量均显著低于野生型,但高于sco2及sl2突变株(图4A~B)。parc6突变株子叶初始叶绿素荧光及最大叶绿素荧光均低于野生型对照,但与sco2及sl2突变株相当;同时其光系统Ⅱ原初光能转化效率(Fv/Fm)也显著低于野生型对照,但高于sl2突变株且与sco2突变株相当,说明parc6突变株子叶光系统Ⅱ的光化学的量子产额显著低于野生型。parc6突变株子叶的非光化学淬灭值(NPQ)则显著高于野生型对照(图4C~D)。以上的结果说明,异常叶绿体分裂会影响子叶的生长发育及其光系统Ⅱ光化学效率,同时其影响程度低于子叶白化突变株。为了明确异常叶绿体分裂对真叶生长的影响,同时排除前期子叶生长的积累效应,将生长10 d的野生型与突变株幼苗的子叶剔除,再选取生长一致的野生型与突变株移至一新的培养基上进行培养。结果显示,parc6突变株真叶的生长也受到显著的影响,其鲜质量、叶绿体含量均显著低于野生型对照,但是其叶绿体荧光参数与野生型对照差异较小(图3)。
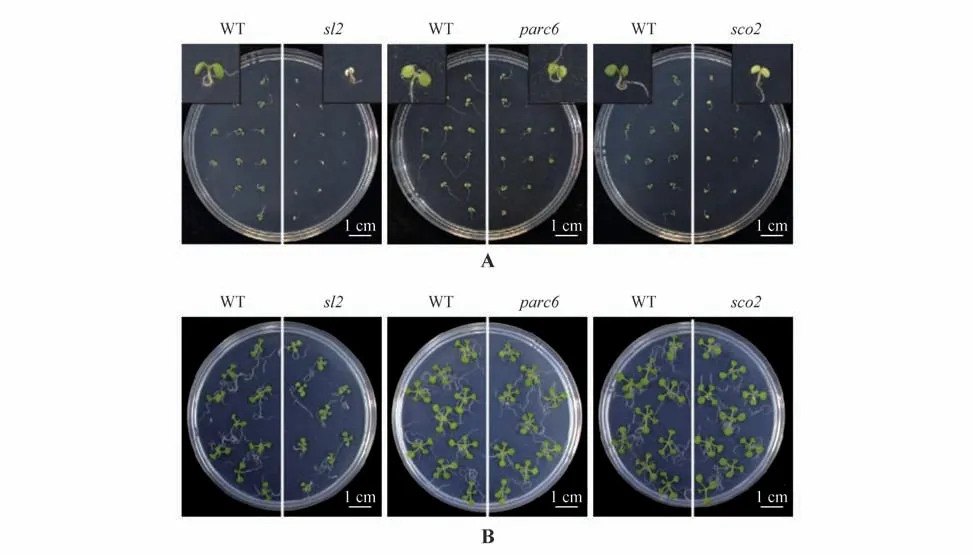
图3 叶绿体分裂异常阻碍子叶与真叶生长A.生长5 d的不同株系子叶表型;B.剔除子叶后生长7 d的不同株系真叶表型Fig.3 Abnormal chloroplast division hindered growth of cotyledon and leaf A.Cotyledon phenotypes of different lines grew after 5 d;B.Leaf phenotype of different lines grew after 7 d and cotyledon removed
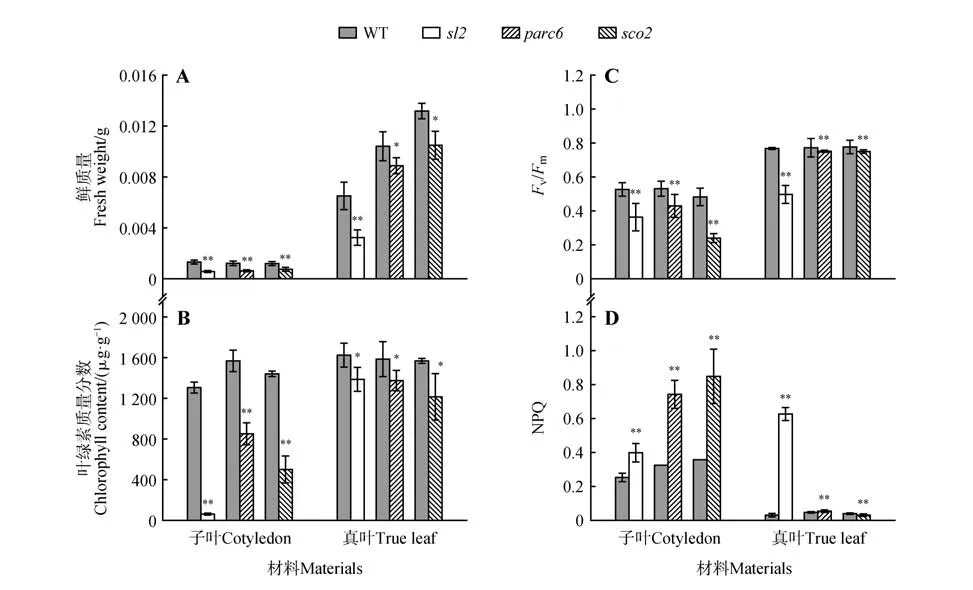
图4 子叶与真叶鲜质量、叶绿素质量分数及光合荧光参数A.植物的鲜质量;B.叶绿素含量;C~D.叶绿素荧光参数;*P<0.05,**P<0.01;下同Fig.4 Fresh weight,chlorophyll content and photosyn-thetic fluorescence parameters of cotyledon and true leaf A-B.The fresh weight and chlorophyll content;C-D.Chlorophyll fluorescence parameters ;*P<0.05,**P<0.0;The same as below
2.4 营养不足导致parc6突变株真叶与子叶生长缺陷
parc6突变株的生长受阻表型可能是由于光系统结构异常而引起的初级缺陷也可能由于正常营养所需能量不足引起的次生效应。为了区分PARC6缺乏引起的初级缺陷和光合作用产物缺乏引起的次生缺陷,本研究向野生型和突变型植物提供不同浓度的蔗糖作为碳源,以支持其正常生长和发育。试验结果显示,在不添加任何碳源的培养基上,parc6突变株表现为生长受阻,且光系统Ⅱ原初光能转化效率显著低于野生型,而非光化学淬灭指数则显著高于野生型(图5)。同时,在不添加任何碳源的培养上,parc6突变株的鲜质量及叶绿素含量也显著低于野生型对照(图6)。然而,随着培养基中蔗糖含量的增加,parc6突变株的光系统Ⅱ的光化学效率增加,且鲜质量和叶绿素含量也显著增加,但与同时期野生型对照仍存在显著差异,同时其叶绿素荧光参数也有所恢复(图5~6)。而生长在含有不同浓度蔗糖上的sco2及sl2突变株随着蔗糖浓度的增加,其鲜质量及叶绿素含量也显著增加,但其叶绿体荧光参数变化不显著(图5~6)。以上结果表明,parc6突变株生长受阻表型可以通过施加碳源得到一定程度的恢复,说明是PARC6 影响子叶与真叶的生长是由于正常所需能量不足而引起的次生效应,而并非其光系统结构异常。

图5 不同质量浓度蔗糖处理后不同株系的表型A.不同株系在正常光照条件下(80 μmol·m2·s-1),含不同质量浓度蔗糖的½MS培养基上生长6 d;B.不同质量浓度蔗糖培养的不同株系的叶绿素荧光参数Fig.5 Effect of different concentrations of sucrose treatment on different lines A.Different lines grew on ½MS medium with different concentrations sucrose after 6 d under normal-light conditions(80 μmol·m2·s-1);B.Chlorophyll fluorescence parameters of different lines grew on different concentrations of sucrose
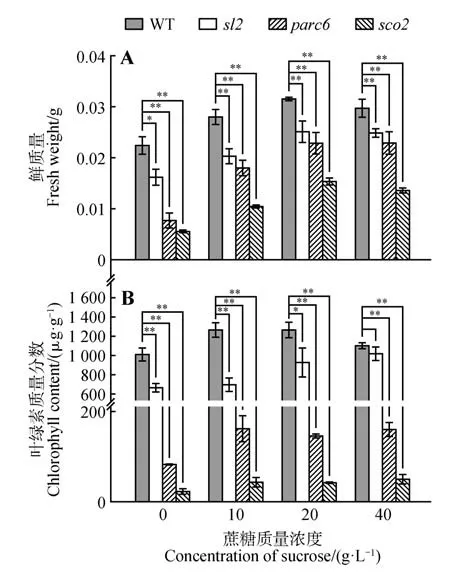
图6 不同质量浓度蔗糖处理后不同株系的鲜质量及叶绿素含量A.不同株系的鲜质量;B.不同质量浓度蔗糖培养的不同株系的叶绿素含量Fig.6 Fresh weight and chlorophyll content of different lines treated with different concentration of sucrose A.All mutants differed significantly from the wild type;B.Chlorophyll content of different lines grew on different concentrations of sucrose
2.5 parc6突变株子叶与真叶光系统组装正常
为了进一步确认parc6突变株子叶与真叶的光系统结构是否正常,对parc6突变株真叶与子叶进行蓝色温和凝胶电泳及二向聚丙烯酰胺凝胶电泳分析。结果显示,与同时期的野生型对照相比,parc6突变株子叶与真叶叶绿体光系统复合物的组装正常,光合系统超级复合体也无显著性差异(图7A)。进一步的二向聚丙烯酰胺凝胶电泳也显示,parc6突变株子叶与真叶光系统核心蛋白具在(图7B)。
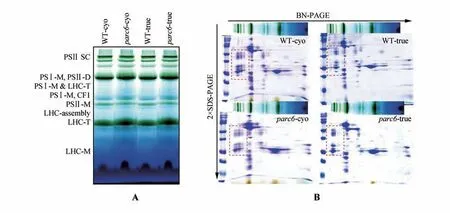
图7 叶绿体类囊体蛋白复合体分析A.生长7 d的野生型及parc6突变株子叶、生长14 d的野生型及parc6突变株真叶叶绿体类囊体蛋白蓝色温和凝胶电泳分析(PSⅡ-SC.光系统Ⅱ超级复合物;PSⅠ-M.光系统Ⅰ单体;PSⅡ-D.光系统Ⅱ二聚体;LHCⅡ.光系统Ⅱ捕光复合物;LHCⅡ-T.光系统Ⅱ捕光复合物三聚体;LHCⅡ monomer.光系统Ⅱ捕光复合物三聚体单体);B.12.5%二向聚丙烯酰胺凝胶电泳,红色虚线框中指示为光系统Ⅱ超级复合体蛋白Fig.7 Analysis of chloroplast thylakoid protein complex A.The thylakoids proteins extracted from 7 d cotyledon of wild type and parc6 mutant and 14 d leaf wild type and parc6 mutant for blue native gel electrophoresis(PSⅡ-SC.PSⅡ super complex;PSⅠ-M.PSⅠ monomer;PSⅡ-D.PSⅡ dimer;LHCⅡ.PSⅡ light-harvesting complex;LHCⅡ-T.PSⅡ light-harvesting complex trimer;LHCⅡ monomer,PSⅡ light-harvesting complex monomer);B.12.5% 2D SDS-PAGE,the red dashed box indicated the photosystem Ⅱ super complex protein
2.6 SCO2与PARC6基因存在共同进化关系
SCO2基因参与拟南芥子叶叶绿体的发育,而PARC6基因参与拟南芥子叶及真叶的叶绿体发育,两者功能存在一定的关联性,且SCO2基因与PARC6基因定位在拟南芥第3 号染色体的相近位置。基于以上事实,可以推测SCO2基因与PARC6基因存在共同进化的趋势。为了确认两者的共同进化关系,查找不同物种中的同源蛋白,构建系统发育树。结果显示,PARC6基因在藻类、苔藓、裸子植物、双子叶植物与单子叶植物中均存在同源基因,说明PARC6基因功能较为保守。SCO2基因也在藻类、苔藓、裸子植物、双子叶植物和单子叶植物中存在同源基因(图8)。并且,在单子叶及双子叶植物中,PARC6与SCO2存在较为相似的系统进化趋势(图8)。

图8 PARC6与SCO2蛋白的无根发育进化树Fig.8 Phylogenetic tree of the rootless development of PARC6 and SCO2 proteins
3 讨论
叶绿体通过光合作用产生有机分子和氧气,直接或间接地为各种各样的生物体提供生长和发育所需的物质,因此叶绿体的起源、发育、分裂和进化一直是研究的热点。目前通过图位克隆技术、现代分子遗传学等技术在拟南芥中已鉴定出一系列参与叶绿体发育、分裂的基因,这些基因的功能已被充分阐述,且功能相关基因的进化速率往往是协变的[27-29]。但目前对于叶绿体分裂的研究主要集中在对其分裂机制的解析方面,而叶绿体分裂对植物的生长发育及植物对环境胁迫响应的影响确鲜有报道。PARC6已被报道是参与叶绿体分裂的重要蛋白,在叶绿体分裂过程的早期通过与ARC3的相互作用参与叶绿体分裂,以保证叶绿体中间环结构的收缩[12-13]。但最新的研究也表明,PARC6 不仅在叶片表皮的所有细胞类型的质体形态建成中起着至关重要的作用[14],也参与影响叶绿体在胁迫条件下的运动[30],这也说明叶绿体异常分裂对植物的影响不仅仅局限于叶绿体的大小。SCO2 已被报道是参与子叶叶绿体发育的重要蛋白,作为一种蛋白二硫异构酶影响编码质体蛋白质基因的表达[20-21]。SCO2 蛋白的发现再次印证了子叶叶绿体与真叶叶绿体存在不同的发育途径。已有的研究指出,叶绿体、线粒体及各类质体的分裂机制较为相似[31],而本次研究表明,在缺失PARC6 蛋白的突变株中,子叶与真叶的叶绿体分裂均存在异常,说明叶绿体分裂机制在子叶和真叶中也较为保守。同时,parc6突变株子叶的鲜质量、叶绿素含量及叶绿素荧光参数都显著低于野生型,稍高于sco2突变株的子叶,说明PARC6蛋白也影响子叶的生长,而且PARC6对子叶生长的影响超过真叶,这可能与子叶叶绿体的发育过程相关。众所周知,子叶最初作为一个储能器官,在缺乏光照的情况下为幼苗提供营养,而在无光照的条件下子叶的质体部分发育(由前质体转化为黄化体)一旦幼苗从土壤中出来并接触到阳光,黄化体就迅速的被转化为叶绿体,从而进行光合作用[2,17,21],这一转变标志着从异养生长到自养生长的主要代谢变化。子叶中完全分化的叶绿体的功能类似于年轻的真叶叶绿体,但是它们通常含有比成熟的真叶叶绿体更少的类囊体膜,类囊体膜是光合作用机器附着的主要场所[32-33]。子叶叶绿体的异常分裂影响了幼苗的自养能力的形成从而阻碍了子叶的正常生长,同时由于子叶含有更少的类囊体膜,异常的叶绿体分裂对其功能的影响表现的更为显著。parc6子叶生长的缺陷可以通过外施碳源得到一定程度的恢复,并且其光合复合体的高级结构正常,这进一步说明是由于自养能力的不足而导致parc6子叶及真叶生长异常。PARC6 与SCO2 共同进化,演变,一定程度上也说明了两者功能的相关性。已有的研究指示出叶绿体结构、数量等因素影响着植物的生长发育,如拟南芥的HDR(4-Hydroxy-3-meyhylbut-2-enyl diphosphate reductase)基因突变后,叶绿体类囊体结构缺失,叶片表现为白化,严重影响叶绿体的功能[34];拟南芥的KASI(b-Ketoacyl-synthaseⅠ)基因突变后,叶绿体的数量显著减少,植物生长受阻,叶绿体功能下降[35]。而本研究表明叶绿体的大小与植物生长也存在密切的联系,这将为研究叶绿体的功能提供一个全新的视角。
