细叶百合Catalase基因的克隆及表达分析
2023-09-09林文昊荆一博金淑梅
宋 煜 林文昊 荆一博 董 懿 金淑梅
(1.东北盐碱植被恢复与重建教育部重点实验室,东北林业大学生命科学学院,哈尔滨 150040;2.东北林业大学奥林学院,哈尔滨150040;3.东北林业大学林学院,哈尔滨 150040)
在盐碱等逆境胁迫下,植物体内产生H2O2,而过量的H2O2导致蛋白质、膜脂、DNA等细胞组分受到严重的损伤,从而对植物产生很强的毒害作用[1-2],植物中抗氧化防御体系主要由抗氧化酶组成。其中,过氧化氢酶是抗氧化酶中首先被发现的,Loew[3]将其命名为Catalase(CAT),Sumner 等[4]从牛肝中首次纯化并结晶得到纯度较高的过氧化氢酶。CAT 主要作用是清除胁迫中产生的过量过氧化氢,避免植物的过氧化损伤,在逆境条件下维持植物体的氧化平衡[5-8],在植物中编码过氧化氢酶CATs 基因家族是一类成员较少的基因家族,并在不同的物种中已有报道,洋葱(Allium cepa)耐盐品种比敏盐品种积累较高的CAT基因转录水平[9],Gondim 等[8]发现,用H2O2喷雾进行预处理,H2O2诱导CAT 活性提高,从而降低盐碱对玉米(Zea mays)幼苗生长的有害影响。Nagamiya 等[10]将大肠杆菌(Escherichia coli)的过氧化氢酶基因在水稻(Oryza sativa)中过表达,有效增强了水稻耐盐碱性。Mittova 等[11]研究表明,盐碱胁迫下耐盐番茄(Lycopersicon pennellii)根部的线粒体中CAT的含量及活性大幅升高。因此作为H2O2清除剂的CAT在植物中起着非常重要的作用。
细叶百合(Lilium pumilum)花朵绮丽,花色鲜红,具有抗盐碱的特性具有很高的园林应用价值。我国东北地区土地盐碱化的问题日益严重,在一定程度上限制了植物的广泛种植与应用,对细叶百合中CAT基因在植物抗盐碱功能上的研究,有助于提高商业百合的应用价值。本研究以细叶百合为研究对象,克隆细叶百合与抗逆性有关的基因CAT,对其进行同源序列比对及进化树分析,检测其在不同逆境处理下的表达特性,表达纯化其蛋白,并进一步构建LpCat过表达基因烟草,研究其在盐碱胁迫下的表达情况和发挥的生物学功能,不仅能为培育耐盐碱的新品种百合提供可利用的基因资源,还能在一定程度上为改善部分地区的土地盐碱化问题提供研究方向。
1 材料与方法
植物材料细叶百合采自松嫩盐碱草地安达野外试验站(44°45′N,123°45′E)。采摘后的植株利用组织培养技术进行植物组织的快繁,产成组培苗,作为试验材料。本氏烟草(Nicotiana plumbaginifolia)为东北盐碱植被恢复与重建教育部重点实验室保存材料。
1.1 Catalase基因开放阅读框的克隆
利用植物提取试剂盒(TaKaRa 公司,北京,中国)提取细叶百合叶的总RNA,反转录试剂盒(Takara 公司,北京,中国)对其进行反转录,获得细叶百合的cDNA,以细叶百合的cDNA为模板,根据细叶百合的转录组数据库序列,设计出1对特异性的上、下 游 引 物(上 游 引 物CatalaseF:5′-ATGGATCCCTACAAGTAC-3′,下 游 引 物CatalaseR:5′-TCACATGCTCGGCTTCAC-3′),进行PCR 扩增,电泳检测PCR 扩增产物的大小正确后,利用胶回收试剂盒(康为世纪公司,泰州,中国)回收目的片段。胶回收的目的片段与pMD18-T 载体在16 ℃过夜进行连接后,热激法转化大肠杆菌DH5α。挑取长势良好的阳性单克隆菌落,PCR 扩增反应进行鉴定,测序,命名为LpCat(L.pumilumCatalase)。
1.2 同源序列比对及进化树分析
测序结果在NCBI 官网(https://www.ncbi.nlm.nih.gov/)中查询出对应基因的ORF 区,利用NCBI官网上的BLAST 功能对获得的氨基酸序列进行分析,得到具有高相似度的其他物种Catalase 氨基酸序列,使用软件DNAMAN 8进行Catalase蛋白的同源氨基酸序列比对与分析。借助MEGA 7 软件构建细叶百合Catalase 蛋白与其同源蛋白的进化树,观察LpCat蛋白与其他物种Catalase蛋白的亲缘关系的远近。
1.3 LpCAT 基因在逆境处理后细叶百合的表达特性
将利用鳞片作为外植体生长6 个月的状态良好、长势一致的细叶百合组培苗移入到1/2 MS 培养基(对照组)和分别含有 20 mmol·L-1NaHCO3和11 mmol·L-1H2O2的1/2 MS 培养基(各处理组),分别胁迫处理6、12、24、36、48 h。利用Trizol 法提取各处理的细叶百合叶片RNA,反转录成cDNA 为模 板,利 用qPCRCATF:5′-CTATTCCCCCTCGCGTTCTC-3′ 和 qPCRCATR:5′-AGCTTCTGACCGAGAGACCT-3′两对引物,Ultra SYBR mixture 荧光染料对CAT基因的表达量进行qPCR 检测:反应体系为20 μL(2×SYBR Green Mix 10.0 μL;10 μmol·L-1上下游引物各0.5 μL;cDNA 模板1.0 μL;ddH2O 8.0 μL);反应条件:95 ℃预变性10 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 1 min,40 个循环。进qPCR 检测LpCat基因在盐碱胁迫及氧化胁迫的表达量变化。细 叶 百 合 内 参 基 因 扩 增 引 物[12]Lpactin F:5′-GCATCACACACCTTCTACAACG-3′和Lpactin R:5′-GAAGAGCATAACCCTCATAGA-3′。每 个 样 品重复3 次,数据经SPSS 17.0 软件进行方差统计分析其相对表达量。
1.4 细叶百合中CAT基因的蛋白表达与纯化
细叶百合中LpCat基因的蛋白表达:在CAT基因ORF 区的上游加上BamH I,下游加上Xhol Ⅰ酶切位点(CAT BamHⅠ F:5′-ggatcCATGGGTGACCTTGCAGT-3′,CAT XholⅠ R:5′-gtcgacTTACAGATCAAAGCTGT-3′),结合到pQE-30 蛋白表达载体BamHⅠ和XholⅠ的酶切位点之间,连接产物转化大肠杆菌DH5α,测序正确的质粒转化大肠杆菌蛋白表达菌株M15 进行蛋白的表达与纯化。菌液在37 ℃,200 r·min-1培养至OD600=0.5,加入1 mmol·L-1IPTG 蛋白诱导剂后培养不同时间(0、0.5、1.0、2.0、3.0、4.0、5.0 h),培养后的菌液经13 000 r·min-1瞬时离心,沉淀用200 μL PBS 缓冲液重悬,30 Hz 超声,9 s 使细胞裂解破碎后,20 μL 样品溶液加20 μL 2×Loading Buffer 缓冲液混匀,煮沸10 min,冰 浴 放 置5 min。4 ℃,13 000 r·min-1,1 min 取20 μL 上清液进行12% SDS-PAGE 蛋白质电泳,电泳结束后经染色、脱色至凝胶透明。
细叶百合中LpCat蛋白纯化:在纯化柱中添加Ni-NTA agarose 纯化树脂,用无菌去离子水清洗。分别在pQE-LpCat的蛋白上清液中加入10 mmol·L-1咪唑,再倒入纯化柱中,置于冰上摇晃充分结合1 h,过滤后保存为复性蛋白。加入2 mL 蛋白清洗缓冲液,充分混匀后过滤保存纯化蛋白加入1 mL 蛋白洗脱缓冲液,充分混匀后过滤保存,重复一次。将以上pQE-CAT的复性蛋白、2 次清洗过滤液、2次洗脱过滤液进行SDS-PAGE电泳检测纯化蛋白。
细叶百合中CAT蛋白抗性:利用pQE-LpCat转化M15的蛋白表达菌液,以pQE-30空载体菌株为对照,待菌液OD600均达到0.5 时,测定在50 mmol·L-1NaHCO3处理下,分别诱导不同时间(0、1、2、3、4、5 h)时,测量携带pQE-LpCat和pQE-30 的M15 菌液的OD600值。
1.5 细叶百合LpCat 基因在过表达烟草植物中的抗性分析
1.5.1 LpCat基因植物表达载体的构建及对烟草的遗传转化和鉴定
添加BamHⅠ/XholⅠ双酶切位点的LpCat质粒和改造后的pBI121 植物表达载体,分别回收相应的片段,T4 连接酶16 ℃过夜连接,连接产物转化大肠杆菌DH5α,提取重组质粒pBI121-LpCat,用电击转化法将双酶切鉴定成功的pBI121-LpCat质粒转化农杆菌(Agrobacterium tumefaciens)菌株EH105中,叶盘法侵染烟草的叶片,选取生长状况良好的Kana 抗性筛选后的转基因烟草叶片提取DNA,使用CatalaseF和CatalaseR进行PCR鉴定。
1.5.2 LpCat 过表达基因烟草的抗盐性分析(表型测定与生理指标)
取长势大小一致的野生型和LpCAT过表达烟草,观 察 在 胁 迫(1 mol·L-1NaHCO3、2.5 mol·L-1H2O2)处理下,LpCat过表达烟草分别与野生型相比生长情况的变化。利用叶绿素计SPAD-502 Plus分别测定在一系列胁迫处理下,野生型、LpCat过表达烟草的叶绿素含量;利用小篮子法测定植物呼吸速率[13];利用过氧化氢试剂盒(南京建成,南京,中国)测定过氧化氢含量;利用硫代巴比妥溶液与紫外风光光度计测定丙二醛的含量[14]。便携式光合作用测定系统(Li-cor 6400XT,美国)被用来测定在一系列的盐碱胁迫处理下,野生型、LpCat过表达烟草的净光合速率,气孔导度,胞间二氧化碳浓度,蒸腾速率。
2 结果与分析
2.1 Catalase基因开放阅读框的克隆
采用改良CTAB 法提取的细叶百合总RNA,利用琼脂糖凝胶电泳进行检测,其18S 条带和28S条带完整且清晰。使用核酸蛋白分析仪检测出总RNA 的浓度为1 023 mg·L-1,OD260/280为1.80,说明提取的总RNA 纯度好,无蛋白污染,浓度高,可以用于反转录。以细叶百合的cDNA 为模板进行PCR 扩增反应,经电泳检测,得到了1 条明亮清晰的长约1 500 bp 的特异性扩增条带(图1),其结果与预期基本一致。将鉴定正确的菌液送至金唯智公司测序,得到LpCat基因的测序长度为1 479 bp。

图1 LpCat基因开放阅读框的克隆M.DL2000;1.克隆出的LpCat基因Fig.1 Cloning of the open reading frame of LpCat gene M.DL2000;1.Cloned LpCat gene
2.2 生物信息学分析
在NCBI 官 网 上 使 用Open Reading Frame Finder 在线软件获得测序基因序列的ORF 区,Lp-Cat 蛋白的Blast 分析结果表明,细叶百合LpCat 蛋白与其他植物Catalase 蛋白的氨基酸序列有较高的相似性,其中与通江百合(L.sargentiae)的Catalase蛋白同源性高达99.39 %。
使用DNAMAN 8 软件将细叶百合Catalase基因的氨基酸序列与通江百合(L.sargentiaeANH22606.1,99.39%)、菠萝(Ananas comosusXP_020084722.1,93.09%)、中国莲(Nelumbo nuciferaOAY65449.1,92.89%)、胡 桃(Juglans regiaXP_018836411.1,91.87%)、油棕(Elaeis guineensisXP_010918244.1,91.87%)、博落回(Macleaya cordataOVA00608.1,92.07%)、西班牙栓皮栎(Quercus suberXP_023920387.1,91.26%)等植物的Catalase 蛋白的氨基酸序列进行对比(图1)。细叶百合Catalase蛋白的氨基酸序列与其它植物Catalase蛋白的一致性高达94.94%,据此推测本试验成功克隆出了细叶百合的LpCat基因。
2.3 细叶百合LpCat的qPCR表达分析
利 用qPCR 检 测20 mmol·L-1NaHCO3和11 mmol·L-1H2O2诱导的5 个时间段中细叶百合叶片组织中LpCat基因的表达水平。结果显示,LpCat基因在20 mmol·L-1NaHCO3逆境处理条件下,12 h时段达到最高峰4.42 后开始下调。该基因在11 mmol·L-1H2O2处理中也有一定表达,表现为于24 h达到最高水平2.64(图2)。

图2 NaHCO(3A)和H2O(2B)诱导细叶百合叶片组织中LpCat基因的表达水平“*”表示显著差异,通过Student’s t-test 检验(P<0.05),±SEM,“*”越多表示差异越大;ns表示不显著差异Fig.2 Expression level of LpCat induced by NaHCO3 and H2O2 in L. pumilum leaf tissues“*”indicated a significant difference,analyzed by Student’s t-tes(tP<0.05),±SEM,“*”indicated a greater difference;ns indicated no significant difference
2.4 Catalase蛋白与同源蛋白的进化树分析
借助NCBI 官网的数据库支持,使用软件MEGA 7构建细叶百合LpCat与其同源蛋白的进化树(图3),发现细叶百合Catalase蛋白与通江百合、菠萝、油棕、拟南芥(Arabidopsis thaliana)等植物的Catalase具有非常相近的亲缘关系。
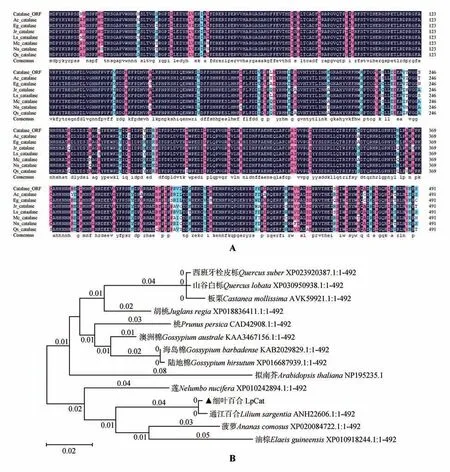
图3 LpCat基因开放阅读框生物信息学分析A.LpCat蛋白的同源氨基酸序列比对分析;B.LpCat与其同源蛋白的进化树分析Fig.3 Bioinformatics analysis of the open reading frame of LpCat gene A.Homologous amino acid sequence alignment analysis of LpCat protein;B.Evolutionary tree analysis of Catalase and its homologous proteins
2.5 重组蛋白pQE30-LpCat的原核表达
挑单克隆过夜摇菌,取2 μL 菌液加入到1 mL LB 培养基中,活化2 h,使菌液OD600的值为0.5 左右。在28 ℃条件下,向菌液中添加终浓度为1.0 mmol·L-1的IPTG 分别诱导0、0.5、1.0、2.0、3.0、4.0、5.0 h后收集菌体,利用SDS-PAGE 电泳和考马斯亮蓝染色等方法检测蛋白表达情况。结果表明在50 kDa附近有明显的诱导条带,s成功诱导表达了细叶百合的LpCat蛋白(图4)。
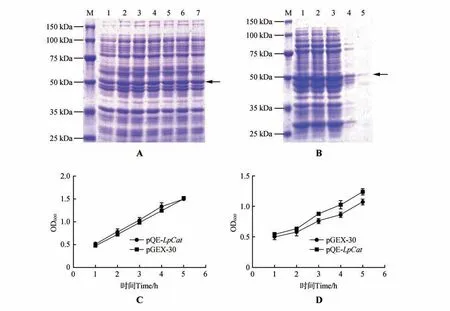
图4 重组蛋白pQE-LpCat蛋白纯化及pQE-LpCat和pQE-30转化菌株的生长曲线A.M.双色预染蛋白分子质量Marker;1~7 分别是诱导0、0.5、1.0、2.0、3.0、4.0、5.0 h;B.M.双色预染蛋白分子质量Marker;1~3.复性蛋白1,复性蛋白2 和复性蛋白3;4~5.pGEX-LpCat 纯化蛋白1 和纯化蛋白2;C.对照条件下pQE-LpCat 或pQE-30 蛋白表达的菌液的生长曲线;D.50 mmol·L-1 NaHCO3处理下pQE-LpCat或pQE-30蛋白表达的菌液的生长曲线Fig.4 Purification of recombinant protein pQE-LpCat and growth curves of pQE-LpCat and pQE-30 transformed bacterial strains A.M.Pre-stained broad molecular weight protein Marker;1-7 were induced 0,0.5,1.0,2.0,3.0,4.0,5.0 h;B.M.Pre-stained broad molecular weight protein Marker;1-3.Recombinant proteins 1-3;4-5.pQEX-LpCat purified proteins 4-5;C.Growth curve of pQE-LpCat or pQE-30 protein expression bacterial solution under control conditions;D.Growth curve of pQE-LpCat or pQE-30 protein expression bacterial solution under 50 mmol·L-1 NaHCO3 treatment
为得到pGEX-LpCat纯化蛋白,将裂解后的蛋白置于有Ni-NTA agarose 纯化树脂的纯化柱中纯化,轻摇1 h 后静置得过滤液“pGEX-LpCat复性蛋白”,重复3次,分别得到复性蛋白1-3,蛋白清洗缓冲液洗脱2 次,蛋白洗脱液缓冲液洗脱2 次得pQE-LpCat纯化蛋白,分别为纯化蛋白1 和纯化蛋白2。最后经SDS-PAGE 电泳后显示,成G 功纯化出目的条带。
在未处理条件下(CK),pQE-LpCat和pQE-30诱导5 h后的OD600值分别等于1.482和1.510相差无几;在50 mmol·L-1NaHCO3处理下,pQE-LpCat和pQE-30 诱导5 h后的菌液OD600值分别等于1.325 和1.113(图4),在50 mmol·L-1NaHCO3胁迫下,LpCAT 蛋白的表达使菌液与对照相比具有较强的耐盐碱能力。
2.6 pCXSN-CAT植物表达载体的鉴定
为了进一步观察细叶百合的过表达基因Lp-CAT对于逆境胁迫的应答反应,首先要构建pBI121-LpCAT植物表达载体,将鉴定成功的植物表达载体转化到大肠杆菌后,提取出质粒,之后用XbaI/SalI 双酶切鉴定,结果显示与目的基因片段相吻合,为1 479 bp。将鉴定正确的重组质粒转化到农杆菌中,浸染烟草植株,以此获得细叶百合LpCAT基因的过表达植株,经共培养及筛选培养后获得待鉴定的LpCAT过表达细叶百合植株,提取过表达细叶百合植株的总DNA 为模板,进行PCR 后,发现株系1~6 都有PCR 产物,说明过表达株系转化成功(图5)。
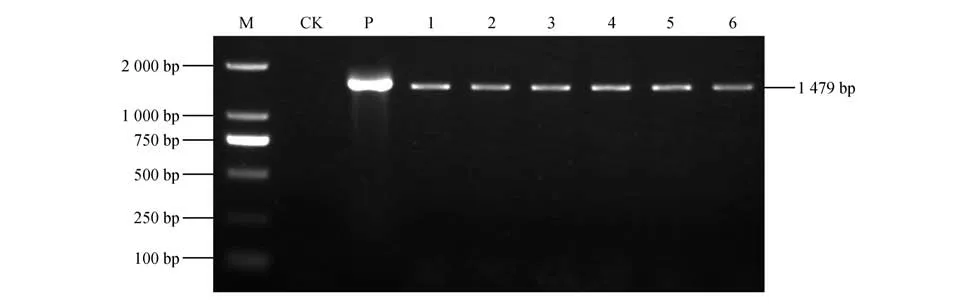
图5 pCXSN-CAT植物表达载体PCR鉴定结果M.DL2000;CK.非转基因植物(阴性对照);P.质粒(阳性对照);1~6.转基因植物Fig.5 PCR identification of pCXSN-CAT plant expression vector M.DL2000;CK.Non-transgenic plan(tnegative control);P.Plasmid(spositive control);1-6.Transgenic plants
2.7 烟草植株在盐碱胁迫处理下的表型分析
取土壤中长势相同的野生型和过表达LpCAT基因的烟草植株株系#1-3,使用逆境(1 mol·L-1NaHCO3、2.5 mol·L-1H2O2)溶液对土壤中生长的烟草进行浇灌,48 h 后观察。结果表明,在逆境胁迫下,烟草开始萎蔫。与野生型相比,过表达LpCAT基因烟草植株枯萎程度相对较低(图6)。据此分析,过表达LpCAT基因烟草植株比野生型烟草植株在表型上更耐逆境。

图6 Catalase基因对2种逆境胁迫下烟草生长情况的影响#1,#2,#3表示LpCAT基因过表达烟草株系1,2,3Fig.6 Effect of Catalase on the growth of tobacco under two stresses#1,2 and 3 indicated LpCAT gene overexpressing tobacco lines 1,2 and 3 respectively
2.8 盐碱胁迫下LpCAT 转基因烟草的生理指标分析
为了探究LpCAT基因和烟草中叶片气体交换参数是否存在关联,使用LI-6400光合仪分别测定对照组 和 经 不 同 处 理(1 mol·L-1NaHCO3、2.5 mol·L-1H2O2)处理48 h 的条件下,野生型和LpCAT过表达烟草的净光合速率(Pn)、气孔导度(Gs)、胞间CO2(Ci)和蒸腾速率(Tr)的变化(图7)。结果显示,在正常条件下野生型和转基因株系的气体交换参数没有显著区别。盐胁迫处理下,野生型和转基因株系烟草叶片中净光合速率、气孔导度、胞间CO2和蒸腾速率均下降,野生型的净光合速率下降尤为显著,在H2O2胁迫下下降了72.1%,由图7 可知与野生型相比,转基因株系的净光合速率、气孔导度、胞间CO2和蒸腾速率均高于野生型,这说明Lp-CAT基因过表达能够有效减缓盐胁迫诱导的叶片气体交换功能降低的现象。

图7 野生型和LpCAT 过表达烟草的净光合速率(A)、气孔导度(B)、胞间CO2(C)和蒸腾速率(D)的变化Fig.7 Changes in net photosynthetic rate(A),stomatal conductance(B),intercellular CO2(C)and transpiration rate(D)in wild-type and LpCAT overexpressing tobacco
使用SPAD 叶绿素测量仪测量,得对照组和经不同盐胁迫下的烟草的叶绿素含量(图8)。结果显示,在植株大小相似,从上到下取相同部位叶片测量时空白对照组的野生型与转基因烟草叶绿素含量相近,经盐处理后的野生型植株叶绿素下降显著,且H2O2和NaHCO3胁迫结果均显示转基因植株的叶绿素含量高于野生型,说明过表达LpCAT植株耐盐性高于野生型植株。
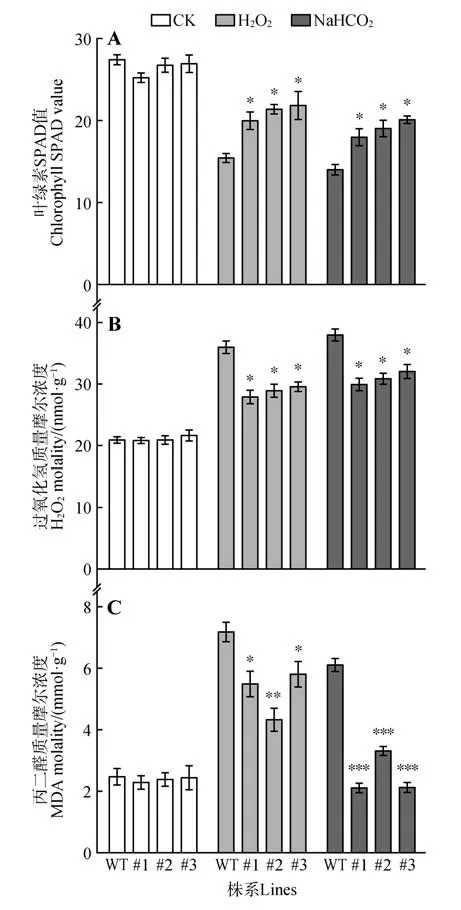
图8 盐胁迫下野生型和LpCAT 过表达烟草的叶绿素SPAD值(A),H2O(2B)及丙二醛(C)质量摩尔浓度SPAD 值表示用SPAD 仪得到的叶绿素相关的读数,SPAD 值与提取出的叶绿素含量之间存在线性相关关系Fig.8 Chlorophyll SPAD value(sA),H2O(2B)and MDA(C)molality of wild-type and Lp-CAT overexpressing tobacco under salt stress SPAD values represented chlorophyll-related readings obtained by a SPAD meter.There was a linear correlation between SPAD values and extracted chlorophyll content
为确定LpCAT基因对盐胁迫下活性氧的积累的影响,使用试剂盒测量得到了野生型和转基因植株在对照和盐胁迫下的H2O2含量(图8)。结果表明,在未经盐胁迫时野生型和转基因株系中的H2O2含量相似;经过盐胁迫后的株系中H2O2含量均有增加,且野生型株系H2O2含量都高于转基因株系,野生型株系在盐胁迫下H2O2积累量显著高于转基因株系,对盐胁迫较为敏感;转基因株系积累了较少的H2O2,对盐胁迫具有抗性。
为确定高活性氧(ROS)积累是否与细胞损伤有关,本研究检测了烟草不同株系在盐胁迫下产生的丙二醛(MDA)含量(图8)。结果表明,ROS水平较高的野生型MDA 显著积累,而ROS 含量较低的转基因株系MDA 表达量也较低。这表明盐胁迫可引起植物体内活性氧的大量积累,LpCAT基因的存在可降低活性氧的积累,减轻植物损伤。
3 讨论
CAT 是清除H2O2的酶中最快且表达最强的,在不同的生理过程和不同的发育阶段参与H2O2的清除[15]。植物过氧化氢酶被分为3类,Ⅰ类过氧化氢酶在光合组织中表达,Ⅱ类过氧化氢酶与维管组织有关,Ⅲ类过氧化氢酶在种子和生殖组织中显著表达[16-17]。拟南芥中的过氧化氢酶基因分别为CAT1、CAT2、CAT3,分别对应于Ⅲ类、Ⅰ类和Ⅱ类过氧化氢酶[17-18]。通过NCBI 数据库BLAST 的程序,发现LpCAT蛋白与拟南芥的CAT2亲缘关系较近,说明LpCAT基因属于Ⅰ类过氧化氢酶。
ZmCAT1、ZmCAT2和ZmCAT3在玉米生长发育阶段有较高表达量[19],CAT2基因在烟草NC89的根、茎、叶、花瓣、花萼和种子中均有表达,其中在花中相对表达量最高,其次为叶、茎、种子和根[20]。LoCAT1基因在长白落叶松(Larix olgensis)的根、茎、叶中均有表达其中在茎部表达量最低,在叶中相对表达量最高[21]。本研究就选择了观察细叶百合叶片的LpCAT基因在植物受到胁迫处理后的表达方式。
在NaCl处理后,根和茎中LoCAT1基因均表现为下调表达,在12 h 时表达量最低,而叶中Lo-CAT1基因表达在24 h 明显受抑制,随后被上调表达,胁迫96 h 时表达量最高。LoCAT1 可参与催化叶片光呼吸中产生的H2O2的分解作用,使机体免受H2O2毒害[21]。大豆(Glycine max)CAT家族成员在叶和开放的花中的表达量较高;荧光定量PCR分析表明,在盐、干旱及缺氧胁迫后GmCATS基因表达量升高,且盐和干旱胁迫下根中的响应较叶片更显著[22]。烟草和银杏(Ginkgo biloba)在高盐和干旱的胁迫下,CAT1基因表达量上调,参与植物抵御逆境胁迫[23-24]。高羊茅(Festuca arundinacea)FaCAT1 基因在植株叶片受到高盐处理4 h 后时,FaCAT1基因的表达量增加到最大,来清除活性氧造成的损害[25],说明CAT基因会在植物受到盐胁迫的情况下,表达量有所变化,LpCAT受到盐胁迫后,表达量会有怎么样的变化呢,通过研究发现,LpCAT在受到胁迫12或24 h 后,表达量达到最大值,说明在逆境处理的很短时间,LpCAT就发挥了作用。
CAT基因的过量表达会提高植物的抗逆性,如过量表达的水稻过氧化氢酶基因OsCATb提高大肠杆菌对不同重金属逆境胁迫的耐受性[26]。转盐穗木(Halostrachys caspica)过氧化氢酶基因Hc-CAT1的大肠杆菌,可明显提高其耐盐性[27]。本研究过量表达细叶百合LpCAT基因的大肠杆菌相对于对照的菌株,也明显地提高了菌液的抗盐性。这初步说明LpCAT基因与盐碱有一定的应答关系。拟南芥CAT基因中,只有缺少CAT2会导致生长抑制和叶片中H2O2的显著积累。CAT2突变体的根系生长受到抑制,而CAT1或CAT3的突变则没有类似的表型[28]。这说明Ⅰ类过氧化氢酶对叶片中的H2O2清除作用相对其他2 类的作用要大些。CAT 作为信号分子介导多种植物的盐胁迫反应[29],植物受到伤害,会抑制CAT 活力,使植物体内过氧化氢的含量升高,此时过氧化氢能够放大胁迫信号,是植物体对胁迫产生快速反应的基础[30]。蓝藻(AnabaenaPCC 7120)CAT基因的过量表达可提高植物的抗高盐能力[31]。水稻幼苗受到盐胁迫后促使H2O2积累,而过表达OsCatC可提高其CAT活性,降低体内H2O2的含量,从而提高其盐和氧化胁迫的耐受性[32]。盐胁迫对桉树(Eucalyptus robusta)活性氧代谢和CAT基因表达的影响,6个CAT基因在不同盐胁迫强度下的转录变化差异显著,响应机制不尽相同[33]。这些研究说明,CAT基因在植物中发挥重要的作用。为了验证LpCAT基因同样对细叶百合的耐盐碱性发挥重要的功能,构建了过表达植物表达载体,通过遗传转化的方法在烟草中过表达LpCAT基因,通过表型观察和测量生理指标,过表LpCAT基因的烟草的逆境耐性要高于野生型烟草,这表示LpCAT基因具有一定的提高植物的耐逆境胁迫能力。本研究将为揭示细叶百合对盐碱逆境的分子机制及百合抗盐分子育种奠定一定的理论基础。
附录:

细叶百合Catalase基因序列及氨基酸序列Gene Sequence and Amino Acid Sequence of L. pumilum Catalase
