LED蓝色光照结合气调包装不同品种荔枝采后品质的比较
2023-09-09蒋汉蓉陈于陇陈飞平周子康张嘉骏罗政
蒋汉蓉,陈于陇,陈飞平,周子康,张嘉骏,罗政
(1.广东省农业科学院蚕业与农产品加工研究所,农业农村部功能食品重点实验室,广东省农产品加工重点实验室,广东广州 510610)(2.仲恺农业工程学院农业与生物学院,广东广州 510225)
荔枝(Litchi chinensisSonn.)是一种亚热带水果,广泛种植于我国的广东、福建等地区。成熟的荔枝不仅外表色泽鲜艳,果肉晶莹剔透饱满,且具有较高的食用价值以及药用价值,因此在市场上深受消费者的追捧[1]。荔枝在采摘后,常温下贮藏其生理代谢依旧旺盛,从而加速了果肉水分散失以及营养物质的减少,导致褐变的发生以及最终果实的腐烂[2];此外由于采摘、运输中会不可避免地发生机械损伤,也会影响荔枝的商品价值[3]。因此,开发一种安全且高效的荔枝采后贮藏保鲜技术,对减少在荔枝采后所造成的损失、保证荔枝的品质以及经济价值的具有重要的意义。
荔枝采后保鲜主要方法之一是冷藏保鲜,近年来,基于冷藏并结合其他方法来进一步提高荔枝的锁鲜技术研究已成为热点。孙钦菊等[4]利用普鲁兰多糖复合液涂膜处理荔枝进行低温贮藏研究发现,可以明显抑制可溶性固形物、可滴定酸、维生素C等营养物质的减少速率,并在14 d后仍可保持好果状态;潘家丽等[5]利用外源H2O2处理荔枝进行低温贮藏后发现,选择浓度为5 mol/L的外源H2O2可以降低果皮中的MDA含量及PPO活性,并提高SOD活性,从而有效延缓了果实的褐变速率;谢晶等[6]在4 ℃低温贮藏条件下使用外源褪黑素也可以有效减缓花青素含量的降低并保持较高的CAT以及SOD酶活性,保持好果率;谢玉花等[7]研究发现选择1.2 kGy剂量进行辐照能保持荔枝中总酚、花色苷等含量并抑制PPO、POD活性,使其减少水分散失并延缓褐变。徐锦洋等[8]发现在低温贮藏条件下自发气调袋能更有效抑制POD、PAL活性,减缓褐变指数,有效抑制竹笋贮藏期间的木质化、褐变等现象,维持竹鲜笋贮藏期间的品质,具备更好的保鲜效果。
LED光具有安全、节能、简便等特点,对采后贮运中的蔬菜具有较好的保鲜效果[9,10]。其中,单色蓝光可以起到延缓果蔬衰老以及增加营养物质的效果,提高果实品质。有研究发现,在蓝光处理番茄后能有效增加抗氧化酶活性,维持果实原有的色泽、硬度和风味[11];甜樱桃在蓝光照射后体内的花青素能显著积累[12];苹果蓝光照射后其绿原酸和总黄酮醇含量均有所增加,保证了色泽和品质[13]。但低温贮藏条件下结合气调包装,探索LED蓝色光照对不同品种气调包装荔枝采后褐变的影响研究还未见报道,具备一定的实用性和创新性。
因此,本研究运用LED单色蓝光对贮藏于4 ℃冷库中的不同品种气调包装荔枝进行每日12 h的照射处理,并在第0、2、4、6和8天对不同样品的各项指标进行测定,探究LED灯单色蓝光对采后荔枝生理指标的影响,以期为荔枝的采后绿色保鲜技术研发提供理论依据。
1 材料与方法
1.1 实验材料
妃子笑、糯米糍、桂味荔枝品种果实(大小一致、色泽统一、无褐变与损伤,保留有新鲜完整枝叶)分别于2022年6月11日、7月6日、7月15日购买自广州市天河区天平架农贸市场,当天运送回实验室(广州蚕业与农产品加工研究所)。
1.2 包装材料
MP20气调包装袋:厚度20 μm,O2渗透率11 643 cm3/(m2·d·atm),水蒸气透过率62.586 g/(m2·d),规格为35 cm×25 cm。
1.3 试剂与仪器
JJ1000电子秤,常熟市双杰测试仪器厂;Millipore Elix纯水仪,德国Merck Millipore公司;四位磁力搅拌水浴锅,常州澳华仪器有限公司;BioTek多功能酶标仪,广州吉源生物科技有限公司;JW-1042低速离心机,安徽嘉文仪器装备有限公司905GP-ULTS超低温冰箱:美国Thermo Fisher Scientific公司。
试剂:液氮:购自佛山市普雷克斯公司;邻苯二酚、愈创木酚、天津市福晨化学试剂厂;原花青素标准品:上海源叶生物科技有限公司;其他所用试剂皆为国产分析纯。
1.4 实验处理
荔枝采摘后当天运回保鲜实验室,保留完整新鲜枝叶,并于实验室4 ℃冷库用气调袋包装后进行贮藏,以每天12 h的LED蓝光(光谱(465±5) nm,主波长为(449±5) nm,光照强度(110±5) lx)照射包装荔枝作为光照处理组,并以避光贮藏作为对照组。每个包装袋选择30颗果,每2 d对样品进行取样。将每袋荔枝果实的果皮和果肉分开处理,果肉汁液用来测定荔枝果实可溶性固形物和可滴定酸含量变化;将荔枝果皮剥离混合均匀,经液氮快速冷冻后打碎成新鲜粉末状,然后储存于-80 ℃超低温冰箱,用于后期丙二醛等相关指标测定。
1.5 指标测定
1.5.1 褐变指数
果皮褐变指数参考林艺芬等[14]的方法,稍有改动。荔枝果皮褐变通过目测将荔枝果皮褐变面积分5级:0级,果实全红,果皮无明显褐斑;1级,果皮轻微褐变(<5%);2级,褐变或褐变面积5%~25%;3级,褐变或褐变面积25%~50%;4级,褐变或褐变面积>50%。
式中:
A——荔枝果皮褐变指数;
a——褐变级数;
d——对应褐变级果数;
D——总果数。
1.5.2 TSS和TA含量测定
参考曹建康等[15]的方法,将荔枝果实剥皮去核,每颗取1/3果肉,榨汁过滤,混合均匀,静置片刻,在数显糖度计检测镜面凹槽处滴加荔枝果肉汁液6~7滴,按下start读取并记录数据得TSS值,即为可溶性固形物的值(Brix)。在此基础上吸取100 μL汁液,稀释50倍,测定并记录,得到荔枝的TA值,即为可滴定酸含量。重复5次。
1.5.3 总酚含量测定
参考曹建康等[15]的方法,稍作修改。称取0.2 g果皮组织,加入少许经预冷的质量分数为1%的盐酸甲醇溶液,在冰浴条件下研磨匀浆后,转入8 mL刻度试管中。用质量分数为1%的盐酸甲醇溶液冲吸研钵,一并转移到试管中,定容至刻度,混匀,于4 ℃避光提取20 min,期间摇动数次,然后过滤,收集滤液待用。以质量分数为1%的盐酸甲醇溶液作空白参比调零,于波长280 nm处测定吸光值,重复三次,最后,将吸光值代入标曲y=0.051 5x+3.325 9,R2=0.999 1,结果mg/g表示每克(鲜质量)果蔬组织的总酚含量。
1.5.4 花青素含量测定
参考曹建康等[15]的方法,稍作修改。称取0.2 g果皮组织,加入少许经预冷的质量分数为1%的盐酸甲醇溶液,在冰浴条件下研磨匀浆后,转入8 mL刻度试管中。用质量分数为1%的盐酸甲醇溶液冲吸研钵,一并转移到试管中,定容至刻度,混匀,于4 ℃避光提取20 min,期间摇动数次,然后过滤,收集滤液待用。以质量分数为1%的盐酸甲醇溶液作空白参比调零,在波长530 nm和600 nm处吸光值之差表示花青素含量,重复三次,将吸光值代入标曲y=0.074 7x+0.000 9,R2=0.999 7,结果%表示每克(鲜重)果蔬组织的原花青素含量。
1.5.5 丙二醛含量测定
参考曹建康等[15]的方法,稍作修改。取1 mL上清液,加入1 mL质量分数为0.67%的TBA溶液于5 mL离心管中,充分混合后在沸水浴中煮沸20 min,冷却后于4 ℃、10 000 r/min离心10 min。然后在450、532和600 nm处测定上清液吸光值。重复5次。
1.5.6 多酚氧化酶(PPO)活性测定
参考Wang[16]的方法,略作修改。称取0.5 g荔枝样品,加4 mL磷酸盐缓冲液(浓度为0.05 mol/L,pH值7.8),加0.2 g不溶性聚乙烯吡咯烷酮。在4 ℃,8 000g离心30 min,离心后上清液用作粗酶提取液。测定PPO活性:通过分别加入2.3 mL磷酸盐缓冲液(PBS,浓度为0.05 mol/L,pH值7.0)和0.2 mL粗酶提取物,制成总3.0 mL反应溶液预先将邻苯二酚与PBS混合,然后加入上清液,立即使用分光光度计在25 ℃下测量3 min内420 nm处的吸光度变化,重复三次。
1.5.7 过氧化物酶(POD)活性测定
参考Shi等[17]的方法,稍作修改。每次测定均使用果肉或萼片冷冻组织(1 g),离心条件为12 000g,在4 ℃下持续20 min,然后提取上清液进行分析。使用0.9 mL质量分数为0.2%的愈创木酚和1 mL质量分数为0.3% H2O2,测定POD活性。在470 nm(POD)条件下,在1 min内测定吸光度的增加,并将在1 min内的分析条件下导致吸光度增加所需的酶量定义为一个活性单位,重复三次。
1.6 数据统计与分析
使用Origin 2018绘图及SPSS Statistics 27进行数据分析。
2 结果与分析
2.1 LED蓝色光照对不同品种荔枝褐变指数的影响
褐变是采后衰老的标志,荔枝果皮的快速褐变是导致荔枝品质下降、销售量下滑的主要原因[18]。如图1所示,在冷藏条件下,不同品种荔枝的褐变系数,随着贮藏时间的增加而上升,糯米糍(图1a)褐变较快,而桂味(图1a)和妃子笑(图1c)褐变较慢,这与前人研究结果一致[19]。在三个荔枝品种中,桂味(图1a)褐变程度最慢,其在第8天的褐变系数为0.47,而灯光照射后仅为0.37;妃子笑(图1c)的褐变也较慢,且在蓝光照射处理的第6天其褐变系数仅为0.23,取得的效果比其他品种更佳;三个品种中褐变系数增加最快的是糯米糍(图1b),其在第8天时已高达2.15,抑制的作用稍微微弱于其他两个品种,在蓝光照射处理后有所降低。这是由于荔枝品种的不同,其褐变的速率并不一致导致的[20,21]。并且褐变与营养物质含量以及其他生理活动有关,因此在LED蓝光照射处理同一物种的不同品种后,其变化趋势等也可能存在差异[13]。在单色蓝光照射后,褐变系数均低于未进行单色蓝光照射后的荔枝褐变系数,这表明LED单色蓝光照射处理可以有效抑制荔枝的褐变。

图1 LED蓝色光照对不同品种荔枝褐变指数的影响Fig.1 Effect of LED blue light on browning index of different litchi varieties
2.2 LED蓝色光照对不同品种荔枝TSS含量的影响
荔枝采后会消耗自身的营养物质,其中的可溶性固形物(TSS)的含量也会随着储藏时间的增加而逐渐减少[22]。如图2所示,不同品种荔枝的可溶性固形物随着储藏时间和照射时间的增加均表现出下降的趋势。桂味(图2a)在蓝光照射后的第8天显著高于对照(P<0.05),达到了18 Brix;糯米糍(图2b)均高于对照组,在第4天时可溶性固形物含量显著高于对照(P<0.05),为16.83 Brix;妃子笑(图2c)在持续蓝光照射处理的第6天可溶性固形物含量为14.43 Brix,略高于对照组。在整个冷藏期间,不同品种荔枝在进行单色蓝光照射后的可溶性固形物含量均高于对照组,这表明LED单色蓝光照射处理可以有效抑制荔枝可溶性固形物的分解。这与吴根良等[23]发现蓝光有利于果实可溶性固形物的形成这一研究结论一致。

图2 LED蓝色光照对不同品种荔枝TSS含量的影响Fig.2 Effect of LED blue light on TSS content of litchi varieties
2.3 LED蓝色光照对不同品种荔枝TA含量的影响
可滴定酸(TA)是果实品质的重要性状之一,是影响果实风味品质的重要因素[24]。如图3所示,不同品种荔枝随储藏时间的延长可滴定酸出现先降后升的趋势。在单色蓝光照射后,桂味(图3a)可滴定酸含量于第2天达到最低值0.83%,糯米糍(图3b)可滴定酸于第4天达到最低值0.58%,妃子笑(图3c)可滴定酸则在第4天达到最低值0.85%。在整个储藏期间,LED单色蓝光照射后的荔枝其可溶性滴定酸含量均低于对照组,这表明LED单色蓝光照射处理可以有效抑制荔枝可滴定酸的升高。这与吴根良等[23]发现蓝光有利于果实可滴定酸的合成这一研究结论一致。有研究表明,蓝光可以延缓鲜切甜瓜可滴定酸含量的增加,有利于果实原有酸度[25]。

图3 LED蓝色光照对不同品种荔枝TA含量的影响Fig.3 Effect of LED blue light on TA content in different litchi varieties
2.4 LED蓝色光照对不同品种荔枝总酚含量的影响
总酚作为酶促褐变的底物,在PPO和POD的作用下,逐渐被消耗,转化为黑褐色的醌,导致含量下降[26]。如图4所示,不同品种荔枝的总酚含量在随贮藏时间的延长呈现出逐渐下降的趋势。桂味(图4a)在灯光照射后其总酚在前8天均较对照组显著增加(P<0.01),在第8天时总酚含量为0.525 mg/g;糯米糍(图4b)在灯光照射的整个阶段较对照组均显著增加(P<0.05),在第8天时总酚含量为0.57 mg/g;与对照相比,妃子笑(图4c)在灯光照射后其总酚含量均有所上升,其中在第6天时达到0.028 mg/g。在整个冷藏期间,不同品种荔枝的LED灯蓝色单色光处理组的总酚含量均高于对照组,这表明LED单色蓝光照射处可以抑制总酚含量的减少,延缓了总酚的消耗,从而抑制酶促褐变的进行,而利用电子束辐照处理也可以有效延缓荔枝中总酚含量的下降[7]。有研究表明,LED处理提高了叶和根提取物中总酚和类黄酮的水平,蓝色LED处理可以显著提高叶片和根部抗氧化酶活性[27]。

图4 LED蓝色光照对不同品种荔枝总酚含量的影响Fig.4 Effect of LED blue light on total phenolic content of different litchi varieties
2.5 LED蓝色光照对不同品种荔枝花青素含量的影响
花青素(LPCs)是荔枝中重要的营养物质之一,具备较强的抗氧化能力。如图5所示,未进行单色蓝光照射的荔枝的花青素含量在随储藏时间的延长,呈现出逐渐下降的趋势。在冷藏的第2天,进行单色蓝光照射的荔枝花青素含量均显著高于对照(P<0.05),也高于第0天时候荔枝的花青素含量,随后逐渐呈现下降趋势。这可能是因为在果实成熟后期蓝光诱导的花青素合成正调控转录因子和下游结构基因表达水平下降,导致花青素生物合成相对其降解减少[28]。在整个冷藏期间,不同品种荔枝的LED灯蓝色单色光处理组的花青素含量均高于对照组,这表明LED单色蓝光照射处理可以有效抑制荔枝花青素的降解。有研究已经表明,LED灯单色蓝光可以诱导花青素合成相关基因表达并促进花青素积累[28]。这与李莹等[29]对番茄果实进行补光,花青素含量在照射蓝光时达到最大值结论一致。
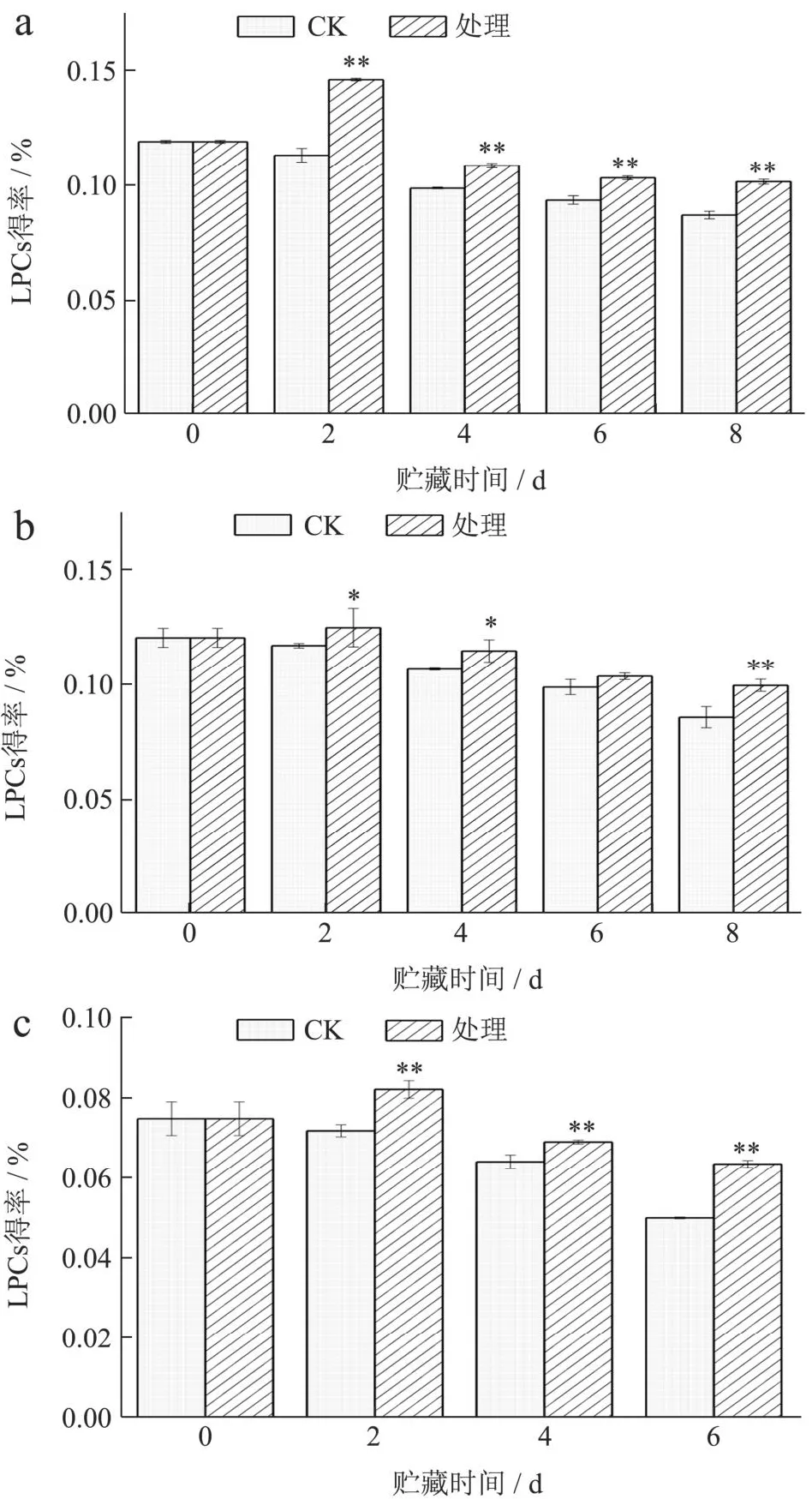
图5 LED蓝色光照对不同品种荔枝花青素含量的影响Fig.5 Effects of LED blue light on anthocyanin content in different litchi varieties
2.6 LED蓝色光照对不同品种荔枝MDA含量的影响
丙二醛(MDA)浓度的变化可以反映细胞的脂质过氧化情况,MDA的积累可导致膜的氧化损伤,因此可作为荔枝采后损伤的一个重要指标。如图6所示,不同品种荔枝的MDA浓度随着贮藏时间的延长而逐渐增加,细胞的氧化损伤加剧导致荔枝逐渐褐变。在桂味冷藏的第6天,其对照组MDA含量显著高于蓝光照射组(P<0.01),是处理组的1.32倍(图6a);在糯米糍(图6b)冷藏的第8天,蓝光照射组的MDA含量是0.01 μmol/g,显著低于对照组(P<0.01);在妃子笑冷藏的第4天,蓝光照射组的MDA含量显著低于对照组(P<0.01),仅为0.01 μmol/g(图6c)。在整个冷藏期间,不同品种荔枝的LED灯蓝色单色光处理组的MDA含量均低于对照组,这表明LED单色蓝光照射处可以有效抑制MDA的积累从而保护膜的完整性,减少荔枝的采后损伤。这与史君彦等[30]利用LED单色蓝光照射豇豆取得的研究结果相似。

图6 LED蓝色光照对不同品种荔枝MDA含量的影响Fig.6 Effects of LED blue light on MDA content in different litchi varieties
2.7 LED蓝色光照对不同品种荔枝PPO活性的影响
多酚氧化酶(PPO)在有氧条件下可将内源性多酚物质氧化为醌类物质,这类物质聚合产生黑色素,从而引起荔枝褐变[31]。多酚氧化酶引起的是酶促褐变,活性越高说明褐变得越快。如图7所示,不同品种的多酚氧化酶活性在随贮藏时间的延长呈现出不同的变化趋势,其中桂味(图7a)呈现先降后升趋势,在冷藏的第2、4、8天,处理组的多酚氧化酶活性均显著低于对照组(P<0.01);糯米糍(图7b)呈现先降后升再降趋势,在蓝光照射后其过氧化物酶活性均显著低于对照组(P<0.01);妃子笑(图7c)则呈现先升后降趋势,在冷藏的第6天,处理组的多酚氧化酶活性均显著低于对照组(P<0.01)。在整个冷库储藏时间里,LED单色蓝光照射后的荔枝多酚氧化酶活性均低于对照组,这表明LED单色蓝光照射处理可以有效抑制荔枝多酚氧化酶活性的升高。

图7 LED蓝色光照对不同品种荔枝PPO活性的影响Fig.7 Effect of LED blue light on PPO activity of different litchi varieties
2.8 LED蓝色光照对不同品种荔枝POD活性的影响
过氧化物酶(POD)可以催化总酚,是荔枝酶促褐变的关键酶之一[32]。如图8所示,桂味(图8a)、糯米糍(图8b)呈现逐渐上升趋势,妃子笑(图8c)则呈先升后降再升的趋势。在蓝光持续照射第4、6、8天,桂味的过氧化物酶活性均显著低于对照(图8a)(P<0.05);糯米糍在蓝光照射后其过氧化物酶活性均显著降低(图8b);妃子笑在蓝光照射后其过氧化物酶活性均显著低于对照组(图8c),并在第4天达到最低值21.36 U/g FW(图8c)。在整个冷藏期间,蓝光照射后的荔枝过氧化物酶均低于对照组,这表明LED单色蓝光照射可以有效抑制荔枝中过氧化物酶活性的升高。有研究表明,LED处理保持了较低的呼吸速率、丙二醛含量和多酚氧化酶活性,延长菊花的保质期[33]。

图8 LED蓝色光照对不同品种荔枝POD活性的影响Fig.8 Effect of LED blue light on POD activity of different litchi varieties
3 结论
本研究主要探讨了LED蓝光结合气调包装对不同品种荔枝采后品质的影响。结果表明,在低温贮藏条件下气调包装结合LED单色蓝光处理能有效抑制不同品种荔枝的劣变,相较避光处理,蓝色光照下包装荔枝的MDA含量显著下降,延缓了花青素、总酚及可溶性固形物含量的降解,抑制了PPO和POD的活性。因此,在低温冷藏条件下,LED单色蓝光照射结合气调包装可以有效抑制不同品种荔枝保鲜品质的劣变。这一研究也为荔枝的采后保鲜技术研发提供了一定的参考。
