内质网应激在脓毒症中的研究进展
2023-09-09於江泉张文娟
石 颖, 於江泉, 张文娟
(江苏省苏北人民医院 重症医学科, 江苏 扬州, 225002)
脓毒症是一种复杂异质性疾病,被定义为宿主对感染的反应失调,引起危及生命的急性器官功能障碍[1]。脓毒症的发病率高,全球每年约有5 000万人罹患该病,病死率为5%~40%[2]。脓毒症治疗花费高,且目前的治疗手段依然有限,世界卫生大会和世界卫生组织于2017年将脓毒症列为全球卫生优先事项[3]。脓毒症并发的多脏器功能障碍(MODS)是造成患者死亡的主要原因,其病理生理过程是复杂和多因素的。目前普遍认为,促炎和抗炎细胞因子失衡在MODS中起着重要作用,而失调的免疫反应是MODS病理生理学的核心。此外,细胞氧利用率降低或细胞病变性缺氧、线粒体和内皮功能障碍以及肠道功能障碍可能是MODS的机制[4]。了解脓毒症发病机制所涉及的生物学过程是改善结果和治疗患者的重要步骤。
内质网是一种重要的细胞内细胞器,用于分泌性蛋白和跨膜蛋白的合成和组装,负责蛋白质的易位、蛋白质折叠和蛋白质翻译后修饰[5]。此外,内质网为钙储存、脂质合成和碳水化合物代谢提供了场所。某些病理条件下,如脓毒症、创伤等折叠蛋白质的需求超过了内质网的折叠能力,导致未折叠或错误折叠的蛋白质积累,内质网的稳态改变,进而引起了内质网应激(ERs)。在ERs的情况下,为了保护细胞,重建内质网稳态,细胞内信号通路未折叠蛋白反应(UPR)开始活跃。当UPR未能击败ERs或ERs严重时,细胞功能会受损,导致细胞凋亡[6-7]。ERs与多种疾病(包括自身免疫病、感染、代谢紊乱、神经退行性疾病以及多器官功能障碍等)的发生发展密切相关。对ERs的研究将有望揭示包括脓毒症在内的炎症性疾病的新治疗靶点。本文对ERs在脓毒症及其并发的器官功能障碍中的可能意义,以及其作为预后标志物的潜在用途和新的治疗靶点等相关研究进行了综述,以期深入了解ERs与脓毒症之间的关系。
1 ERs介导UPR信号通路的机制
在哺乳动物UPR中起重要作用的内质网跨膜蛋白主要有3种,包括需肌醇酶1(IRE1)、双链RNA 依赖蛋白激酶样ER 激酶(PERK)和活化转录因子6 (ATF6),见图1。在正常细胞中,葡萄糖调节蛋白78(GRP78)/免疫球蛋白重链结合蛋白(BiP)与这些内质网跨膜蛋白结合,而在ERs过程中解离,通过信号传导共同参与炎症、氧化应激和细胞凋亡。
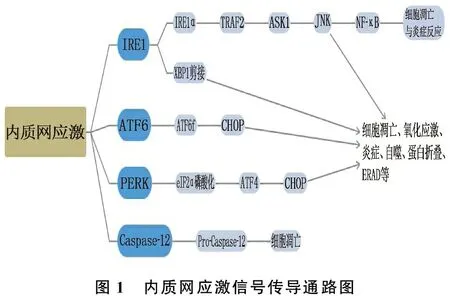
图1 内质网应激信号传导通路图
1.1 IRE1-XBP1
IRE1是含有蛋白激酶和细胞质核酸内切酶活性结构域的双功能酶,含有IREl α和IREl β共2种亚型,并因细胞不同,分布有所差别。在ERs过程中, BiP与IRE1分离,IRE1磷酸化激活其核糖核酸内切酶活性,剪切下游目的基因X盒结合蛋白(XBP1) mRNA, 进一步促进内质网相关性降解(ERAD)相关基因表达的上调,促进细胞适应性生存[8]。而当ERs持续存在, IRE1还通过与肿瘤坏死因子受体相关因子2 (TRAF2)结合,激活凋亡信号激酶-1 (ASK1), 导致c-Jun氨基末端激酶(JNK)下游的激活,促进细胞凋亡[9]。
1.2 PERK
PERK是具备胞质蛋白丝氨酸/色氨酸激酶结构域的Ⅰ型跨膜蛋白。与IRE1一样,在ERs的情况下, BiP从PERK中释放,并与未折叠蛋白结合,然后通过磷酸化激活PERK。被激活的PERK直接磷酸化下游的真核细胞启动因子2的α亚基(eIF2α), 抑制蛋白的翻译和转录过程,从而缓解ERs, 促进细胞适应性生存[10]。当ERs持续存在, eIF2α的磷酸化诱导了活化转录因子4(ATF4)的表达上调,促进C/EBP同源蛋白(CHOP)和DNA损伤诱导蛋白34 (GADD34)的活化,从而诱导细胞凋亡[11]。
1.3 ATF6
ATF6是一种Ⅱ型跨膜蛋白,在ERs过程中, BiP与ATF6分离, ATF6通过囊泡转运从内质网转移到高尔基体。在高尔基体中, ATF6进一步水解活化,产生活性转录因子ATF6f(ATF6的一个片段)。然后ATF6f迁移到细胞核,与ERs反应元件结合,并活化GRP78/94及钙离子-三磷酸腺苷酶等ERs蛋白,有助于ERs的恢复,促进细胞适应性生存[5, 12]。当导致ERs的不良刺激持续存在, ATF6f还能激活核内编码CHOP的靶基因,进而诱导细胞凋亡[13]。
2 ERs与细胞凋亡、炎症、氧化应激
如果各种UPR诱导机制不能缓解ERs, UPR可通过不同的信号通路机制诱导细胞凋亡,包括: ① CHOP信号通路。 IRE1、PERK和ATF6对CHOP的转录激活,在ERs诱导的细胞凋亡中起重要作用[14]。在正常情况下, CHOP低表达,而在ERs条件下, CHOP的表达均可由UPR的3条信号通路诱导,但PERK及ATF6是主要通路。 ② IRE1介导JNK通路的激活, IRE1依赖的JNK激活是激活转录因子CHOP和核转录因子-κB(NF-κB)的重要信号机制,诱导细胞凋亡和炎症反应。③ 含半胱氨酸的天冬氨酸蛋白水解酶(Caspase)-12信号通路可作为ERs诱导的细胞凋亡途径的标志。NAKAGAWA T等[15]研究表明, Caspase-12缺失的小鼠和细胞对ERs诱导的凋亡有部分抗性,但对其他凋亡刺激没有抗性。此外, Ca2+信号也能调控ERs介导的细胞凋亡。内质网是细胞内Ca2+的主要存储场所,细胞内Ca2+稳态机制是连接凋亡与内质网-线粒体相互作用的关键信号通路。大量树突细胞、淋巴细胞凋亡被认为与脓毒症患者高病死率密切相关。过度ERs引起的细胞凋亡,在脓毒症发生发展以及炎症反应恶化过程中起重要作用[5]。
ERs/UPR与炎症相关机制密切相关。一方面, IRE1可被toll样受体(TLRs)信号磷酸化,诱导XBP1mRNA剪接,刺激巨噬细胞产生促炎症细胞因子[16]; 另一方面, TLR信号也能抑制巨噬细胞中的ATF6和CHOP[17]。研究[18-20]表明, ERs通过激活XBP1、ATF6和cAMP反应元件结合蛋白H (CREBH)等UPR因子诱导炎症反应,而这些UPR因子上调了白细胞介素(IL)-1β、肿瘤坏死因子-α(TNF-α)和γ干扰素(IFN-γ)等促炎症因子。据报道[20], CREBH的氨基末端片段上调血清淀粉样蛋白p组分(SAP)和C反应蛋白(CRP)等急性期蛋白,参与炎症反应的急性期。在脓毒症病理过程中,不受控制的炎症和先天免疫系统的激活可能导致组织损伤并最终导致细胞死亡。
氧化应激是指活性氧(ROS)的产生与机体修复损伤能力之间的不平衡。脓毒症使氧化还原稳态失衡,趋向于促氧化状态,其特征是产生过多的活性氧和活性氮,线粒体功能障碍,以及抗氧化系统的破坏[21]。氧化应激改变了内皮细胞的多种功能,还诱导糖萼退化、细胞死亡、通透性增加等。氧化应激与ERs相互关联。未折叠或错误折叠的蛋白质可诱导ROS的产生。同样,氧化应激会扰乱内质网的氧化还原状态,进而破坏正常的二硫键形成和适当的蛋白质折叠[22-23]。
3 ERs与脓毒症
脓毒症和脓毒性休克发病率、致死率高,可导致组织灌注不足和多器官功能衰竭。在不同的脓毒症模型中,ERs参与了脓毒症的进展。脂多糖(LPS)是革兰氏阴性菌细胞壁内毒素的主要成分,参与多种炎症性疾病。HIRAMATSU N等[24]发现,腹腔注射LPS可引起小鼠脾、肺、肝、心等器官GRP78表达上调,提示内毒素血症可诱发全身性ERs。SCHILDBERG F A等[25]报道, LPS刺激人脐静脉内皮细胞凋亡, PERK作为ERs的敏感标记物,在LPS的加入后发生了显著激活,并随着Caspase-12、Caspase-9的裂解,最终通过激活Caspase-3导致细胞凋亡,提示ERs相关凋亡信号的激活是触发内皮细胞凋亡的关键事件。
KOZLOV A V等[26]发现, LPS可通过线粒体依赖途径导致大鼠肝脏的功能性ER衰竭,而组织学检查未发现以坏死形式对肝脏造成显著损害。XBP1剪接的mRNA变体和GRP78 mRNA表达上调,但不伴随凋亡诱导因子(AIF)向细胞核的转位,提示细胞进入凋亡前状态,但未发生凋亡。这说明ERs反应后,细胞可能存活,但内质网功能可能失效。细胞凋亡和基本细胞功能障碍是脓毒症引起多器官功能衰竭的细胞学基础。因此, ERs反应可能是脓毒症治疗的重要靶点。
CHOP是ERs介导细胞凋亡的重要因子,有证据表明, CHOP在脓毒症中作为炎症反应的中介物。FERLITO M等[27]发现,脓毒症小鼠表现出CHOP表达增加, H2S治疗通过抑制CHOP表达提高脓毒症实验动物模型的存活率; CHOP可能在脓毒症的发病机制中起到炎症反应的放大作用, H2S至少部分通过涉及Nrf2激活的机制抑制CHOP的表达。此外,包括CHOP在内的ERs通路在LPS诱导的小鼠肺损伤中被激活,并且在CHOP基因敲除的小鼠中,经LPS处理后的肺损伤被削弱[28]。这些结果进一步证明, CHOP介导的ERs在小鼠感染性损伤的发病机制中起关键作用。KIM H J等[29]发现,使用特定的ERs抑制剂四苯基丁酸(4-PBA)减少了LPS诱导的各种ERs标志物的增加,并减轻了小鼠的肺损伤。上述结果加深了人们对脓毒症发病机制的认识,针对ERs的治疗方案可能改善脓毒症患者的预后。
4 ERs参与脓毒症引起的多器官损伤过程
脓毒症是急性呼吸窘迫综合征(ARDS)常见的病因之一。在病理条件下, ERs诱导炎症反应,炎症反应进一步激活ERs。这种正反馈最终破坏肺组织中的蛋白质稳态,加剧肺组织中的炎症应激,导致肺组织中各种免疫细胞的代谢恶化[20, 30]。KIM H J等[29]采用气管灌注LPS建立小鼠急性肺损伤模型,经LPS处理的小鼠GRP78、CHOP等应激相关标志物表达显著升高,表明ERs是ARDS诱导和维持炎症性肺损伤的重要因素。研究[31]表明, PERK信号通路可诱导肺泡上皮细胞和肺微血管内皮细胞凋亡,导致肺组织结构损伤和功能退化。此外,在盲肠结扎穿刺(CLP)诱导的ARDS大鼠肺组织中检测到IRE1信号通路蛋白和凋亡标志物的表达增加,同时肺微血管内皮细胞凋亡率增加[32]。
缺血、再灌注(I/R)损伤是创伤、休克等危重疾病中常见的病理生理变化,可导致缺氧、酸中毒、自由基积累和细胞能量消耗,从而引起ERs, 影响多种蛋白质的合成和折叠。MIYAZAKI Y等[33]报道, ERs诱导的CHOP介导通路参与心肌I/R损伤过程, CHOP缺失可减弱小鼠心肌I/R损伤中的心肌凋亡。GROOTJANS J等[34]发现,在人类和大鼠的空肠样本中, I/R激活了UPR并导致潘氏细胞凋亡。缺血空肠再灌注时,潘氏细胞特异性BiP染色增加。上述结果表明, ERs参与了I/R损伤相关细胞凋亡。因此,对内质网相关的细胞凋亡途径的干预可能帮助减少I/R损伤。
脓毒症常可引起心肌受损导致心力衰竭,脓毒症性心肌病常常给治疗带来巨大困难。相关研究[35-37]表明,ERs通过PERK/CHOP、IRE1/ASK和caspase-12等信号通路促进细胞凋亡。活化的肾素-血管紧张素-醛固酮系统、交感肾上腺素系统和循环中B型脑钠肽浓度可影响这些通路,导致细胞凋亡甚至心力衰竭。同时,由于CHOP途径释放成纤维因子,诱导炎症反应,心肌也可发生重塑纤维化。因此,抑制上述蛋白的表达可以通过减少细胞凋亡来治疗心力衰竭。
脓毒症引起的急性肾损伤,作为危重患者的常见病,经常受到ICU医生的关注。一项回顾性研究[38]在AKI患者的肾活检中发现了多种ERs标记物的表达增加。RTN1A是ERs和AKI的关键介质,与肾损伤的严重程度呈正相关。此外, ERS还与肝衰竭、急性胰腺炎等多种疾病相关,广泛参与脓毒症引起多脏器损伤的病理过程。对ERs与人类疾病,特别是危重疾病关系的研究,不仅完善了对疾病发病机制的研究,也为靶向治疗提供了新的思路和方法。
5 干预ERs在脓毒症治疗中的潜在价值
ERs与许多疾病的发病机制有关,因此, UPR通路可能是调节ERs及其相关疾病的重要治疗靶点。一项研究[39]表明, Mdivi-1(一种喹唑啉酮衍生物)通过重建线粒体融合-裂变平衡,防止脓毒症中的ERs的诱导,改善CD4+T细胞的凋亡。ROSEN D A等[40]发现Sigma-1受体(S1R)限制ERs跨膜蛋白IRE1内切酶活性和细胞因子表达,其进一步发现氟伏沙明(一种对S1R具有高亲和力的抗抑郁药物)可保护小鼠免受致命脓毒性休克的影响,并抑制人血白细胞的炎症反应,使S1R成为治疗脓毒症的可能治疗靶点。CHEN X Z等[41]指出,血红素氧合酶(HO)-1通过抑制ERS中的PERK/eIF2α/ATF4/CHOP促凋亡通路,保护脓毒症诱导的急性肺损伤,减轻肺内细胞凋亡。HOU Y等[42]研究表明,外源性脂联素在120 mg/kg剂量下可减弱脓毒症大鼠内皮细胞凋亡,证实脂联素可通过抑制ERs IRE1α通路来缓解内皮细胞凋亡。HONG Y P等[43]研究表明, 4-苯基丁酸(4-PBA)可降低急性胰腺炎(AP)大鼠重要器官中ERs标志物(BiP、CHOP、PREK、ATF6、IRE1)的表达,并通过调节ERs和减轻炎症反应抑制细胞死亡,保护AP大鼠胰腺、肺、肝、肾免受损伤。因此,了解UPR各组成部分之间的相互作用,以及这些信号通路如何与炎症和细胞凋亡相互交织,将为包括脓毒症在内的多种疾病提供新的治疗选择[44]。
6 小结与展望
各种原因引起未折叠蛋白堆积或Ca2+稳态失衡,可导致ERs的发生,激活保护信号通路,促进细胞功能恢复。然而,不良刺激持续存在会诱导凋亡启动子的表达,导致凋亡的发生。因此,何时进行ERs干预和调控便成了研究的重要方面。有研究[45]发现,经LPS刺激的巨噬细胞,早期(5 h)可产生明显的ERs, 且由于内质网功能的保护机制, ERs诱导剂引起的细胞凋亡被阻止。这也正提示了适度的ERs可减轻细胞损伤,促进细胞功能恢复。因此,在脓毒症早期,适当调控ERs, 而在后期对其引起的细胞凋亡进行适当干预,可能是将来脓毒症治疗的新方向。ERs的双向作用及其协同炎症反应在脓毒症及其他相关疾病的发生发展中起着复杂而关键的作用。对ERs的发生机制和自我调节机制进行深入研究,从精准医疗的角度出发,可探索疾病治疗的新靶点,并采取一些有效的防治措施。
