淫羊藿素对人舌鳞癌细胞CAL-27增殖、凋亡、迁移及侵袭的影响
2023-09-09曹华娇傅玲玲冯红超
曹华娇, 傅玲玲, 冯红超,
(1. 贵州医科大学 口腔医学院, 贵州 贵阳, 550001;2. 贵州省贵阳市口腔医院 口腔颌面外科, 贵州 贵阳, 550002)
舌鳞状细胞癌(TSCC)简称舌鳞癌,是口腔颌面部最常见的恶性肿瘤之一,其发生率占口腔鳞癌的50%~60%[1]。舌体淋巴引流丰富且舌运动频繁,舌鳞癌颈淋巴结转移率较高,患者的5年存活率较低[2-4]。舌鳞癌的主要治疗方法是多模式治疗,目前中草药治疗的相关研究仍在持续进行中。淫羊藿抗肿瘤作用较为广泛[5-6], 研究[7-9]表明,其主要成分淫羊藿素、脱水淫羊藿素也具有抗舌鳞癌作用。作者查阅文献过程中发现,淫羊藿素与脱水淫羊藿素的分子式及分子名称存在一定争议,有研究[10-11]认为淫羊藿素对应分子式为C21H22O7, 水解脱去一分子H2O后变为脱水淫羊藿素,对应分子式为C21H20O6; 也有研究[12]认为,淫羊藿素分子式为C21H20O6; 还有研究[13]认为,脱水淫羊藿素分子式为C21H20O6。本研究基于查阅文献及分子对接结果选取分子式为C21H22O7的淫羊藿素进行实验,拟通过分子对接揭示淫羊藿素抗舌鳞癌的药效及可能的作用机制,以期为治疗人舌鳞癌提供理论依据。
1 材料与方法
1.1 细胞来源
人口腔鳞癌细胞系CAL-27来自贵州医科大学头颈鳞癌生物学实验室。
1.2 主要试剂与仪器
淫羊藿素(C21H22O7, CAS: 521-45-9; CAT. NO. II0330, 北京索莱宝科技有限公司); 胎牛血清、双抗(青霉素10 000 U/mL, 链霉素10 mg/mL, 以色列BI); 基质胶(货号0827045, 上海诺娃医药科技有限公司); Annexin V-FITC/PI双染细胞凋亡检测试剂盒(CAT. No: KGA107, Lot. No. 20220407, 南京凯基生物科技有限公司); Navios流式细胞仪购(美国Beckman); 超微量分光光度计(型号NanoDrop 2000, 美国Thermo)。
1.3 方法
1.3.1 细胞培养: 将人口腔鳞癌细胞系CAL-27培养于高糖DMEM培养基中,在培养基中添加10%胎牛血清, 100 U/mL青霉素和100 U/mL链霉素,放入37 ℃恒温和CO2浓度为5%的细胞培养箱内培养。每2~3 d换1次液,每5 d传1次代,细胞生长汇合度为80%~90%时,用磷酸盐缓冲液(PBS)轻轻漂洗2次, 0.25%胰蛋白酶-EDTA溶液消化5 min, 镜下观察细胞变圆后,用含10%胎牛血清的完全培养基终止消化,将细胞轻轻吹打成单细胞悬液,转移至15 mL离心管中,以1 000转/min离心5 min, 去掉上清液后重悬计数,根据后续实验调整成需要的细胞密度。
1.3.2 CCK-8法检测细胞增殖能力: 将对数生长期人舌鳞癌细胞CAL-27以每孔3 000个细胞的密度接种于96孔板中,设置实验组、对照组和空白组,每组5个复孔。待24 h后细胞贴壁、细胞状态良好,加入淫羊藿素,淫羊藿素的终浓度分别为 0(对照组)、10、20、40 μmol/L(实验组),继续培养24、48 h后,每孔加入10 μL CCK8溶液,酶标仪测试450 nm波长处的吸光度值,并计算细胞的抑制率,抑制率(%)=(对照孔吸光度-实验孔吸光度)/(对照孔吸光度-空白孔吸光度)×100%。
1.3.3 光镜下细胞形态学观察: 取对数生长期的CAL-27单细胞悬液,以每孔50 000个细胞的密度接种至6孔板中,加入培养液, 24 h后加入淫羊藿素,终浓度分别为0、10、20、40 μmol/L, 继续培养48 h后于倒置显微镜下观察细胞形态。
1.3.4 平板克隆形成实验: 取对数生长期的CAL-27单细胞悬液,以每孔500个细胞的密度接种至65 mm培养皿中,加入完全培养基至3 mL, “十”字轻轻晃动使细胞分散均匀。将培养皿放入37 ℃、5% CO2培养箱中培养1周,每3 d更换1次培养基,至单个细胞集落细胞数量≥50个时终止培养。PBS轻柔清洗2次后,使用4%多聚甲醛固定15 min, 0.4%结晶紫染色15 min, 双蒸水清洗2次后干燥,拍照,计数。
1.3.5 划痕实验: 将生长状态良好的CAL-27细胞以每孔3×106个细胞的密度接种至6孔板中,每组设3个复孔,待细胞汇合度达100%, 用100 μL移液枪枪头垂直底部横线划直线,形成一段宽度约3 mm的无细胞空白区域, PBS洗去划落的细胞,分别加入淫羊藿素终浓度为0、10、20、40 μmol/L的不含血清的DMEM培养基。选取划痕区域均匀一致的位置做好标记并拍照,继续培养12、24、36 h后选取同一区段进行观察及拍照,最后用Image J软件分析药物作用后划痕愈合情况。
1.3.6 Transwell迁移及侵袭实验: 8~11 mg/mL基质胶解冻分装后用冷的不含胎牛血清完全培养基以1∶8比例稀释。侵袭实验需提前取100 μL稀释好的基质胶置于24孔板Transwell上室内,置于培养箱中孵育2 h。将密度为每孔1×104个细胞的CAL-27接种于上室,在下室内放入含10%胎牛血清的完全培养基600 μL, 培养24 h后加入淫羊藿素,继续48 h后取出培养板,用棉签轻轻擦去小室内的基质胶, PBS漂洗3次后,将小室依次置于多聚甲醛及结晶紫中15 min, PBS漂洗3次,干燥后于显微镜下随机选取3个视野进行拍照及计数。
1.3.7 流式细胞术检测CAL-27细胞凋亡情况: 取对数生长期的CAL-27单细胞悬液,以每孔3×105个细胞的密度接种至6孔板中,药物干预48 h, 消化完成后,将上清液、PBS漂洗液和细胞悬液收集至同一个离心管中,以1 000转/min离心5 min,计数,取5×105个细胞, PBS洗涤2遍,弃上清液,加入500 μL结合缓冲液混匀,再依次加入5 μL Annexin V-FITC、5 μL PI混合,避光孵育15 min后,采用流式细胞仪上样检测,用FlowJo 10.6.2软件分析计算CAL-27细胞凋亡率。
1.3.8 分子对接预测药物作用效果: 根据课题组淫羊藿抗舌鳞癌的网络药理学分析,淫羊藿抗舌鳞癌可能主要与AR、ESR1、PRKACA、PTGS2共4个靶基因相关。因此,本实验在RSCB PDB数据库查询并下载AR、ESR1、PRKACA、PTGS2的3D结构; TCMSP数据库中下载淫羊藿素分子结构MOL文件; 在Discovery Studio (2019) 软件中对淫羊藿素与4个靶基因大分子进行化学结合能的计算及半柔性对接。
1.3.9 逆转录-实时定量聚合酶链反应(RT-qPCR)检测: 以GAPDH作为内参,相对表达量采用2-△△Ct法计算。提取细胞样本总RNA, 逆转录cDNA, 利用qPCR法检测各组细胞中ESR1、PTGS2、PRKACA、AR基因表达情况。为了减少误差,所有检测样本均做3个平行复孔,检测完成后,取3个平行复孔的平均值作为该样本的最终检测数值。引物序列见表1。

表1 RT-qPCR 检测所用引物序列
1.4 统计学分析

2 结 果
2.1 CCK-8检测不同浓度淫羊藿素对CAL-27细胞增殖的抑制作用
处理24、48 h的细胞存活率均随淫羊藿素剂量增加而降低(P< 0.001), 见图1A; 在同一时点,与0 μmol/L 淫羊藿素相比, 10、20、40 μmol/L淫羊藿素细胞存活率降低,差异有统计学意义(P<0.001); 同一浓度下,与处理24 h比较, 48 h的细胞存活率降低,差异有统计学意义(P<0.001)。淫羊藿素对CAL-27细胞作用24 h的半数抑制浓度(IC50)为33.37 μmol/L, 48 h IC50为15.57 μmol/L, 见图1B。

A: CAL-27细胞存活率随淫羊藿素浓度变化柱形图; B: CAL-27抑制率随淫羊藿素浓度变化折线图。与0 μmol/L浓度比较, ***P<0.001; 两者比较, ###P<0.001。图1 淫羊藿素作用于CAL-27 24、48 h后的变化
2.2 光镜下细胞形态学观察
倒置显微镜下观察细胞形态发现,不同浓度淫羊藿素干预48 h后, CAL-27细胞生长受到抑制,且对形态学影响较为明显,见图2。

A: 放大倍数为100倍,比例尺为100 μm; B: 放大倍数为200倍,比例尺为50 μm。图2 CAL-27细胞经淫羊藿素干预48 h后形态学变化
0 μmol/L浓度的细胞贴壁伸展,稍呈梭形,伪足较长; 经淫羊藿素影响后,细胞逐渐皱缩,伪足变短,形态不规则,随着药物浓度的升高,形态变化越来越明显,在40 μmol/L浓度时最为明显,细胞稍呈圆形。
2.3 克隆形成实验检测细胞增殖情况
不同浓度淫羊藿素处理CAL-27后,细胞增殖受到显著抑制,形成的单克隆集落大小呈逐渐变小趋势,见图3A。与0 μmol/L组比较,淫羊藿素浓度为20 μmol/L时细胞集落减少,当淫羊藿素浓度为40 μmol/L时几乎不存在细胞集落,见图3B。克隆形成实验显示, 10 μmol/L浓度的克隆形成率为(79.20±5.74)%, 低于0 μmol/L组的(101.00±2.26)%, 差异有统计学意义(P<0.05); 与0 μmol/L组克隆形成率比较, 20 μmol/L浓度的克隆形成率(64.73±5.98)%和40 μmol/L浓度的克隆形成率(27.33±7.69)%均降低,差异有统计学意义(P<0.001), 见图3C。
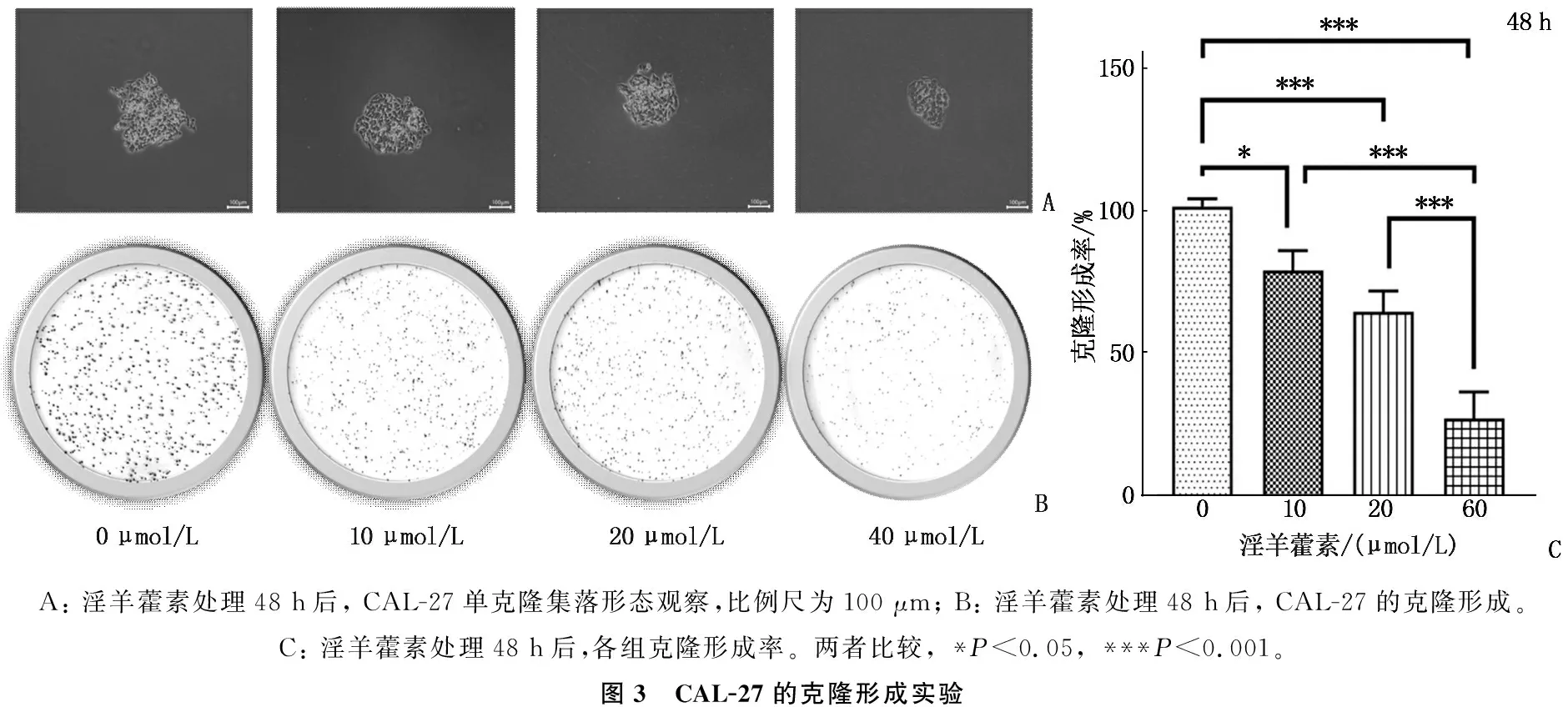
A: 淫羊藿素处理48 h后, CAL-27单克隆集落形态观察,比例尺为100 μm; B: 淫羊藿素处理48 h后, CAL-27的克隆形成。C: 淫羊藿素处理48 h后,各组克隆形成率。两者比较, *P<0.05, ***P<0.001。图3 CAL-27的克隆形成实验
2.4 划痕实验
CAL-27经过不同浓度的淫羊藿素分别作用12、24、36 h后,细胞水平向内迁移,见图4A。随着时间的推移,迁移愈合面积越来越大, 36 h时0 μmol/L浓度和10 μmol/L浓度的划痕恢复接近100%, 而20 μmol/L浓度和40 μmol/L浓度划痕未能完全愈合。在0、12、24、36 h时,与0 μmol/L浓度比较, 10、20、40 μmol/L浓度的划痕区域迁移率呈下降趋势,差异有统计学意义(P<0.05), 见图4B。
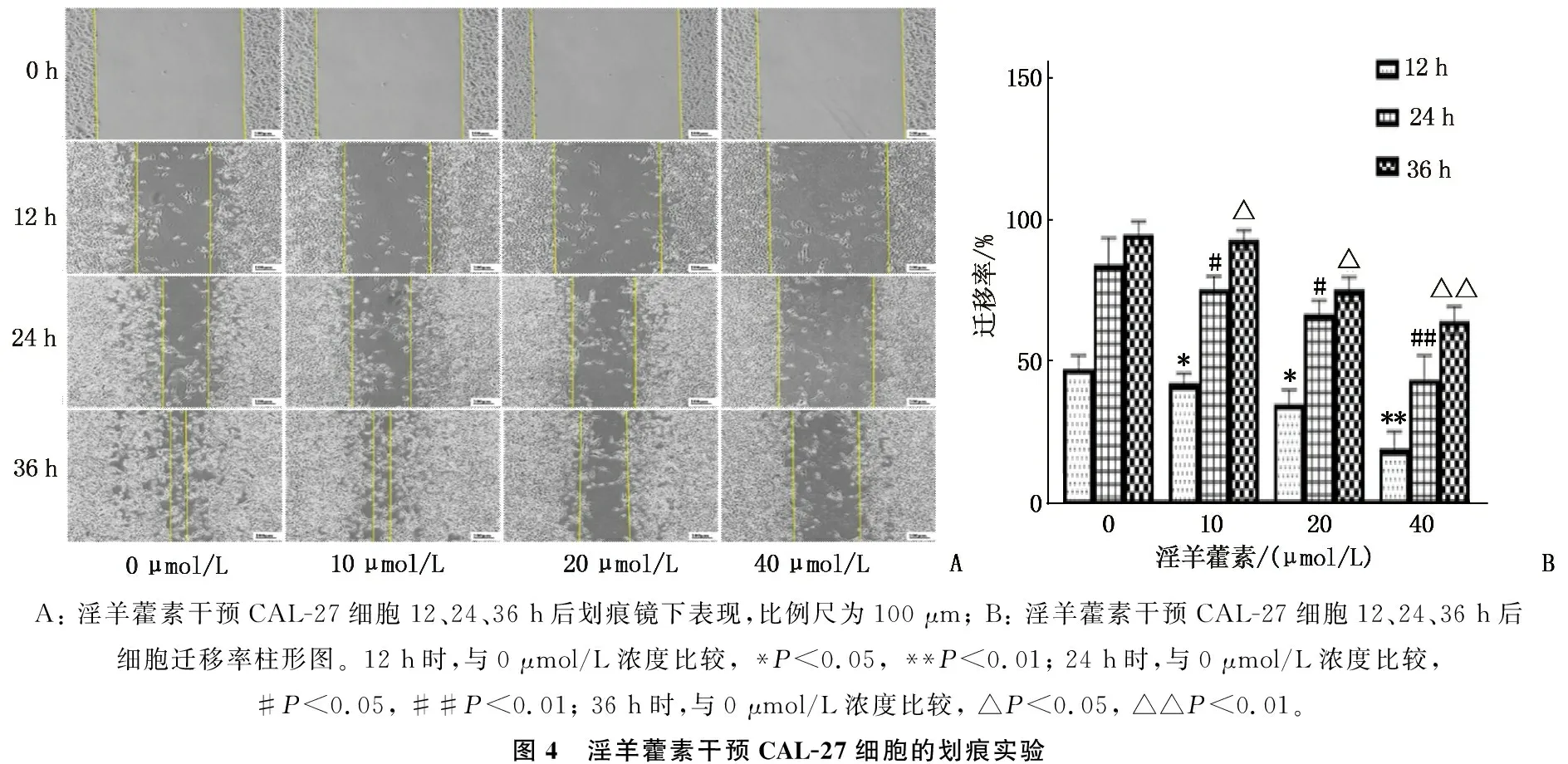
A: 淫羊藿素干预CAL-27细胞12、24、36 h后划痕镜下表现,比例尺为100 μm; B: 淫羊藿素干预CAL-27细胞12、24、36 h后细胞迁移率柱形图。12 h时,与0 μmol/L浓度比较, *P<0.05, **P<0.01; 24 h时,与0 μmol/L浓度比较, #P<0.05, ##P<0.01; 36 h时,与0 μmol/L浓度比较, △P<0.05, △△P<0.01。图4 淫羊藿素干预CAL-27细胞的划痕实验
2.5 Transwell迁移及侵袭实验
CAL-27细胞经过不同浓度的淫羊藿素作用48 h后,随着药物浓度的增加,迁移和侵袭穿过小室的细胞逐渐减少,见图5A、5B。CAL-27迁移穿过小室的细胞数目呈淫羊藿素剂量依赖性减少(P<0.001); CAL-27侵袭穿过小室的细胞数目呈淫羊藿素剂量依赖性减少(P<0.05或P<0.001), 见图5C、5D。

A: CAL-27细胞各组迁移图,比例尺为100 μm; B: CAL-27细胞各组侵袭图,比例尺为100 μm; C: 各浓度淫羊藿素干预细胞迁移数目统计分析; D: 各浓度淫羊藿素干预细胞侵袭数目统计分析。两者比较, *P<0.05, ***P<0.001。图5 淫羊藿素干预CAL-27细胞48 h后的迁移和侵袭结果
2.6 流式细胞术检测细胞凋亡情况
淫羊藿素干预人舌鳞癌细胞CAL-27 48 h后,随着药物浓度的增加,凋亡细胞比例增加,见图6A。0 μmol/L浓度细胞凋亡率为(4.96±1.92)%, 10 μmol/L浓度细胞凋亡率为(10.15±2.16)%, 20 μmol/L浓度细胞凋亡率为(28.96±4.65)%, 40 μmol/L浓度细胞凋亡率为(45.20±6.80)%。CAL-27细胞凋亡率呈淫羊藿素剂量依赖性增加,差异有统计学意义(P<0.05或P<0.001)。

A: 流式凋亡图; B: 细胞凋亡率柱形图。两者比较, *P<0.05, **P<0.01, ***P<0.001。 流式图中4个象限: 左下象限代表正常细胞群; 左上象限代表机械损伤细胞群; 右上象限代表晚期凋亡细胞; 右下象限代表早期凋亡细胞; 细胞凋亡率为右上和右下细胞占比之和。图6 淫羊藿素干预CAL-27细胞48 h后的凋亡结果
2.7 淫羊藿素与AR、ESR1、PRKACA、PTGS2进行分子对接
淫羊藿素与AR(1XOW)、ESR1(7BAA)、PRKACA(5N1F)、PTGS2(5F19)进行分子对接的结合能依次为: -69.457 9、0、-48.798 2、0 kcal/mol。结合能数值越低,氢键结合数目越多,则舌鳞癌受体与淫羊藿素之间的结合活性越高,结合构象越稳定,潜在效果就越好。其中,AR、ESR1、PRKACA与淫羊藿素对接有2个氢键,而PTGS2与淫羊藿素的对接没有氢键的结合,见图7。
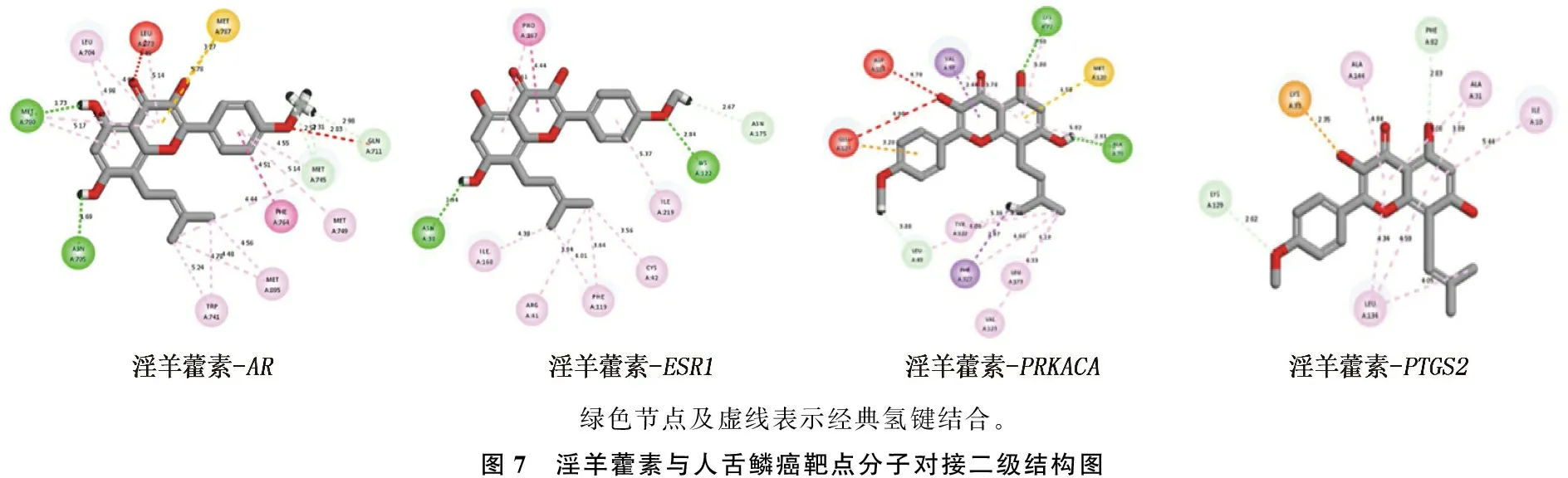
绿色节点及虚线表示经典氢键结合。图7 淫羊藿素与人舌鳞癌靶点分子对接二级结构图
2.8 RT-qPCR实验
分别采用0、10、20、40 μmol/L 浓度的淫羊藿素处理CAL-27 48 h后,检测AR、ESR1、PRKACA、PTGS2的表达情况。与0 μmol/L浓度比较,AR、ESR1、PRKACA、PTGS2的相对表达量呈淫羊藿素浓度依赖性降低; 但0 μmol/L浓度和10 μmol/L浓度的PTGS2的相对表达量比较,差异无统计学意义(P>0.05), 见图8。

A: 干预48 h后PRKACA的相对表达量; B: 干预48 h后AR的相对表达量; C: 干预48 h后ESR1的相对表达量; D: 干预48 h后PTGS2的相对表达量。两者比较, **P<0.01, ***P<0.001。图8 淫羊藿素干预CAL-27细胞48 h后AR、ESR1、PRKACA、PTGS2的相对表达量
3 讨 论
舌鳞癌预后较差,淋巴结阳性、肿瘤浸润深度和淋巴结比率升高是影响存活率的重要预后因素[14]。目前,舌鳞癌治疗方式以手术为主,辅助放化疗、生物治疗和康复治疗等进行综合序列治疗[15]。研究[16-17]表明,天然化合物如淫羊藿素、白皮杉醇、姜黄素、醋酸棉酚等在舌鳞癌的治疗中起着越来越重要的作用。淫羊藿素又名阿可拉定,有研究[18]表明,其可抑制多条肿瘤增殖信号通路,提高免疫系统对肿瘤的杀伤。目前已完成晚期肝癌治疗的ⅡB期临床试验,与其他药物的联合应用对晚期或三阴性乳腺癌的临床实验一致,均显示出明确的临床疗效和良好的安全性[19-21]。
本研究采用不同浓度的淫羊藿素干预人舌鳞癌细胞CAL-27, 通过CCK-8测试、克隆形成实验、细胞形态学观察、流式细胞术、Transwell迁移和侵袭实验检测淫羊藿素对舌鳞癌增殖、凋亡、迁移、侵袭等生物学性能的影响。本研究结果表明,随着药物浓度的增加, CAL-27生长受到的抑制越来越显著,且呈时间和剂量依赖性。结合划痕实验及Transwell迁移、侵袭实验发现,细胞向四周移动的能力逐渐降低,且流式细胞术检测和RT-qPCR实验表明随着淫羊藿素浓度的增加,细胞凋亡率越来越高。
结合本课题组对淫羊藿抗舌鳞癌作用的网络药理学和分子对接分析中发现,AR、ESR1、PRKACA、PTGS2可能为淫羊藿素作用于舌鳞癌的4个最佳靶点。4个靶点抗肿瘤作用为:AR被认为在癌症发生中有促进作用,可促进肿瘤细胞的增殖、迁移和侵袭,并被认为是一种潜在的头颈鳞状细胞癌预后标记物[22-24]; 研究[25]表明,AR阳性的口腔鳞癌患者可能具有低生存率、高复发率的风险。ESR1在转录上调节参与肿瘤细胞的增殖、迁移、侵袭和转移。研究[26-28]表明,ESR1参与了乳腺癌、前列腺癌等癌症的病理过程,在头颈鳞癌中被报道为潜在的预后化学标志物。PRKACA被报道[29]与心血管疾病、肾上腺皮质肿瘤以及乳腺癌、纤维板层状肝细胞癌等多种癌症相关。研究[30]表明,DNAJB1-PRKACA基因融合能与β-连环蛋白相互作用,显著促进肿瘤的发生; 研究[31]表明,PRKACA可以通过其下游底物的磷酸化来调节细胞活动,从而减少细胞内的自噬,并诱导细胞增殖。PTGS2在肿瘤发病过程中也起着至关重要的作用,其与结肠癌、前列腺癌、宫颈癌、卵巢癌等多种癌症相关[32-35]。生物信息学分析[36]表明,PTGS2作为头颈癌免疫调节网络的关键节点之一,在不久的将来可能成为新的治疗靶点。
为进一步探究淫羊藿对舌鳞癌的作用机制,本实验通过qPCR实验检测AR、ESR1、PRKACA、PTGS2mRNA的相对表达量,发现随着药物浓度的增加,其相对表达量均呈现不同程度的降低,且下降程度以AR最为显著,其次为PRKACA, 变化幅度最小的为PTGS2, 变化趋势与分子对接结合能绝对值大小依次排序:AR(1XOW)>PRKACA(5N1F)>ESR1(7BAA)= PTGS2(5F19)。
综上所述,淫羊藿素可促进人舌鳞癌细胞凋亡,并抑制舌鳞癌细胞的增殖、迁移和侵袭能力,具体机制可能与淫羊藿素和人舌鳞癌细胞内AR、ESR1、PRKACA的特异性结合,进而影响目的基因的表达量有关,但其具体调控作用机制尚不明确,还需进一步探讨。
