台盼蓝法测定发酵液中ε-聚赖氨酸产量
2023-09-07张存金韩金洋宋登科刘莹莹廖爱美侯银臣宇光海黄继红
张存金,潘 龙,2*,韩金洋,宋登科,刘莹莹,蔡 婷,廖爱美,侯银臣,宇光海,惠 明,黄继红,4,5*
1.河南工业大学 生物工程学院, 小麦生物加工与营养功能河南省重点实验室, 河南 郑州 450001
2.河南金丹乳酸科技股份有限公司 , 河南 周口 477150
3.河南牧业经济学院 食品与生物工程学院, 河南 郑州 450046
4.河南大学 农学院, 河南 开封 475001
5.许昌学院 食品与药学院, 河南 许昌 461000
ε-聚赖氨酸(ε-poly-L-lysine,ε-PL)是一种由L-赖氨酸单体在合成酶催化作用下通过 α-COOH 和 ε-NH2脱水缩合连接而成的同型氨基酸聚合物,分子质量为 3 200~4 500 Da[1],结构式如图1所示。这种具有25~35个单体的聚合物是在小白链霉菌Streptomycesalbulus346发酵液中分离得到的[2]。ε-PL主链上的游离氨基使其在酸性和弱碱性环境中表现出阳离子特性,因此能够与细胞膜表面的阴离子结合从而破坏微生物的细胞膜[3-4]。这一特性使ε-PL在抑制革兰氏阳性和阴性细菌、真菌以及酵母的生长方面表现出特有的优势[5-7]。因此,2014年,继日本、韩国和美国之后,我国正式批准ε-PL用于淀粉制品、烘焙食品、肉制品、调味品和饮料等的防腐与保鲜,成为我国批准的第3种微生物来源天然食品防腐剂[8-9]。
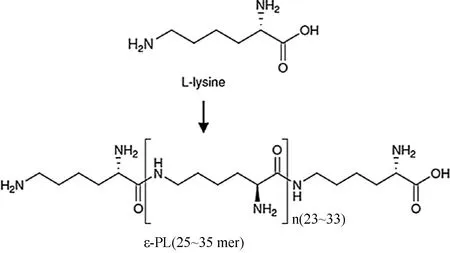
图1 ε-聚赖氨酸的分子结构Fig.1 Molecular structure of ε-PL
目前国内对ε-PL的研究无论是在诱变育种还是发酵工艺优化方面都有大量的报道[10-11],但有关发酵液中ε-PL定量检测的相关报道较少。现有的发酵液中ε-PL含量的检测方法有HPLC法[12-13]、扩散圈法[14]、荧光淬灭法[15]以及Itzhaki[16]使用的方法等。其中,HPLC法对ε-PL纯度要求较高,若将未经处理的发酵液进行HPLC法检测将极大地降低色谱柱的使用寿命;扩散圈法误差较大,测量不准确;荧光淬灭法中用到的指示剂异硫氰酸酯具有强烈刺激性,不适用于在常规环境下检测;目前通用的是Itzhaki[16]使用的方法,虽然在很大程度上缩短了ε-PL的检测时间,但操作依然复杂,因此还需要探索新的ε-PL检测方法。
据报道,ε-PL的侧链含有大量的氨基阳离子[17-18],而台盼蓝含有磺酸基阴离子[19],根据ε-PL与甲基橙的沉淀原理,发现ε-PL与台盼蓝在pH值4~10的范围内同样能够形成复合物而沉淀,离心后上清液在600 nm处其吸光度与ε-PL浓度存在良好的线性关系;培养基中的成分不干扰ε-PL的测定。根据这个原理作者建立了一种准确、简便、灵敏的发酵液中ε-PL的酶标仪检测方法,为进一步研究ε-PL奠定了基础。
1 材料与方法
1.1 试剂与菌种
ε-PL标品(纯度99%):郑州拜纳佛生物工程股份有限公司;葡萄糖、MgSO4·7H2O、FeSO4·7H2O、磷酸氢二钾:均为分析纯,天津市科密欧化学试剂有限公司;磷酸二氢钾:洛阳市化工试剂厂;蛋白胨、酵母提取物:生化试剂,北京奥博星生物技术有限公司;(NH4)2SO4:天津市大茂化学试剂厂;Na2HPO4·12 H2O、NaH2PO4·2 H2O:洛阳市化学试剂有限公司;水为去离子水;台盼蓝:国药集团化学试剂有限公司。
菌种:白色链霉菌IFO 14147(CICC ®11022),中国工业微生物菌种保藏管理中心。
1.2 仪器
T2S紫外-可见光分光光度计:上海精科实业有限公司;EPOCH多功能酶标仪:美国Biotek有限公司;HTS-W50摇床:常州英德生物科技有限公司;FE20KpH计:特勒托利多(中国)有限公司;5910 Ri离心机:德国艾本德股份公司;MANDELA多功能诱变仪:北京韦恩斯技术有限公司;GZX光照培养箱:上海比朗仪器制造有限公司;ME104E/02电子天平:上海梅特勒-托利多仪器有限公司。
1.3 试验方法
1.3.1 溶液的配制
ε-PL溶液:配制2 g/L的ε-PL母液,分别用蒸馏水稀释成10、20、40、60、80、100 mg/L的ε-PL系列质量浓度溶液。
台盼蓝试剂:分别称取台盼蓝0.1、0.2、0.3、0.4、0.5 g,溶于50 mL去离子水中,加去离子水定容至100 mL,配制成1、2、3、4、5 g/L台盼蓝试剂,完全溶解后于棕色试剂瓶中密封保存。
PBS溶液:用1.0 mmol/L磷酸二氢钾和磷酸氢二钾溶液分别配制不同pH值(4、6、8、10)的缓冲液。
1.3.2 台盼蓝法测定ε-PL产量
标准曲线测定方法:分别量取ε-PL系列浓度溶液0.25 mL置于1.5 mL离心管中,加入PBS缓冲液0.7 mL,再加入台盼蓝试剂0.03 mL,置于50 ℃,200 r/min 摇床中反应30 min,12 000 r/min 离心3 min后,吸取200 μL于96孔板中。以PBS溶液为空白参比,测定样品在600 nm处的吸光度(A600)。
发酵液中ε-PL含量的测定:取发酵液2 mL,12 000 r/min离心3 min。取上清液0.5 mL用蒸馏水稀释20倍,取稀释液0.25 mL置于1.5 mL离心管中,按照上述标准曲线的测定方法进行测定。以未接种发酵液为空白参照,于600 nm处测定吸光度,根据标准曲线计算发酵液中ε-PL的含量。
1.3.3 检测方法的优化
考察显色剂浓度、pH值、反应温度、反应时间等因素对检测结果的影响,其中台盼蓝试剂质量浓度设置为1、2、3、4、5 g/L,反应pH 4、6、8、10,反应温度30、40、50、60、70 ℃,反应时间20、30、40、50、60 min。
1.3.4 甲基橙法测定ε-PL产量
参照Itzhaki等[16]的测定方法。用PBS缓冲液将发酵上清液适当稀释后与甲基橙溶液进行反应,30 ℃条件下振荡反应30 min,然后200 r/min离心15 min。上清液经PBS缓冲溶液稀释20倍后,在465 nm处测定其吸光度。
1.4 数据处理
试验数据均用平均值±标准差表示,采用 Excel 2010 整理数据,采用SPSS 20分析显著性(P<0. 05),采用 Origin 2018制图。
2 结果与讨论
2.1 试验条件确定
2.1.1 检测波长
以去离子水为对照,扫描100 mg/L ε-PL与台盼蓝反应液在400~700 nm处的吸收光谱,结果如图2所示。由图2可知,反应液在600 nm波长处有最大吸收峰。

图2 反应液吸收光谱Fig.2 Absorption spectrum of reaction solution
2.1.2 显色剂质量浓度
以PBS溶液为空白参比,测定样品吸光度A600,结果见表1。由表1可知,当台盼蓝试剂质量浓度高于3 g/L时,10~20 mg/L ε-PL样品池中读数超出酶标仪检测限,当质量浓度低于3 g/L时,R2较低,最终选择3 g/L为显色剂的最适质量浓度。

表1 不同显色剂质量浓度下的吸光度Table 1 Absorbance at different chromogenic concentrations
2.1.3 pH值
测定不同缓冲液pH值(4、6、8、10)对检测结果的影响,以PBS溶液为空白对照,测定样品在600 nm处的吸光度,结果见表2。由表2可知,当缓冲液pH值为6时,R2最高。因此,选择缓冲液pH值为6。

表2 不同pH值条件下的吸光度Table 2 Absorbance under different pH conditions
2.1.4 反应温度和加热时间
以PBS溶液为空白参比,测定样品的吸光度,由图3(a)可知,当温度超过50 ℃后,吸光度几乎不再发生变化。因此,选用反应温度为50 ℃。由图3(b)可知,随着反应时间的延长,吸光度在40 min后趋于稳定。因此,选择加热时间为40 min。

图3 温度与时间对反应液吸光度的影响Fig.3 Effects of different temperature and time on the absorbance of the reaction solution
2.2 标准曲线的测定
在优化的条件下进行ε-PL标准曲线的测定,按1.3.1中的方法,以PBS溶液为空白参比,测定样品的吸光度。制作ε-PL的标准曲线如图4所示,回归方程为Y=-0.012 8X+3.148 8,R2=0.999 8。由图4可知,ε-PL在10~100 mg/L的质量浓度范围内有良好的线性关系。
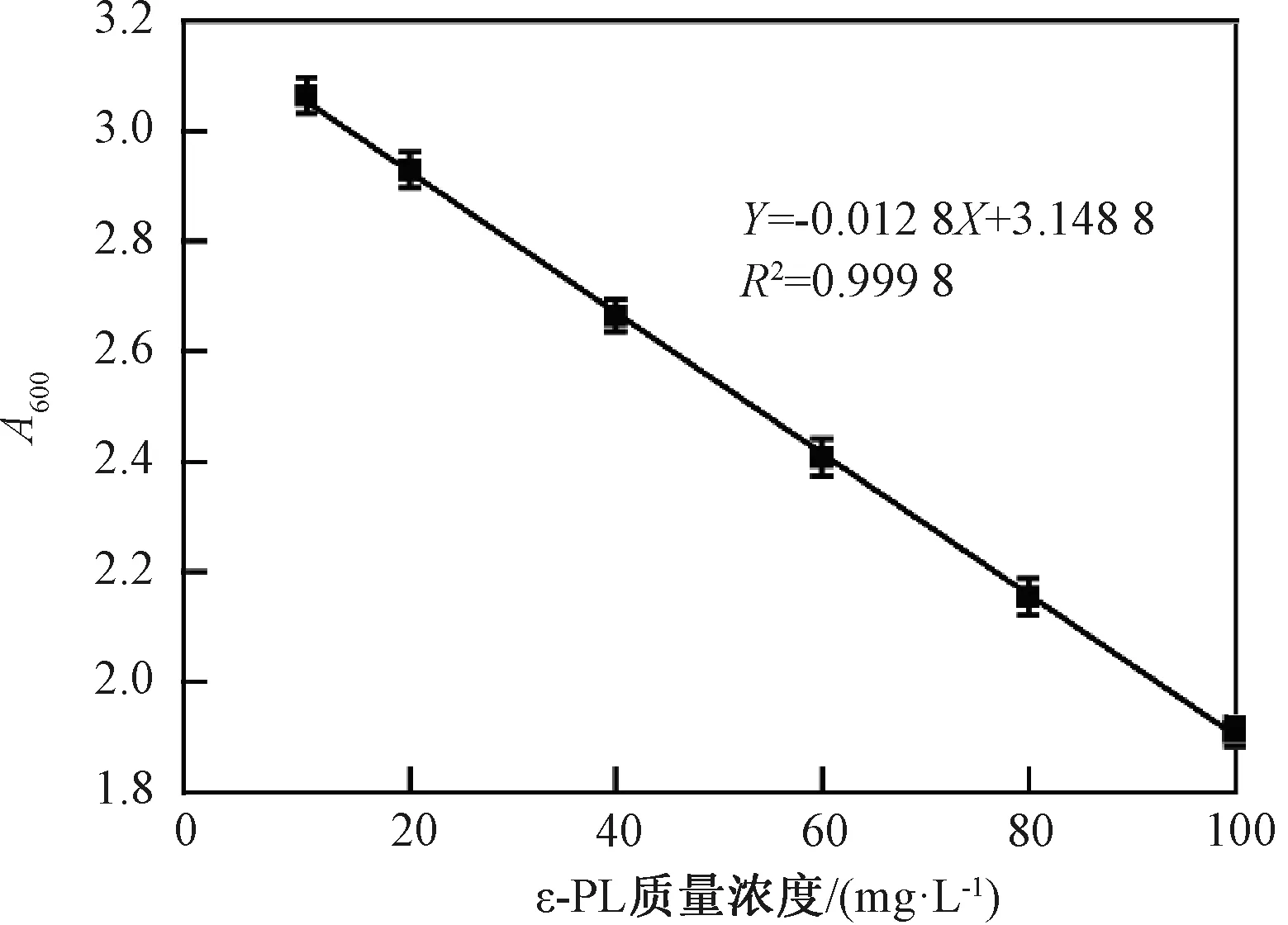
图4 台盼蓝检测法测定ε-PL标准曲线Fig.4 ε -PL standard curve determined by trypan blue detection
2.3 不同因素对检测方法的影响
2.3.1 显色稳定性研究
取不同浓度的ε-PL溶液,与显色剂进行反应后在不同时间内测定600 nm处的吸光度,发现溶液在显色完成后12 h内的吸光度基本不变,表明此方法有良好的显色稳定性。
2.3.2 培养基成分对检测结果的影响
取未接种的培养基,12 000 r/min离心 3 min。按1.3.2中的方法,以水为空白对照测定吸光度,培养基的A600为0,表明培养基中的底物和杂质不影响该方法的测定。
2.4 灵敏度试验
通过11次空白测定和标准曲线的建立,分别获得响应值偏差(δ)和标准曲线的斜率(S),计算试验最低检测限(LOD)和最低定量限(LOQ):
LOD=3.3δ/S, LOQ=10δ/S。
计算得到LOD为2.03 mg/L,LOQ为6.14 mg/L。
2.5 精密度试验
将ε-PL标准液稀释至10、50、100 mg/L后,按1.3.2中方法测定。连续6次测定结果显示,该方法的测量结果相对变异系数(CV)分别为1.65%、1.94%、1.91%,说明该方法的精密度较高。
2.6 回收率试验
取发酵液按不同质量浓度的量精确加入ε-PL,按1.3.2中方法对加标后样品进行检测(n=6),由表3可知,ε-PL的回收率分别为101.53%、99.55%和98.96%。表明应用此方法测定发酵液中ε-PL产量准确度较高。

表3 回收率测定结果Table 3 Results of recovery rate
2.7 与甲基橙法测定结果比较
为了研究台盼蓝法和甲基橙法测定ε-PL产量的相关性,随机选取96个发酵样品分别用台盼蓝法和甲基橙法测定ε-PL产量。由图5可知,两种方法检测结果R为0.934 59,呈高度相关性。此外,相较于甲基橙法,台盼蓝法所需检测时间更短。通过试验统计发现,甲基橙法检测96个样品所需时间约为90 min,而台盼蓝法的检测时间为55 min,缩短了38.9%。表明台盼蓝法不仅能够保障检测的准确性,还可以有效缩短检测时间,可替代甲基橙法快速测定ε-PL的产量。

图5 台盼蓝法和甲基橙法测定ε-PL产量的相关性Fig.5 Relevance between ε-PL yield by trypan blue and methyl orange
2.8 在ε-PL高产菌株筛选中的应用
将建立的台盼蓝检测法应用到ε-PL高产菌株的筛选工作中,对出发菌株白色链霉菌孢子进行ARTP诱变后,选择了365株菌进行多孔板发酵,结果见图6。相比于出发菌株1.2 g/L的ε-PL产量,正突变菌株达到121株,正突变率为33.15%,其中最高产量达1.884 g/L,相比于出发菌株提高了57.0%。结果表明,建立的台盼蓝检测法结合高通量筛选技术可以有效提高高产菌株诱变筛选的工作效率。
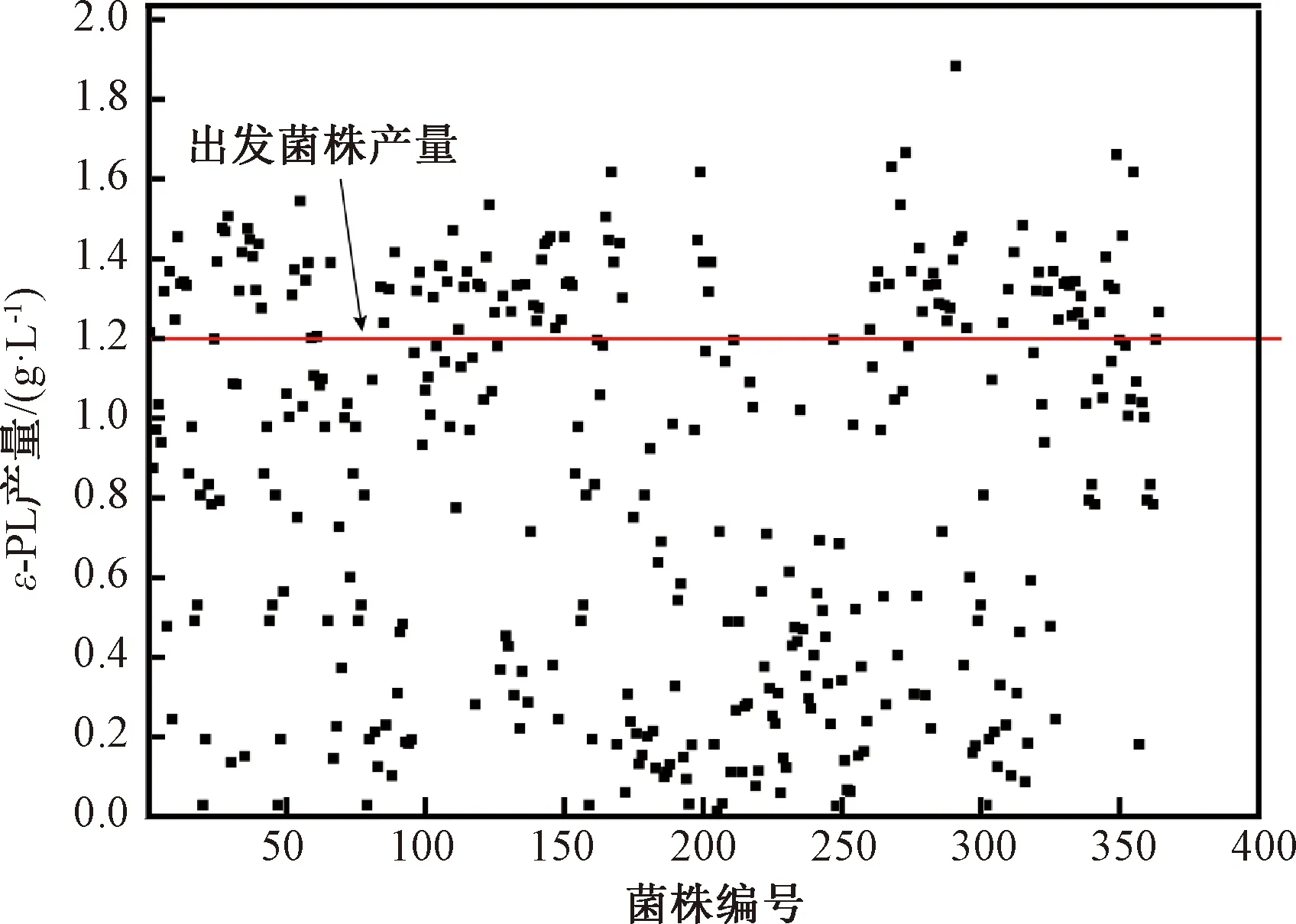
图6 ε-PL高产菌株筛选Fig.6 Screening for ε-PL high-yielding strain
3 结论
本研究建立了以台盼蓝为显色剂的高通量检测方法测定发酵液中ε-PL的产量。研究结果表明,当发酵液中ε-PL质量浓度稀释至10~100 mg/L范围时,具有良好的线性关系,R2=0.999 8。在与甲基橙法测定对比后,检测时间减少38.9%,而且本方法不受发酵液中其他培养基成分的影响。将此方法应用到高产ε-PL的菌种筛选中,实现了发酵液中ε-PL的高通量快速测定,对未来ε-PL高产菌株的选育和研究具有重要的意义。
