基于纸基荧光生物传感器快速检测食品中的赭曲霉毒素A
2023-09-07索志光王琪璇吕泽平
索志光,王琪璇,吕泽平,卫 敏
河南工业大学 粮油食品学院, 河南 郑州 450001
赭曲霉毒素是由赭曲霉、纯绿青霉以及疣孢青霉等产生的真菌毒素[1-2],其中赭曲霉毒素A(ochratoxin A,OTA)的污染范围最广、毒性最强。赭曲霉毒素A不仅可以污染小麦、高粱、玉米等多种粮食[3-4],还可以污染肉类、葡萄酒、啤酒等工业化的食品[5-6]。此外,赭曲霉毒素A具有较强的肾毒性、肝毒性、免疫毒性和致畸作用[7],被国际癌症研究机构列为2B类潜在致癌物[8],对人类和动物的健康存在严重威胁。
目前,用于检测OTA的传统方法,多需要复杂的大型设备和专业的检测人员,只适用于实验室分析,不便于现场检测。然而,在粮食和食品实际生产和储存过程中的不同阶段,可能都需要对其中的污染物进行检测。因此,需要开发更加简单、便捷的方法来满足实际需求。便携式快速检测装置被认为是解决这一问题的有效方法,它可以满足就地实时检测的要求,降低分析成本,具有较大的应用潜力。纸张价格低廉、易于购买、易于保存、还具有良好的生物相容性和生物降解性,是便携式传感设备的最佳传感基质[9-11]。采用纸张作为基底的纸基分析方法,是一种很有前景的检测方法。
核酸适配体是基于指数富集的配体系统进化技术(SELEX)从随机寡核苷酸文库中筛选获得的对靶物质具有高特异性和高亲和力的寡核苷酸序列[12]。核酸适配体具有合成方便、重复性好、易于储存等优点[13],而且它的靶标广泛,包括蛋白质、RNA、毒素、农药等多种物质[14-15]。目前,可以特异性选择OTA的适配体已经被发现[16],研究人员开发了多种基于OTA适配体的生物传感器。在各种传感器中,荧光适配体传感器因其响应速度快、成本低、操作简单、灵敏度高、选择性好而备受关注[17]。因此,将纸基分析方法与荧光检测技术结合,在实际应用方面具有较大的潜力。
基于上述研究,本试验以纸张作为传感器的基底,使用可以特异性识别OTA的核酸适配体,以及羧基荧光素(FAM)与黑洞猝灭基团(BHQ1)之间的FRET作用,构建了简单、低成本的纸基荧光生物传感器,实现对食品中OTA的现场检测。
1 材料与方法
1.1 试验材料
核酸序列(表1):生工生物工程(上海)股份有限公司;赭曲霉毒素A:Sigma-Aldrich公司;Whatman 1级色谱纸:通用电气英国医疗保健有限公司;米粉、绿豆饼:当地超市;三(羟甲基)氨基甲烷(Tirs):上海麦克林生化科技有限公司;氯化钠(NaCl)和盐酸(HCl):天津市科密欧化学试剂有限公司;乙二胺四乙酸(EDTA):洛阳化学试剂厂;链霉亲和素(SA):Solarbio公司。本试验所用试剂均为分析纯。
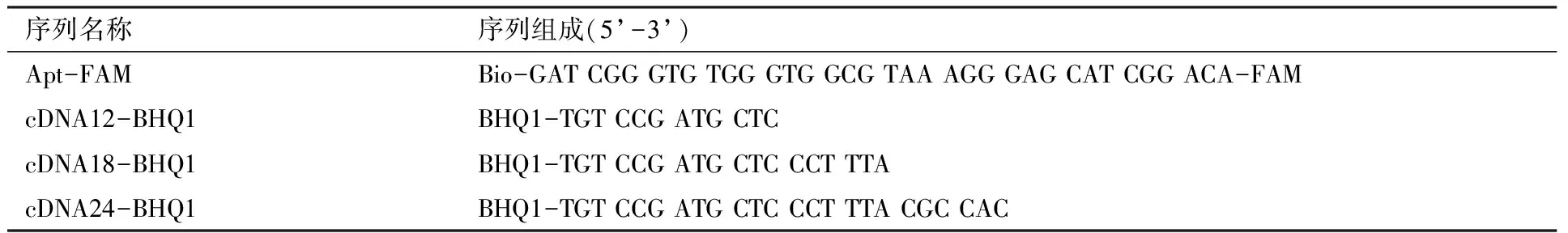
表1 DNA序列Table 1 DNA sequences
1.2 仪器与设备
Agilent Cary Eclipse EL06053220型荧光光谱仪:美国瓦里安公司;HC-2066型高速离心机:安徽中科中佳科学仪器有限公司;MX-S型涡旋振荡器:北京大龙兴创实验仪器有限公司;ULUP-Ⅱ-10T超纯水机:西安优普仪器设备有限公司。NUPACK软件(http://www.nupack.org/partition/new)。
1.3 试验方法
参考He等[18]的方法,对纸基传感器的制备进行了改进,具体制备过程如下。
1.3.1 检测孔的制备
使用打孔器在Whatman 1级色谱纸上打出直径为6 mm的圆形检测孔,该检测孔带有长1.5 cm、宽2 mm的茎。茎与检测孔连接处使用马克笔将其双面涂黑,放置于阴凉干燥处,等待油墨完全干透后,检测孔制备完成。
1.3.2 纸基生物传感器的制备
将5 μL 1 mg/mL的SA溶液滴入检测孔,孵育30 min,使SA在纸基表面均匀包被。使用Tris-HCl(pH 7.4)缓冲液洗涤后,将4 μL 10 μmol/L带有生物素标记的Apt-FAM滴加在检测孔中,孵育30 min,Apt-FAM被固定在检测孔上。用Tris-HCl(pH 7.4)缓冲液洗涤后,传感器制备完成。上述过程均在黑暗环境下进行。
1.3.3 OTA的检测
2.1 术后病理结果 手术病理结果显示,176例甲状腺结节中,恶性结节48例,其中:甲状腺乳头状癌43例,髓样癌2例,未分化癌1例,甲状腺滤泡状腺癌2例。良性结节128例,其中:结节性甲状腺肿83例,甲状腺腺瘤41例,甲状腺炎4例。
在已制备的传感器上滴加2 μL不同浓度的OTA标准液,并孵育30 min,然后将4 μL 6 μmol/L的cDNA-BHQ1滴在检测孔上,继续孵育30 min,孵育完成后,用Tris-HCl(pH 7.4)缓冲液冲洗。上述过程均在黑暗环境下进行。通过荧光分光光度计测定传感器的荧光光谱,设置激发光波长为480 nm,使用特制检测装置,测试传感器的荧光强度。检测孔用带有中空圆形检测位置的长方形卡片固定,将检测孔粘贴在中空部分,之后将卡片沿对角线插入荧光池中。当激发光射入时,与检测孔表面成45°夹角,激发光与发射光的夹角为90°,荧光分光光度计可以成功检测到传感器的荧光光谱。
1.3.4 实际样品处理
对加标米粉和加标绿豆饼进行检测。两种样品的处理:将购买的市售米粉样品和绿豆饼样品研磨成粉,各取0.5 g,分别加入0.5 mL不同浓度的OTA标准液,室温干燥后,加入5 mL的萃取溶剂(甲醇-水,体积比7∶3),振荡30 min后,以12 000 r/min离心10 min,用0.45 μm有机滤膜过滤获得上清液。之后,使用Tris-HCl缓冲液(pH 7.4)将滤液稀释。根据上述方法,分别制备出含有0、10、100、1 000 ng/mL的加标米粉样品和加标绿豆饼样品。
1.4 数据处理
本试验使用OriginPro 2021软件处理数据,使用Adobe Illustrator 2022软件绘制原理图。
2 结果与分析
2.1 试验原理
图1为检测过程示意图,图2为纸基生物传感器的检测原理图。由图2可知,标记有生物素的Apt-FAM,通过生物素和SA的强相互作用接在检测孔表面。当OTA存在时,OTA先与其适配体链Apt-FAM结合,形成特殊的OTA-G-四链体单链结构的复合物(OTA-induced G quadruplex),该复合物具有较高的稳定性。再加入cDNA-BHQ1,结合有OTA的Apt-FAM无法与cDNA-BHQ1结合。因此,cDNA-BHQ1不能连接到纸基表面,FAM的荧光信号不会被猝灭。当OTA不存在时,将cDNA-BHQ1加入检测孔中,cDNA-BHQ1与Apt-FAM通过碱基互补配对结合形成DNA双链结构,并成功连接到纸基上。此时,猝灭基团BHQ1靠近荧光基团FAM,通过FRET作用猝灭FAM,FAM的荧光信号减弱。通过测定两种不同情况的荧光差值,OTA可以成功被检测到。
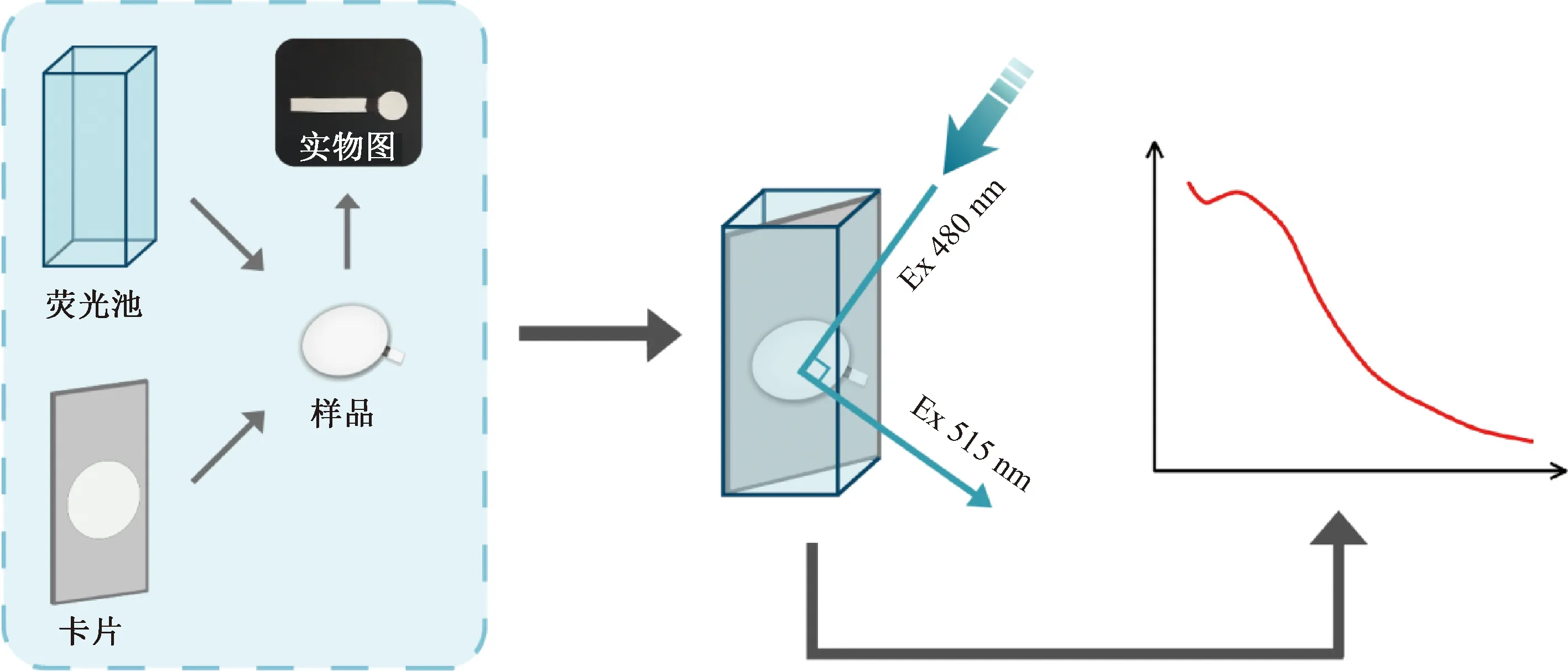
图1 荧光分光光度计检测纸基生物传感器的示意图Fig.1 Schematic diagram of detecting paper-based biosensor by fluorescence spectrophotometer

图2 纸基生物传感器检测OTA的原理图Fig.2 Schematic diagram of paper-based biosensor for OTA detection
2.2 纸基生物传感器用于OTA检测
使用纸基生物传感器对500 ng/mL的OTA进行检测,结果如图3所示。当OTA不存在时,测得的荧光信号较弱(曲线a),为468.50,这说明DNA双链结构形成,FAM的荧光信号成功被BHQ1猝灭。当OTA存在时,测得的荧光信号较强(曲线b),为637.59。这表明OTA-适配体复合物可以有效阻止cDNA-BHQ1与适配体结合,避免FAM的荧光被BHQ1猝灭。以上结果表明,OTA是引起荧光信号变化的关键因素,该纸基生物传感器被成功制备。
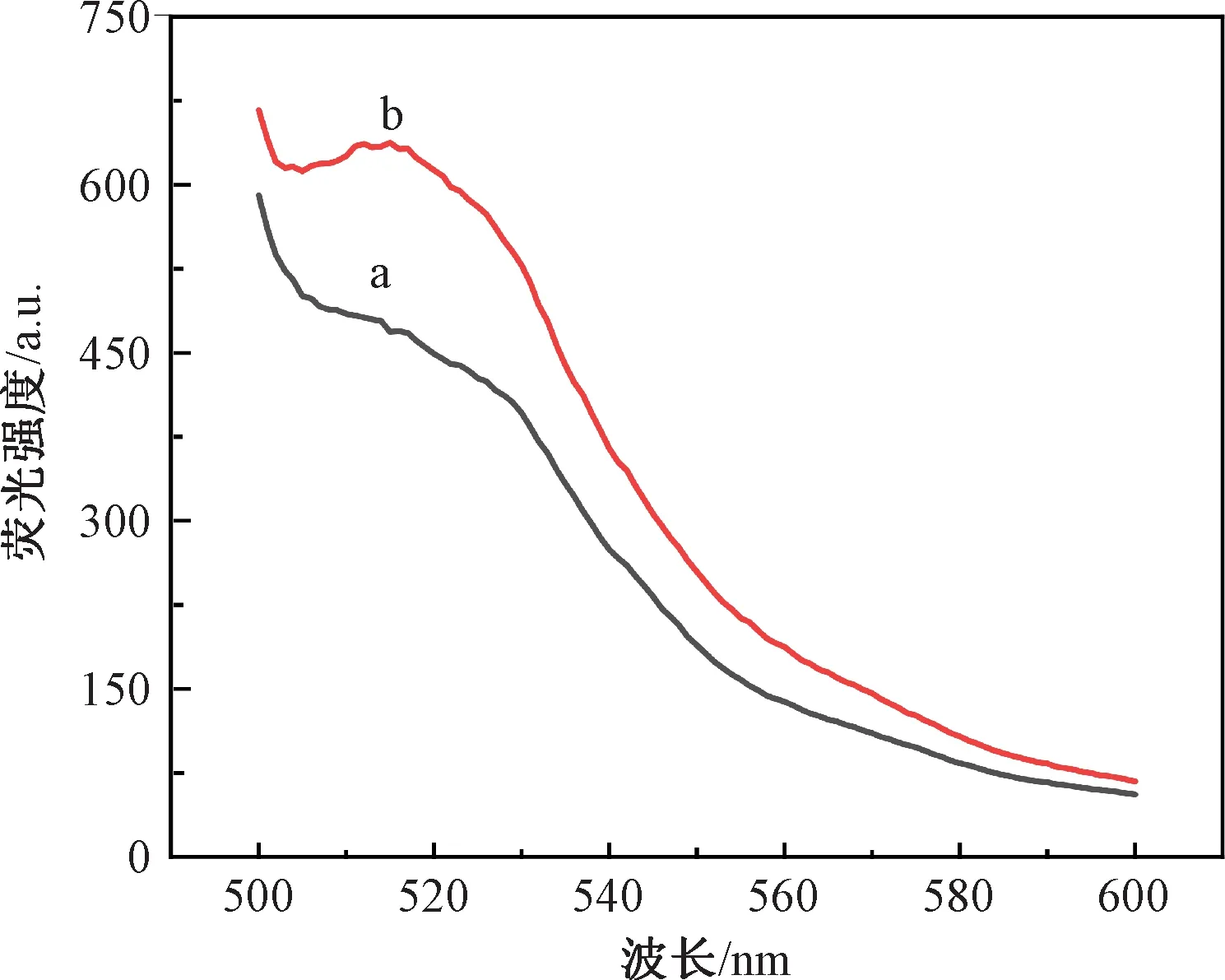
图3 纸基生物传感器的荧光光谱图Fig.3 Fluorescence spectra of paper-based biosensor
2.3 核酸适配体互补DNA序列的优化
为了使纸基生物传感器达到最佳的检测性能,对互补链cDNA-BHQ1与Apt-FAM互补的碱基序列进行了选择。依据NUPACK软件模拟结果(图4),分别选取了3条不同长度的互补序列cDNA12-BHQ1、cDNA18-BHQ1、cDNA24-BHQ1。试验结果如图5所示,F0为传感器与空白溶液孵育后的荧光强度,F为加入500 ng/mL OTA时传感器的荧光强度,F-F0表示为相对荧光强度(ΔF)。可以看出,当cDNA-BHQ1与适配体互补18个碱基时,有无目标物存在时的ΔF最大。这说明cDNA-BHQ1与适配体互补的碱基序列过多或过少时,都会影响传感器的检测性能,不利于传感器的构造。因此,选择cDNA18-BHQ1进行后续试验。

图4 Apt与不同cDNA的形成的二级结构图Fig.4 Diagram of secondary structure formed by Apt and different cDNA
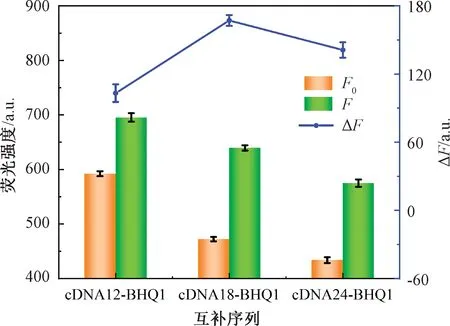
图5 不同cDNA对传感器荧光强度的影响Fig.5 Effect of different cDNA on the fluorescence intensity of the sensor
2.4 纸基生物传感器的检测性能分析

表2 用于检测OTA的纸基传感器的比较Table 2 Comparison of paper-based sensors for OTA detection
2.5 纸基生物传感器的特异性分析
为了验证本试验所制备的纸基生物传感器对OTA的选择性,在相同的试验条件下对其他毒素(伏马菌素B1(FB1)、T-2毒素、呕吐毒素(DON)、玉米赤霉烯酮(ZEN)、黄曲霉毒素B1(AFB1))进行了测试。由图7可知,当加入其他毒素孵育后,传感器的荧光信号没有明显增强;其他毒素与OTA混合孵育后,仍能实现对OTA的检测,表明所制备的纸基生物传感器具有良好的特异性。
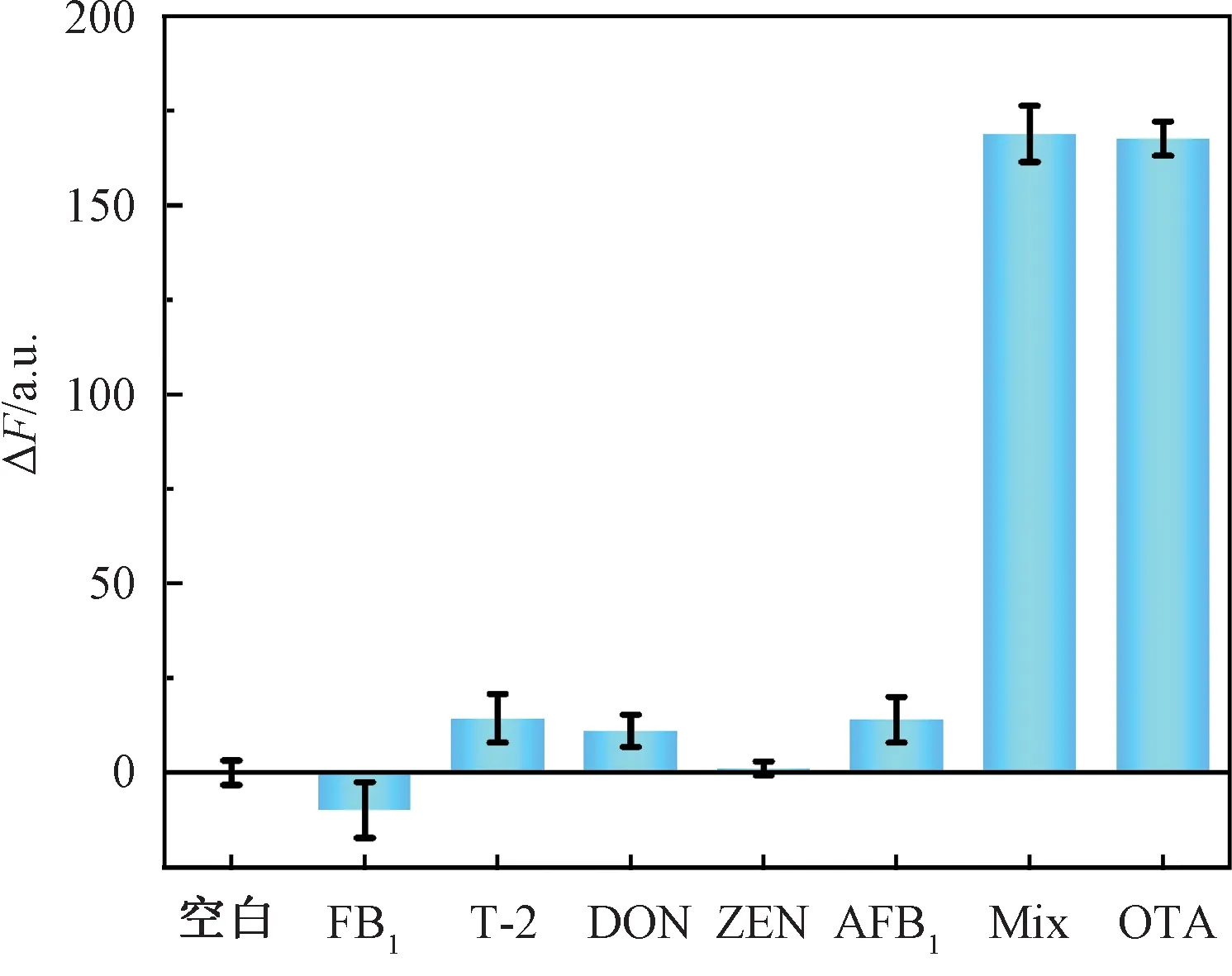
注:所用OTA的质量浓度为500 ng/mL,其他干扰毒素的质量浓度均为10 000 ng/mL,Mix为6种物质的混合物。图7 不同毒素对传感器特异性的影响Fig.7 Effects of different toxins on sensor specificity
2.6 纸基生物传感器的重现性和稳定性分析
在相同检测条件下,测定6个独立相同的传感器对500 ng/mL OTA的荧光响应值,来评估传感器的重现性。如图8 (A)所示,检测结果的RSD较低,为4.1%,表明该纸基生物传感器具有良好的重现性。传感器在适当的条件下进行储存,其检测能力的稳定性也是影响传感器性能的重要因素。因此,对纸基生物传感器的储存稳定性进行了测试。如图8 (B)所示,将传感器在4 ℃条件下储存7 d后,传感器的荧光强度保持在90%以上;在4 ℃条件下储存28 d后,传感器的荧光强度仍保持在60%以上。以上结果表明,该纸基生物传感器具有良好的稳定性。
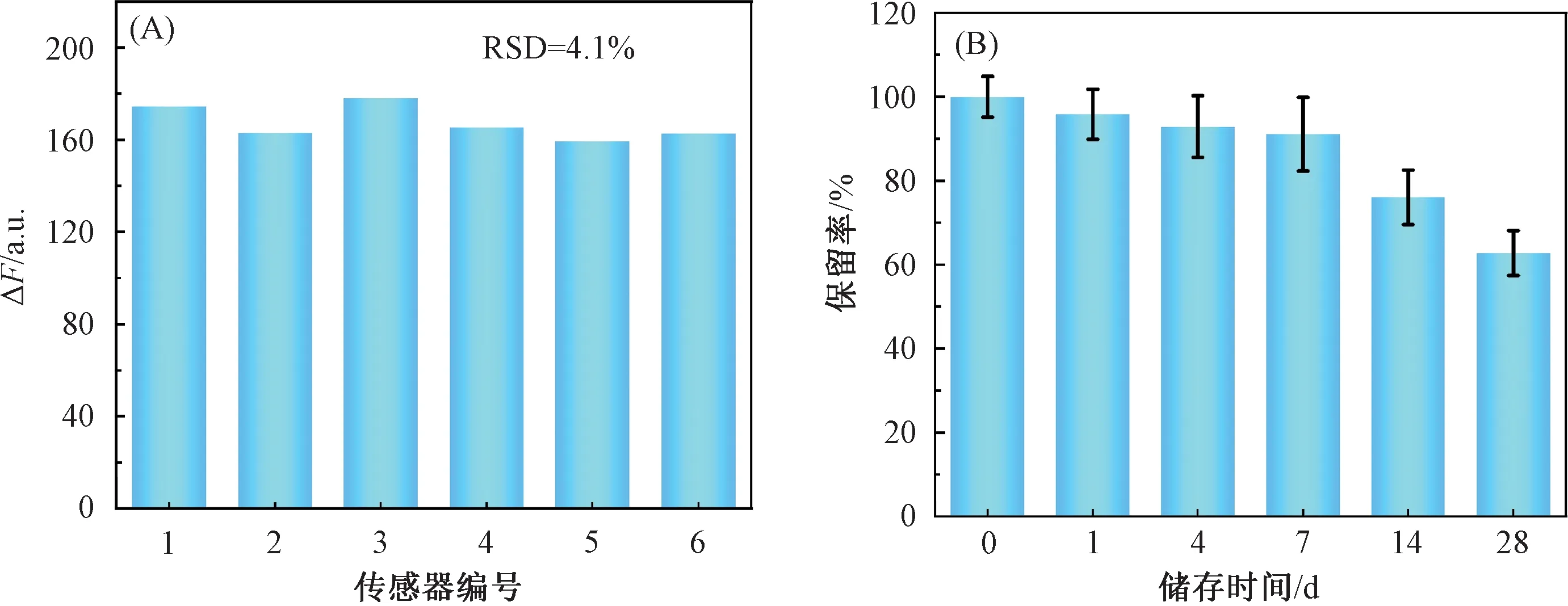
注:(A)纸基生物传感器的重现性; (B)纸基生物传感器的稳定性(OTA的质量浓度为500 ng/mL)。图8 传感器的重现性与稳定性Fig.8 Reproducibility and stability of different sensors
2.7 实际样品检测
为了验证本试验所制备的传感器在实际样品中的检测效果,对米粉、绿豆饼样品进行了加标检测,结果如表3所示。米粉样品和绿豆饼样品的平均回收率分别为89.2%~111.0%和89.0%~103.0%,RSD均低于10%,表明该传感器能够成功应用于实际样品的检测,且检测结果准确性较高。然后,通过检测经高效液相色谱法(HPLC)测定的玉米粉样品,进一步验证了该传感器的适用性,结果如表4所示。采用t检验进行分析,测定玉米粉中OTA的t均小于4.303,即均小于t(0.95 ,n=3),说明本试验制备的传感器与国标HPLC法无显著性差异。可以看出,所制备的纸基生物传感器具有一定的准确性,置信度为95%。表明该传感器具有实际应用的潜力。
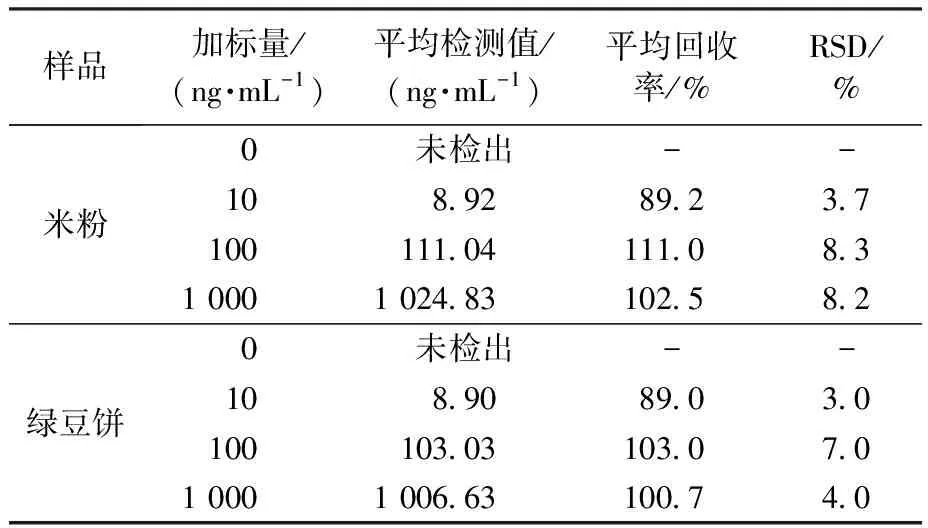
表3 米粉和绿豆饼中OTA的加标检测 (n=3)Table 3 OTA spiked detection in rice flour and mung bean cake (n=3)
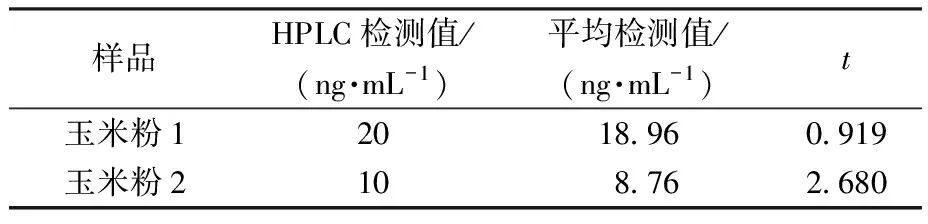
表4 玉米粉对照样品中OTA的检测 (n=3)Table 4 Detection of OTA in control samples of corn flour (n=3)
3 结论
本研究采用简单、低成本的纸基分析方法和快速响应的荧光分析方法,成功构建了基于FRET作用的纸基荧光生物传感器,用于食品中OTA的快速检测。该传感器采用适配体特异性识别OTA,具有良好的选择性,可以在多种真菌毒素存在的情况下进行检测。此外,该传感器还具有良好的重现性和稳定性,并成功应用于实际样品的检测,为实现现场快速检测真菌毒素提供了技术支持。
