硒化枯草芽孢杆菌肽聚糖的结构表征及体外抗氧化活性研究
2023-09-07杨智翔殷海成王金荣
杨智翔,殷海成,王金荣
河南工业大学 生物工程学院, 河南 郑州 450001
硒是谷胱甘肽过氧化物酶、硫氧还蛋白还原酶、甲酸脱氢酶、超氧化物歧化酶等多种抗氧化酶的辅因子,具有抗氧化、抗炎、免疫预防、抗病毒和抗癌等功能特性;同时糖尿病、癌症、血管硬化症等疾病也与缺硒有关,因此硒是人和动物不可或缺的微量元素。自然界中,硒的2种存在形式是无机硒和有机硒。有机硒与无机硒相比因容易被消化吸收而具有更高的生物利用度[1]。硒化多糖是不同来源的多糖与硒进行合成的有机硒化合物,在增强免疫调节[2-3]、降血糖、降血脂[4]和抗菌[5]等方面优于自然多糖。Malinowska等[6]的研究表明,硒元素与多糖通过化学合成的方式获得硒多糖,既可保持多糖的基本构型和生理功能,又能有效提高硒的生物利用度,发挥微量元素硒和多糖的复合功能。截至目前从微生物中发现的有机硒多糖很少或含量极低。但也有报道微生物多糖的硒化修饰,例如乳酸菌肽聚糖和嗜酸乳杆菌肽聚糖。
枯草芽孢杆菌(B.subtilis)是益生菌,具有抗感染、抗癌、抗过敏、免疫调节等功能特性,常用作饲料添加剂或免疫增强剂。肽聚糖(PG)是枯草芽孢杆菌胞壁的主要成分,由N-乙酰葡糖胺和N-乙酰胞壁酸通过β-1,4糖苷键连接而成。研究表明,PG具有多种生物活性,如抗感染、抗癌、抗过敏、免疫调节等,还可诱导内皮细胞产生免疫调节因子,如肿瘤坏死因子(TNF-α)、γ干扰素(IFN-γ)和白细胞介素[7]。实验室前期研究发现不同浓度的PG可保护由β-伴大豆球蛋白诱导引起的幼鲤肠道上皮细胞氧化损伤和炎症反应,提高肠上皮细胞抗氧化能力和抗炎能力[8]。目前未见关于B.subtilisPG硒化修饰的报道。
在微生物胞壁多糖硒化改性中,二氯氧化硒(SeOCl2)法和硝酸-亚硒酸钠(HNO3-Na2SeO3)法常用于多糖的硒化修饰。相关研究表明,使用HNO3-Na2SeO3法对多糖进行硒化修饰,对其分子主体和空间构型影响较小[9],并且该方法具有反应条件简单、生产速度快、改性剂的硒含量较高等优点。因此,在本研究中,采用HNO3-Na2SeO3法制备硒化肽聚糖(Se-PG),旨在表征Se-PG的结构特征以及评价其体外抗氧化活性,以期为Se-PG作为食品或饲料添加剂提供参考。
1 材料与方法
1.1 材料与试剂
石油醚、无水乙醇、碳酸钠、亚硒酸钠、三氯乙酸、硝酸、盐酸、溴化钾、水杨酸、二甲亚砜(DMSO)和巯基乙醇均为分析纯;1,1-二苯基-2-三硝基苯(2,2-diphenyl-1-picrylhydrazyl, DPPH)、2,2′-联氮-双-3-乙基苯并噻唑啉-6-磺酸(2, 2′-azino-bis(3-ethylbenzothiazoline-6-sulfonic acid), ABTS):上海源叶生物科技有限公司。透析袋(1 000 Da):北京索莱宝科技有限公司。
1.2 仪器与设备
ME-1004分析天平:梅特勒-托利多国际有限公司;ULTS1490恒温水浴振荡器:上海新苗医疗器械制造有限公司;213 pH计:上海精密仪器有限公司;ST16R高速冷冻离心机:赛默飞世尔科技有限公司;TGF-9073A电热恒温鼓风干燥箱:上海喆图科学仪器有限公司;TOPT-10D冷冻干燥机:西安特普讯仪器设备有限公司;L-8800全自动氨基酸分析仪:上海艾研生物科技有限公司;UV-3100PC紫外可见分光光度计:上海美普达仪器有限公司;FT-IR920红外光谱分析仪:天津市拓普仪器有限公司;AVANCEⅢ HD 500 MHz核磁共振波谱仪:德国布鲁克公司。
1.3 试验方法
1.3.1 硒化肽聚糖的制备
用优化后的三氯乙酸法提取B.subtilis细胞壁PG(蛋白质含量50.10%,总糖含量32.45%,分子质量70 kDa),冷冻干燥备用。称取100 mg酶解后的PG,加入体积分数为0.5%硝酸溶液中,充分混匀后,逐滴加入2.5 mL 0.05 g/mL的Na2SeO3溶液,然后在80 ℃下反应8 h后冷却至室温,用1 mol/L无水碳酸钠调节pH值为中性后离心。采用流水透析,透析过程中取透析液检测,当透析液中不含Na2SeO3时停止透析。将透析液浓缩,加入8倍体积的95%乙醇,静置过夜,离心后,沉淀用无水乙醇洗涤两次后复溶,冷冻干燥得Se-PG[10]。依据GB 5009.93—2010的方法,采用氢化物发生原子荧光光谱法分析Se-PG的硒含量,负电压为 300 V,灯电流为 80 mA,雾化温度为200 ℃,雾化气体高度为8 mm,载气流量为400 mL/min,屏蔽气流量为1 000 mL/min。
1.3.2 肽聚糖和硒化肽聚糖的结构表征
1.3.2.1 紫外光谱分析
分别将1.0 mg PG和Se-PG溶解于100 mL纯水中,混匀后用紫外分光光度计在波长190~400 nm下进行光谱扫描,扫描间距2 nm。
1.3.2.2 傅里叶红外光谱(FT-IR)分析
分别取1.0 mg在烘箱中烘2 h的PG和Se-PG样品,与干燥的溴化钾粉末以质量比1∶100混合,研磨均匀后压片,然后由傅里叶变换红外光谱仪检测,扫描波数3 500~500 cm-1。
1.3.2.3 核磁共振(NMR)分析
分别取50.0 mg PG和Se-PG样品,用DMSO溶解后冻干(重复3次),溶于1.0 mL DMSO,加入核磁管中。采用核磁共振仪在室温下分析1H NMR和13C NMR谱。
1.3.2.4 氨基酸组成测定
根据GB/T 5009.124—2016的方法,将PG和Se-PG样品烘干后粉碎,然后分别准确称取40 mg的样品放入2支水解管中,分别加入10 mL 6 mol/L的HCl和100 μL巯基乙醇,充氮气后密封水解管,于恒温干燥箱中110 ℃水解24 h后冷却,加入超纯水并定容至100 mL。取1.5 mL过滤到离心管,吸取200 μL重蒸苯酚于离心管,旋转蒸干,最后加入1 mL 0.02 mol/L的HCl,混匀。用全自动氨基酸分析仪进行分析测定。
1.3.3 体外抗氧化活性试验
1.3.3.1 DPPH自由基清除率的测定
根据李晓娇等[11]使用的方法,并稍加改动。试验分为空白对照组、硒化试剂组(Na2SeO3)和试验组(PG、Se-PG)。分别取2 mL梯度稀释(1.0、2.0、3.0、4.0、5.0 mg/mL)的Na2SeO3、PG、Se-PG溶液于15支试管中,向各组加入2 mL 0.1 mmol/L的DPPH溶液(无水乙醇配制),振荡混匀后,避光放置30 min,用无水乙醇调零,用紫外分光光度计测定517 nm波长下的吸光度,每组试验重复3次。
DPPH清除率= [1-(A1-A2)/A0]×100%,
式中:A0为2 mL超纯水 + 2 mL DPPH溶液的吸光度;A1为2 mL Na2SeO3、PG、Se-PG + 2 mL DPPH溶液的吸光度;A2为2 mL Na2SeO3、PG、Se-PG + 2 mL无水乙醇的吸光度。
1.3.3.2 ABTS自由基清除率的测定
根据Ma等[12]使用的方法,并稍加改动。试验分为空白对照组、硒化试剂组(Na2SeO3)和试验组(PG、Se-PG)。将等量7.4 mmol/L ABTS和2.6 mmol/L过硫酸钾充分混合,室温避光反应16 h,制备ABTS自由基。使用前,先将ABTS自由基溶液用无水乙醇稀释至在734 nm处的吸光度为0.70±0.02。分别取1 mL梯度稀释(1.0、2.0、3.0、4.0、5.0 mg/mL)的Na2SeO3、PG、Se-PG溶液于15支试管中,然后加入9 mL ABTS自由基溶液,室温下反应6 min,用蒸馏水调零,用紫外分光光度计测定734 nm波长处的吸光度,每组试验重复3次。
ABTS清除率=(1-A1/A0)×100%,
式中:A0为1 mL蒸馏水 + 9 mL ABTS溶液的吸光度;A1为1 mL Na2SeO3、PG、Se-PG + 9 mL ABTS溶液的吸光度。
1.3.3.3 ·OH自由基清除率的测定
根据罗敏等[13]使用的方法,并稍加改动。试验分为空白对照组、硒化试剂组(Na2SeO3)和试验组(PG、Se-PG)。分别取2 mL梯度稀释(1.0、2.0、3.0、4.0、5.0 mg/mL)的Na2SeO3、PG、Se-PG溶液于15支试管中,向每支试管中依次加入2 mL 9 mmol/L的FeSO4溶液,2 mL 9 mmol/L的水杨酸-乙醇溶液,2 mL 9 mmol/L的H2O2溶液,然后于37 ℃水浴锅中反应30 min,冷却至室温,用蒸馏水调零,用紫外分光光度计测定510 nm波长处的吸光度,每组试验重复3次。
羟基清除率=(A0-A1+A2)/A0×100%,
式中:A0为2 mL蒸馏水+2 mL H2O2+2 mL FeSO4+2 mL水杨酸-乙醇溶液的吸光度;A1为2 mL Na2SeO3、PG、Se-PG溶液+2 mL H2O2+2 mL FeSO4+2 mL水杨酸-乙醇溶液的吸光度;A2为2 mL Na2SeO3、PG、Se-PG溶液+2 mL蒸馏水+2 mL FeSO4+2 mL水杨酸-乙醇溶液的吸光度。
1.4 数据分析
数据用3个独立试验的平均值±标准偏差表示。使用SPSS 25.0软件进行统计分析,差异显著水平为P<0.05。采用Origin 2021软件作图。
2 结果与分析
2.1 肽聚糖和硒化肽聚糖的结构表征
2.1.1 肽聚糖和硒化肽聚糖紫外光谱分析
Se-PG的紫外光谱扫描如图1所示,由图1可知,在260 nm和280 nm处没有出现吸收峰,表明B.subtilisPG核酸和蛋白质都被完全消除,修饰前后的紫外全波长扫描图谱有显著的不同,PG本身无明显吸收峰,但PG经过修饰后出现了一个强的吸收峰,表明硒化修饰后,硒通过酯键的形式与PG结合,在209 nm处出现较强的吸收峰,归因于结构中存在亚硒酸酯。
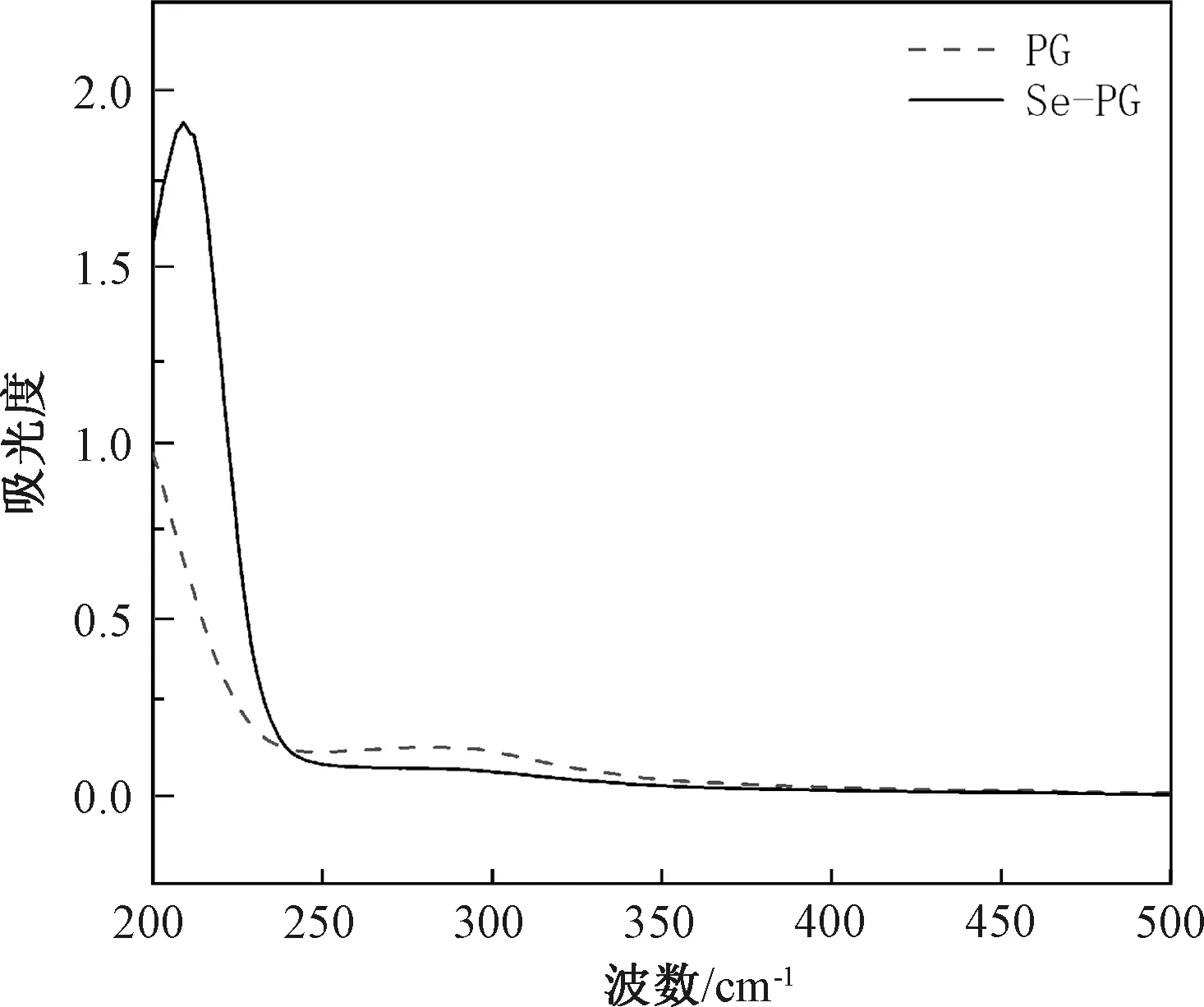
图1 肽聚糖和硒化肽聚糖紫外光谱Fig.1 UV spectra of PG and Se-PG

图2 肽聚糖和硒化肽聚糖傅里叶红外光谱Fig.2 FT-IR spectra of PG and Se-PG

2.1.3 肽聚糖和硒化肽聚糖核磁共振分析
在硒化修饰过程中,Na2SeO3优先与半缩醛羟基反应。在13C-NMR谱中,化学位移(δ)60.65~84.07 ppm的信号归因于残基的C-2到C-6。在1H-NMR谱中,δ5.0~5.4 ppm的化学位移与α-糖苷构型有关,δ3.20~4.20 ppm之间的信号可分配给糖苷环的H-2到H-5。由图3(a)与3(b)可知,在δ1.34 ppm位置的信号峰在硒化修饰后消失,由此推断与—CH2相连的—OH被硒基取代,且δ1.79 ppm位置的氢信号出现新的信号峰,推测为硒基取代乙酰氨基(CH3—CO—NH—)的特征峰。由图3(c)和3(d)可知,Se-PG在δ87.80 ppm处出现的新峰可以归属于硒化后硒元素取代的碳原子共振现象。

注:(a)PG 1H-NMR谱,(b)Se-PG 1H-NMR谱,(c)PG 13C-NMR谱,(d)Se-PG 13C-NMR谱。图3 肽聚糖和硒化肽聚糖核磁共振图谱Fig.3 13C-NMR and 1H-NMR spectra of PG and Se-PG
2.1.4 肽聚糖和硒化肽聚糖氨基酸分析
氨基酸组分分析是研究PG结构和组成的重要手段,用以确定PG肽链的连接方式,分析其免疫活性及抗氧化活性。氨基酸自动分析结果见表1,B.subtilisPG共含有17种氨基酸,硒化修饰前后其总氨基酸含量分别为47.74%和28.20%;其中含量较高的5种分别是丙氨酸、谷氨酸、赖氨酸、天冬氨酸和亮氨酸,这5种氨基酸组成了连接在N-乙酰胞壁酸3号碳原子上的短肽或肽桥(一条糖链肽尾3号位氨基酸氨基与另一条链4号位氨基酸羧基通过肽桥脱水缩合),而PG免疫效应的产生与四肽尾(L-Ala→D-Glu→L-Lys→D-Ala)和肽桥的交联结构存在联系;硒化修饰后,PG氨基酸种类并未发生改变,四肽尾结构未发生变化,保留了PG的生物学特性。

表1 PG和Se-PG氨基酸分析Table 1 Amino acid analysis of PG and Se-PG
2.2 硒化肽聚糖的抗氧化活性
通过氢化物发生原子荧光光谱法测得Se-PG中硒含量为369.32 μg/g。在抗氧化剂存在的情况下,DPPH自由基可以通过接受电子或氢被还原,常用于评估多糖等抗氧化剂的自由基清除能力,DPPH自由基清除率越高,抗氧化活性越高。由图4(a)可知,当Se-PG质量浓度增加时,DPPH自由基清除率随之增加,且在相同质量浓度下Se-PG自由基清除率显著高于PG (P<0.05)。当质量浓度为5 mg/mL时,PG和Se-PG的DPPH自由基清除活性分别为26.07%±0.82%和39.51%±0.26%。

注:曲线上不同字母表示样本之间存在显著差异(P<0.05)。图4 肽聚糖和硒化肽聚糖对DPPH、ABTS、羟基自由基清除作用Fig.4 DPPH, ABTS, and hydroxyl free radical scavenging ability of PG and Se-PG
由图4(b)可知,当Se-PG质量浓度增加时,ABTS自由基清除率随之增加,Se-PG自由基清除率显著高于PG(P< 0.05);在质量浓度为5 mg/mL时,PG和Se-PG的ABTS自由基清除活性分别为33.90%±0.45%和39.47%±0.98%。
·OH自由基被认为是最具活性的氧自由基,活性氧很容易穿过细胞膜与碳水化合物、脂质、氨基酸和DNA反应,导致细胞损伤甚至死亡。由图4(c)可知,PG和Se-PG对·OH自由基的清除有重要作用,当其质量浓度增加时,自由基清除率随之增加,当质量浓度为5 mg/mL时,PG和Se-PG的·OH自由基清除活性分别为40.24%±1.12%和48.38%±1.42%。
3 讨论
改性方法及多糖性质均会影响多糖硒化修饰的效果。颜炳祥等[14]采用二氯氧硒法对乳酸菌胞外多糖进行硒化修饰,得到的硒多糖的硒含量为169.228 μg/g;经HNO3-Na2SeO3法对嗜酸乳杆菌胞壁PG进行硒化修饰,得到的Se-PG硒含量为381.93 μg/g[15];李晓娇等[11]通过HNO3-Na2SeO3法制备得到的硒化铁皮石斛多糖硒含量为2.35 mg/g。本研究制备得到Se-PG的硒含量为369.32 μg/g。相关研究表明,HNO3-Na2SeO3法对多糖分子结构的影响较小[9],但不同来源的多糖由于基团及结构性质的不同,进行硒化修饰后,其复合物的硒含量出现相应的差异。

PG是B.subtilis细胞壁主要成分,占50%~80%,每个PG单体都由糖链、四肽尾和肽桥等组成,其中糖链是由N-乙酰葡糖胺和N-乙酰胞壁酸通过β-1,4糖苷键连接而成[23],PG免疫效应的发挥与其四肽尾和肽桥的交联程度相关[24]。本研究制备得到的硒化B.subtilisPG的氨基酸含量与修饰前比较,虽然每种氨基酸的含量都有所变化,但是主氨基酸组成并没有变化,仍为丙氨酸、谷氨酸、赖氨酸、天冬氨酸和亮氨酸。研究表明,谷氨酸、天冬氨酸、组氨酸、丝氨酸等氨基酸与金属离子螯合特性关系密切[25],机体内发生化学反应时,亚铁离子会被氧化成高价态,同时生成羟基自由基或超氧阴离子,而金属离子螯合物会阻断反应链,通过减少羟基自由基与超氧阴离子的生成,进而发挥抗氧化作用[26]。PG硒化修饰前后氨基酸构成没有发生明显变化就意味着PG仍然具有抗氧化效应,且增加了硒的抗氧化功能。
自由基是机体新陈代谢的中间产物,当机体应激时,机体内自由基的代谢量会超过正常免疫应答范围,引起自由基的连锁反应,活性氧(O2-、·OH、H2O2)的数量便会增加,促使蛋白质、碳水化合物、脂质等细胞基本组成物质遭受氧化反应而转化为新的自由基,进一步损伤机体器官,导致机体功能失调紊乱。PG的分子结构与其抗氧化活性相关,而亚硒酸钠本身对DPPH自由基具有较强的清除能力[27],硒化修饰后,硒化PG水解作用加强,支链结构增多,且侧链基团增多,也增加一定的亲水基,有助于活性提高;本研究结果显示,PG经硒化修饰后,引入的硒基团能够进一步增强PG对ABTS与·OH自由基的清除能力;因此Se-PG相较于PG,表现出更好的体外抗氧化活性。张钊瑞[28]提出,4 mg/mL乳酸菌PG清除DPPH、ABTS和羟基自由基的能力随水解时间延长逐渐增强。同样地,Xiao等[29]研究表明,与修饰前相比,硒化马尾藻多糖具有更强的亚铁离子螯合活性,具有更高的DPPH、ABTS自由基清除能力。另外,随着PG不断水解,糖苷键断裂,羟基、羧基、酰胺等能够提供电子基团的数量增多,不稳定的自由基能够捕获的电子随之增多,进而转化为稳定的产物,因此,促进了水解PG抗氧化能力的提升。新基团的形成可能会导致其供氢能力增强,因此,较高的硒含量通常会增强硒多糖的生物活性和其自由基的清除能力。PG硒化修饰后对ABTS、DPPH和·OH自由基清除率显著增加,且随质量浓度的增加,其抗氧化能力增强;Se-PG中的硒是以硒基团或硒酸酯形式存在的,硒基团或硒酸酯可以激活异构体碳的氢原子,并具有给予氢原子的能力,能够将更多的自由基转化为稳定的产物,提高PG的抗氧化能力。
4 结论
对制备得到的Se-PG进行结构表征及抗氧化活性测定,结果表明,硒化修饰后,氨基酸含量略有下降,但氨基酸种类整体没有变化,仍保留了主要氨基酸组成。通过紫外光谱、傅里叶红外光谱和核磁共振分析,均出现相应的特征吸收峰,表明Se-PG中硒主要以酯键的形式与PG结合。在体外抗氧化活性方面,Se-PG对ABTS、DPPH和·OH自由基有较强的清除作用。这些结果表明,Se-PG可以作为功能性抗氧化添加剂,提高机体的抗氧化能力。
