马铃薯转录因子StNAC043基因的克隆及其生理功能分析
2023-09-07唐鑫华曲自成李世伟刘玉霖
唐鑫华 曲自成 李世伟 刘玉霖 石 瑛*
(1.东北农业大学 农学院,哈尔滨 150030;2.国家大豆工程技术研究中心,哈尔滨150028)
马铃薯(SolanumtuberosumL.)是世界四大粮食作物之一,其块茎营养丰富、含有人体必需的全部七大类营养物质[1]。中国是世界第一大马铃薯生产国,产量约占世界总产量的1/4[2]。我国已于2015年启动马铃薯主粮化战略,马铃薯将逐渐成为我国第四大主粮作物[3]。但常规栽培四倍体马铃薯由于种质资源遗传基础相对狭窄及育种年限较长等原因,导致品种资源更新较慢,目前我国马铃薯平均单位面积产量低于世界平均水平[1,4]。因此,丰富马铃薯育种材料对于丰富其种质资源具有重要的意义。
转录因子(transcription factor,TF)是与目的基因启动子或增强子的区域相互作用来调控基因的表达的一类蛋白质[5]。NAC(NAM、ATAF1/2、CUC2)转录因子是植物特有的最大的转录因子家族之一,最早在矮牵牛属植物发现[6],NAC蛋白结构由高度保守的N端和可变的C端(TR)组成[7-8],该转录因子家族在调控植物生长发育进程、响应生物胁迫和非生物胁迫方面具有重要作用[9-12]。在植株生长发育方面,研究表明转录因子AtNAC2基因在拟南芥中过表达可以促进转基因植株侧根生长[13];转CarNAC1基因棉花的净光合速率、抗氧化酶酶活、单铃重均显著高于野生型[14];番茄转录因子SlNAC1和SlNAC4基因通过影响乙烯合成和类胡萝卜素积累可调控番茄的成熟[15-16];将紫花苜蓿MsNAC2基因转入烟草,在非生物逆境胁迫下转基因烟草的株高、根长、鲜重和干重等生长指标均高于野生型[17];转录因子ANAC071和ANAC096基因能够促进拟南芥茎段愈伤组织细胞形成[18]。在植株抵御非生物抗性方面,研究表明水稻的ONAC045基因[19]、玉米的ZmNAC111基因[20]、棉花的CarNAC1基因[14]过量表达可以提高植株耐干旱胁迫能力,BraNAC基因上调表达能提高白菜型冬油菜耐低温能力[21],细叶百合LpNAC6基因可以提高转基因烟草的耐盐性[22],而抑制水稻OsNAC2基因的表达能提高水稻抗旱性[23]、在转基因拟南芥中BcNAC036表达与耐高温性呈显著负相关[24];马铃薯StNAC2基因参与Cd的胁迫响应过程[25],将梭梭HaNAC1基因转入马铃薯、将马铃薯StNAC053基因转入拟南芥后均可提高转基因植株的耐盐性和抗旱性[26-27]。可见NAC转录因子在植物生长和抗逆等方面具有重要作用,但目前对四倍体马铃薯NAC转录因子在生理功能方面的研究报道却较少。本研究克隆了马铃薯转录因子基因StNAC043,用农杆菌介导法转入马铃薯‘东农 310’,获得StNAC043基因过量表达植株,并对转基因株系的根和茎的生长指标、叶绿素相对含量(SPAD)以及荧光参数(Fv/Fm、ETRmax)进行测定,以转录组测序结合qRT-PCR验证分析其下游调控基因,旨在探究马铃薯转录因子StNAC043基因的功能,以期为丰富马铃薯种质资源奠定基础。
1 材料与方法
1.1 试验材料
马铃薯‘东农 312’的脱毒组培苗和马铃薯‘东农 310’原原种,由黑龙江省哈尔滨市国家级农作物品种区域试验站提供。
1.2 试验方法
1.2.1目的基因的克隆和载体构建
基于曲自成等[28]对‘东农312’转录组测序和NCBI数据库比对结果,获得马铃薯转录因子StNAC043(LOC102584189)的CDS序列,根据该基因序列(去除终止密码子)添加BamH I和XbaI限制性内切酶位点设计特异性引物(表1)。提取‘东农312’叶片总RNA、反转录合成cDNA;利用特异引物StNAC043-CLO-F、StNAC043-CLO-R扩增转录因子StNAC043基因;PCR程序为:98 ℃预变性2 min; 98 ℃变性10 s,55 ℃退火5 s,72 ℃延伸15 s,35个循环; 72 ℃延伸10 min。用1%凝胶电泳检测扩增产物、回收纯化目的片段;将上述片段与pEASY®-Blunt克隆载体进行连接,转入大肠杆菌感受态细胞,涂布在含有50 mg/L卡那霉素(Kan)的LB固体培养基,37 ℃培养。挑单菌落,以StNAC-CDS-F和StNAC-CDS-R特异引物PCR检验,反应体系:2xTaq MasterMix(Dye) 10 μL、引物各1 μL、菌液2 μL,加水至20 μL;反应程序:94 ℃预变性2 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸30 s,35 个循环;72 ℃延伸10 min。选择与目的片段大小一致的阳性克隆单菌落测序。

表1 本研究所用引物序列Table 1 Primer sequences in the study
提取测序正确的大肠杆菌单菌落质粒;使用BamH I和XbaI双酶切上述质粒及pCAMBIA1302-GFP载体,凝胶电泳分离检测目的基因和线性化载体,并用试剂盒回收;使用T4连接酶连接目的基因与线性化载体,构建植物过表达载体pCAMBIA1302-GFP-StNAC043,冻融法转入农杆菌GV3101感受态细胞,摇菌后提取质粒;并用PCR扩增和BamH I、XbaI双酶切上述载体检测目的基因。
1.2.2目的基因遗传转化
将含有pCAMBIA1302-GFP-StNAC043质粒的农杆菌接种于含有50 mg/L Kan和20 mg/L利福平(Rif)的LB液体培养基,28 ℃、200 r/min震荡培养至OD600为0.5。5 000 r/min离心10 min,弃上清液后加入50 mL MS液体培养基,重悬菌液,加入乙酰基丁香酮(AS)至50 μmol/L。将表面消毒并去除种皮的‘东农 310’原原种切成约1 cm×1 cm×2 mm薄片,浸泡在菌液中10 min,每隔2 min摇匀1次。吸干残留菌液,平铺于含4 mg/L 玉米素(ZT)+1 mg/L 生长素(IAA)+50 μmol/L AS的MS固体培养基上,23 ℃暗培养48 h。清洗后浸泡于含200 mg/L头孢霉素(Cef)无菌水中30 s,冲洗、晾干后移至分化培养基(MS+4 mg/L ZT+1 mg/L IAA+500 mg/L Cef+6 mg/L潮霉素(Hyg),置于光照培养箱培养(25 ℃,16 h光照/8 h黑暗),每10 d继代1次。待分化芽长到2~3 cm时,扦插至生根培养基中(MS+200 mg/L Cef+6 mg/L Hyg),并对经检测的抗性植株进行无性系扩繁,备用。
1.2.3转基因植株检测
用植物基因组DNA提取试剂盒提取在生根培养基培育20 d的植株叶片基因组DNA,以其为模板,用载体基因GFP特异引物GFP-F和GFP-R进行PCR扩增检测,1%凝胶检验扩增条带。
1.2.4转基因植株qRT-PCR检测和分析
扩繁转基因植株和非转基因对照,培育20 d,用试剂盒提取植株根、茎、叶的总RNA,反转录合成cDNA,用Primer 5.0软件根据StNAC043基因序列设计定量引物,用UltraSYBR一步法荧光定量PCR试剂盒,以马铃薯Elfα基因为内参基因,反应体系总体积20 μL,其中cDNA 2 μL、引物各0.5 μL、2×UltraSYBR Mixture 10 μL、ddH2O 7 μL;应用实时荧光定量PCR仪(Line Gene 9620,杭州博日科技股份有限公司)进行qRT-PCR检测,反应程序为:预变性95 ℃ 10 min;95 ℃变性20 s,58 ℃退火30 s,72 ℃延伸32 s,40个循环。每个株系进行3次生物学重复。采用2-ΔΔCt算法,对基因相对表达量进行标准化计算。
1.2.5植株表型指标和叶绿素荧光参数测定
取长势均一的转基因植株和非转基因植株无性系扩繁,去除顶芽、切成1.5 cm茎段于MS培养基,光照培养箱培养25 d。用叶绿素仪SPAD-502(日本柯尼卡美能达公司)测定植株上部3片叶的叶绿素相对含量(SPAD);应用叶绿素荧光仪PAM-2500 (德国Heinz Walz GmbH公司)测定叶片叶绿素荧光参数(PSⅡ最大光化学量子产量Fv/Fm、最大电子传递速率ETRmax);应用LA-S型植物根系分析仪系统(LA-S,杭州万深检测科技有限公司)测定植株根系表型(总根长、根表面积、根直径、根体积),测定根系鲜重、株高和节间距;每个株系测定9株。
1.2.6转录组测序分析
为明确马铃薯转录因子StNAC043调控的下游基因,对转基因株系和非转基因植株无性系扩繁培育20 d,每个株系取3株,分别提取总RNA,由北京百迈客生物科技有限公司进行转录组测序。应用百迈克在线数据分析平台(www.biocloud.net)分析得出差异表达基因。结合表型数据和荧光参数差异选取部分差异表达基因qRT-PCR验证,3 次生物学重复,分析转录因子StNAC043调控的下游基因。
1.2.7数据分析
应用Excel 2012记录数据和做图,应用SPSS 23进行数据分析。
2 结果与分析
2.1 转录因子StNAC043基因的克隆及序列分析
由图1可知,以马铃薯‘东农 312’叶片cDNA为模板,利用特异性引物,扩增出的条带大小为955 bp(图1)。经测序分析,PCR扩增产物片段序列与StNAC043基因一致(不含终止密码子),StNAC043基因开放阅读框(ORF)942 bp,编码氨基酸313个(图2)。

M,分子量标记5 000;1、2,StNAC043基因PCR产物。M, Marker 5 000; 1 and 2, PCR Product of StNAC043 gene.图1 StNAC043基因电泳图Fig.1 StNAC043 gene electrophoresis map

图2 StNAC043基因核苷酸序列及所编码氨基酸序列Fig.2 Nucleotide sequence of StNAC043 gene and the encoded amino acid sequence
2.2 转基因植株检测及qRT-PCR分析
由图3可知,对6个抗性植株中长势良好的3个植株(ST1、ST2和ST3)提取基因组DNA并经PCR检测,ST1、ST2和ST3为转基因植株。
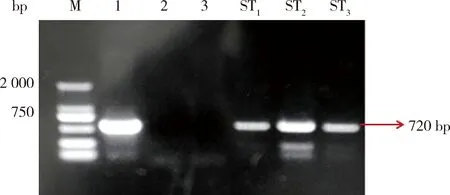
M,分子标记2000;1,阳性对照;2,ddH2O;3,非转基因植株;ST1、ST2、ST3抗性植株。M,DNA marker 2000; 1,positive control; 2,ddH2O; 3,non-transgenic plants; ST1, ST2, ST3 are resistant plants, respectively.图3 植株PCR检测电泳图Fig.3 Plant PCR detection electrophoresis map
由图4可知,经qRT-PCR检测,ST1、ST2和ST3的StNAC043在植株的叶、茎和根部相对表达量均显著高于CK,其中StNAC043基因在叶、茎和根的相对表达量分别比CK高 2.13~2.37、2.76~6.98和2.28~6.25倍,因此,ST1、ST2和ST3为StNAC043基因的过量表达植株。转基因株系和非转基因株系(CK)的茎和根中StNAC043相对表达量均高于叶片中的相对表达量,说明StNAC043基因在不同器官的表达存在显著差异。
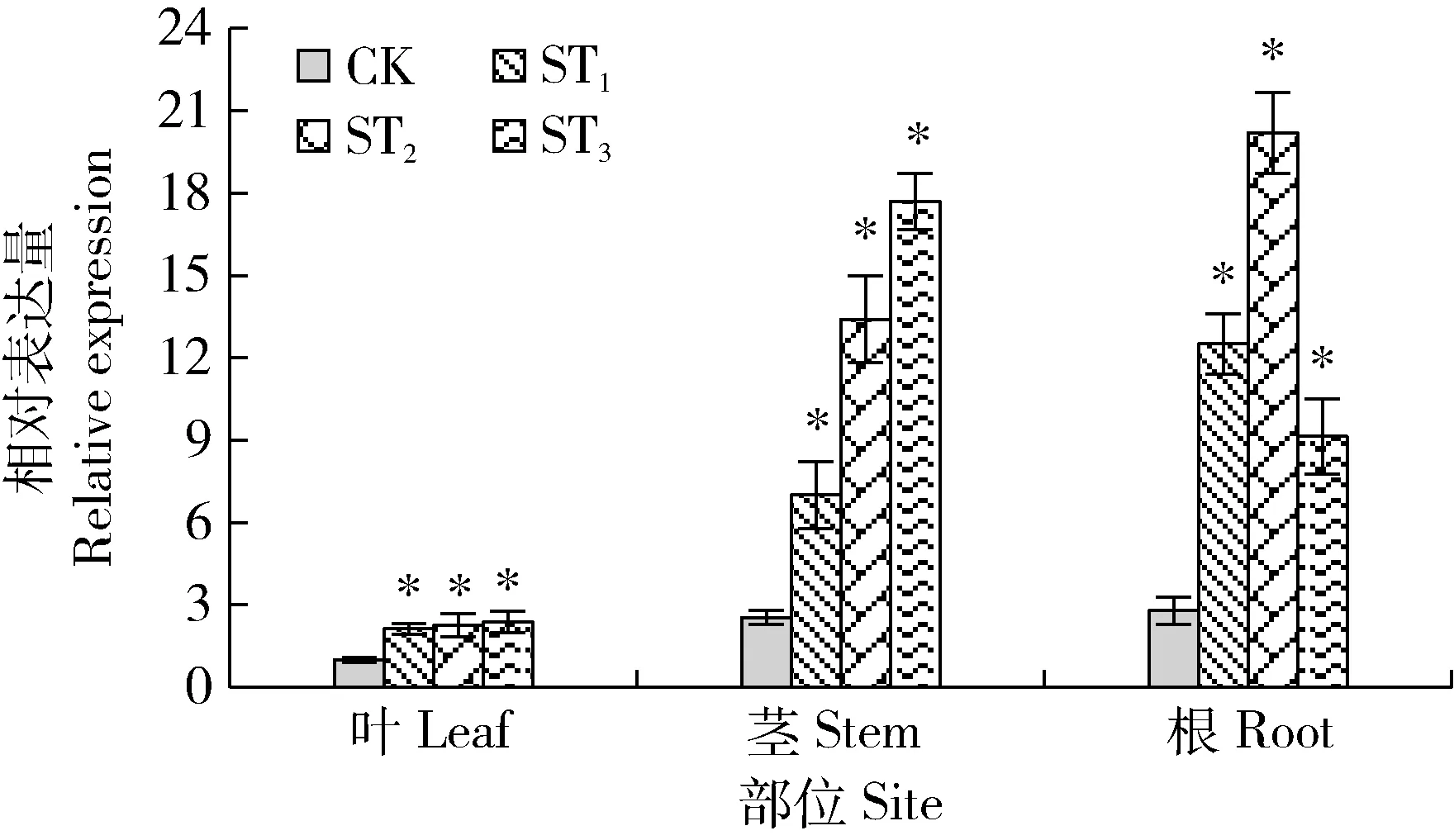
CK为非转基因株系,ST1、ST2和ST3为转基因株系。*表示转基因株系和CK之间差异显著(P<0.05)。下同。CK is non-transgenic control, ST1, ST2 and ST3 are transgenic lines. * indicates the significant difference between transgenic lines and CK (P<0.05). The same below.图4 StNAC043基因在不同部位相对表达量Fig.4 Relative expression of StNAC043gene in different parts
2.3 植株表型指标及叶绿素荧光参数分析
由图5可知,3个转基因株系长势均优于非转基因对照。由表2可知,转基因株系根的总长、表面积、体积、鲜重以及株高和节间距均显著高于CK,其中转基因株系总根长、根表面积、根体积、根鲜重、株高、节间距分别比CK高26.14%~37.20%、16.82%~26.03%、22.32%~37.50%、47.30%~83.78%、12.94%~25.53%、37.50%~46.88%。说明StNAC043基因过量表达可以促进马铃薯转基因植株根系和茎的生长。

图5 ‘东农 310’及转基因植株的幼苗Fig.5 Seedling of ‘Dongnong 310’ and transgenic lines

表2 转基因植株的表型指标Table 2 Phenotypic indicators of transgenic plant
由表3可知,转基因株系叶片的SPAD、Fv/Fm、ETRmax均显著高于CK,其中转基因株系叶片的SPAD 比CK高4.37%~16.67%、Fv/Fm比CK高10.93%~15.63%、ETRmax比CK高21.65%~36.91%。表明StNAC043基因的过量表达可以提高转基因植株叶片的SPAD、Fv/Fm和ETRmax。
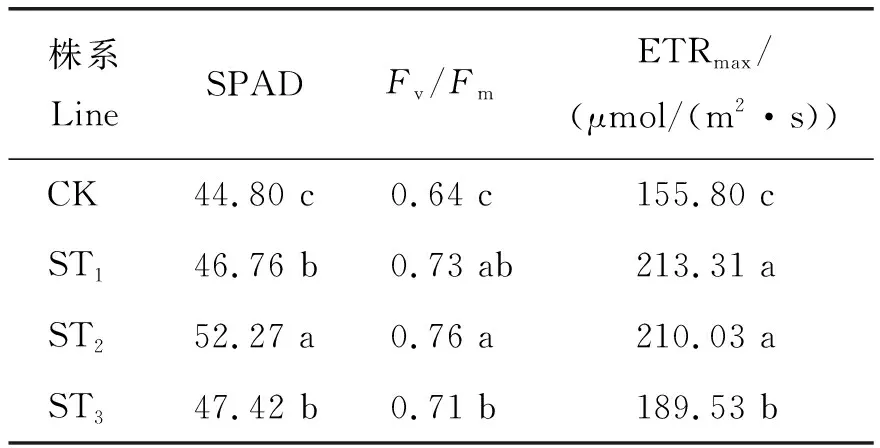
表3 叶绿素荧光参数Table 3 Chlorophyll fluorescence parameters
2.4 转录组测序分析及qRT-PCR验证
由图6可知,转录组测序数据表明转基因株系与非转基因对照植株存在615个差异表达基因,其中432个基因表达量上调,183个基因下调表达。对差异表达基因进行KEGG分类,发现光合作用-捕光蛋白(Photosynthesis-antenna proteins)通路的P<0.01且富集因子最高,表明StNAC043基因过量表达所调控的下游基因在此通路高度富集。经qRT-PCR检测表明转基因株系在此通路中的StCAB1和StCAB2基因相对表达量分别比CK高3.84~8.83和4.02~10.93倍(图7),说明转录因子StNAC043基因可以调控StCAB1和StCAB2基因表达。

图6 差异表达基因功能的KEGG分类Fig.6 KEGG classification of differentially expressed gene function

图7 StCAB1和StCAB2基因相对表达量Fig.7 Relative expression of StCAB1 and StCAB2
3 讨 论
NAC转录因子在调控植物生长发育进程、响应生物和非生物逆境胁迫方面具有重要作用[9-12]。本研究将克隆的NAC转录因子家族中的StNAC043基因转入马铃薯‘东农310’,使其过量表达,转基因植株的根系生长指标均高于非转基因对照,这与在烟草和拟南芥等模式植物中开展的研究结果一致[13,17,29]。Xie等[29]研究表明拟南芥NAC1基因在根尖和侧根生长原基表达,可通过调控生长素应答因子AIR3(auxin-induced in rootcultures3) 和DBP(DNA-binding protein)基因表达促进根系的发育,推测StNAC043基因正向调控与根系生长相关的基因,因此StNAC043过表达马铃薯植株根系生长优于非转基因对照植株。Huang等[30]在转基因水稻中研究表明转录因子NAC29和NAC31能调控纤维素合成酶基因CESA的表达,CESA基因与植物次生细胞壁形成有关,通过正向调控CESA基因表达可以促进水稻茎秆生长。在本研究中转基因植株的株高和节间距均高于非转基因对照,推测在马铃薯过表达植株中StNAC043基因促进马铃薯植株次生细胞壁合成。发达的根系和茎对于植物吸收水、养分及促进植株生长具有重要的作用[31],可以促进植株蒸腾作用、进而提高净光合速率,本研究中转基因株系的ETRmax高于非转基因植株,因此在转基因马铃薯中StNAC034基因可通过促进根系和茎的生长进而促进植株水分和养分的吸收,从而影响植株光合作用。
本研究中对转基因株系和非转基因植株转录组测序以及qRT-PCR验证表明转录因子StNAC043可以正向调控StCAB1、StCAB2基因表达,StCAB1、StCAB2基因均编码捕光色素结合蛋白,该类蛋白主要功能是收集光能并传递给光反应中心,在光反应的光能吸收阶段对光能捕获过程具有重要作用[32],StNAC043基因的过表达可能通过增加捕光色素结合蛋白StCAB1、StCAB2含量的方式促进叶片的叶绿素含量升高,本研究中转基因株系的Fv/Fm和SPAD均显著高于非转基因对照植株也与此推测吻合,转录因子StNAC043还可通过调控参与光反应的捕光色素结合蛋白基因的表达进而影响植株光合作用。
本研究中转基因株系和非转基因对照无性系扦插扩繁培养的环境条件相同,但非转基因植株叶片Fv/Fm显著低于转基因株系,Fv/Fm反映PSⅡ光能转换效率且非胁迫条件下该参数的变化极小、不受物种和生长条件的影响,而在胁迫条件下该参数显著下降[33],在组培条件下植株生长消耗MS固体培养基中的养分和水分,随着培养基中养分减少、pH和渗透压变化等对植株造成了一定非生物逆境胁迫,而转基因株系表现出所受胁迫影响较小,说明StNAC043基因的过量表达可能提高植株抗逆性、降低由于环境因素造成的非生物逆境胁迫对植株的影响,与申玉华等[17]、Zheng等[19]、刘彬等[22]在烟草等模式植物中的研究结果相似。StNAC043基因在马铃薯中提高非生物逆境胁迫抗性的机制仍需进一步深入研究。
4 结 论
马铃薯转录因子StNAC043基因在马铃薯‘东农310’中过量表达可以促进转基因植株幼苗根系和茎的生长,显著提高叶片SPAD、Fv/Fm和ETRmax;转录组测序表明转基因株系与非转基因株系的差异表达基因在光合作用-捕光蛋白通路高度富集;转录因子StNAC043可以调控捕光色素结合蛋白基因StCAB1和StCAB2的表达。
