脂肪间充质干细胞修复氧化损伤髓核细胞机制研究
2023-09-07段嘉豪,李兆勇,陈龙,刘恩旭,李硕夫,杨雷,杨少锋
段嘉豪,李兆勇,陈龙,刘恩旭,李硕夫,杨雷,杨少锋


〔摘要〕 目的 探究脂肪間充质干细胞(adipose-derived mesenchymal stem cell, ADSC)修复氧化损伤髓核细胞(nucleus pulposus cell, NPC)的作用机制。方法 实验分为NPC组、ADSC组、NPC+ADSC组、H2O2+NPC+ADSC组、H2O2+NPC组5组。采用H2O2构建NPC氧化损伤模型;SA-β-Gal染色分析NPC衰老程度;流式细胞仪检测NPC氧化损伤水平;Western blot检测ADSC中Collagen Ⅱ、Aggrecan蛋白表达水平,以及NPC中Collagen Ⅱ、p53、p21、TGF-β1、Smad2、p-Smad2蛋白表达水平;qPCR检测ADSC中Collagen Ⅱ、Aggrecan mRNA表达水平,以及NPC中Collagen Ⅱ、p53、p21、TGF-β1、Smad2 mRNA表达。结果 与H2O2+NPC组相比较,H2O2+NPC+ADSC组的NPC衰老数量减少(P<0.05),NPC氧化损伤减轻(P<0.05),p53、p21蛋白和基因表达下降(P<0.05),Collagen Ⅱ、TGF-β1、p-Smad2蛋白和基因表达升高(P<0.05)。与ADSC组相比,NPC+ADSC组Collagen Ⅱ、Aggrecan基因和蛋白表达升高(P<0.05)。结论 ADSC与NPC共培养不仅可以促进ADSC类髓核化,而且ADSC可修复氧化损伤的NPC,抑制其衰老,该过程可能与调控TGF-β1/Smad2信号通路有关。
〔关键词〕 脂肪间充质干细胞;髓核细胞;氧化损伤;细胞衰老;TGF-β1/Smad2信号通路
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.08.010
Mechanism of adipose-derived mesenchymal stem cells repairing
oxidatively damaged nucleus pulposus cells
DUAN Jiahao, LI Zhaoyong, CHEN Long, LIU Enxu, LI Shuofu, YANG Lei, YANG Shaofeng*
The First Hospital of Hunan University of Chinese Medicine, Changsha, Hunan 410007, China
〔Abstract〕 Objective To investigate the mechanism of adipose-derived mesenchymal stem cell (ADSC) repairing oxidatively damaged nucleus pulposus cell (NPC). Methods Five groups were divided as NPC group, ADSC group, NPC+ADSC group, H2O2+NPC+ADSC group, and H2O2+NPC group. Hydrogen peroxide (H2O2) was used to construct the oxidative damage model of NPC; SA-β-Gal staining was performed to analyze the degree of senescence in NPC; flow cytometer was used to determine the level of oxidative damage in NPC; Western blot was used to check the protein expressions of Collagen Ⅱ and Aggrecan in ADSC, and the protein expressions of Collagen Ⅱ, p53, p21, TGF-β1, Smad2, and p-Smad2 in NPC; qPCR was carried out to determine the mRNA expressions of Collagen Ⅱ and Aggrecan in ADSC, and the mRNA expressions of Collagen Ⅱ, p53, p21, TGF-β1, and Smad2 in NPC. Results Compared with H2O2+NPC group, H2O2+NPC+ADSC group showed a reduced number of senescent NPC (P<0.05), attenuated oxidative damage to NPC (P<0.05), decreased protein and mRNA expressions of p53 and p21 (P<0.05), and elevated protein and mRNA expressions of Collagen II, TGF-β1, and p-Smad2 (P<0.05). Compared with ADSC group, the protein and mRNA expressions of Collagen Ⅱ and Aggrecan were elevated in NPC+ADSC group (P<0.05). Conclusion Co-culture of ADSC and NPC can promote ADSC-like myelination, and ADSC can repair oxidatively damaged NPC and inhibit their senescence, which may be related to the regulation of TGF-β1/Smad2 pathway.
〔Keywords〕 adipose-derived mesenchymal stem cells; nucleus pulposus cells; oxidative damage; cell senescence; TGF-β1/Smad2
下腰痛(low back pain, LBP)是临床常见病、多发病。流行病学调查显示,80%的人一生中至少会出现一次下腰痛,造成了巨大的社会问题和经济负担[1]。椎间盘退变(intervertebral discs degeneration, IDD)是公认导致下腰痛的主要原因[2],其典型表现为髓核细胞(nucleus pulposus cell, NPC)衰老和死亡增加、细胞外基质(extracellular matrix, ECM)降解、蛋白聚糖和Ⅱ型胶原蛋白合成减少,炎症因子浸润、酸性环境增强等微环境恶化[3]。因此,如何防治IDD具有重要的现实意义。
目前,用于治疗IDD所引起腰背痛的经典方法是手术切除椎间盘以减轻疼痛[4],但手术并不能修复或减缓潜在的退行性病变。相比于单纯的机械性切除椎间盘,生物修复椎间盘具有恢复退变椎间盘生物功能、缓解病变、降低并发症等优点[5-7]。因此,细胞治疗是一种有潜力的修复IDD的治疗方法。
相较于其他干细胞,脂肪间充质干细胞(adipose mesenchymal stem cell, ADSC)因其来源丰富、易获取、无免疫排斥等优点成为修复退变椎间盘的理想候选细胞[8],可分泌生物活性因子以调节炎症,且具有分化为NPC的潜力[9]。TGF-β/Smad通路是IDD的经典信号通路,TGF-β1信号传导在IDD中发挥着重要调节作用[10]。本研究通过建立NPC氧化损伤模型,使用Transwell小室与ADSC共培养,探究ADSC类髓核化表现以及对NPC氧化损伤修复机制,旨为相关实验研究及临床应用提供一定的参考价值。
1 材料和方法
1.1 试剂和仪器
普诺赛人椎间盘髓核细胞完全培养基、PBS缓冲液(武汉普诺赛生命科技有限公司:批号:CM-H097、PB180327);成人ADSC完全培养基(海星生物科技有限公司,批号:ADHX-C101);0.25%胰酶消化液(北京索莱宝科技有限公司,批号:SL6020-100 mL);细胞培养皿、细胞培养瓶(贝兰伯,批号:CCD06-060A、CCB06-205);Costar Transwell小室(MERCK,批号:3412);30%过氧化氢(上海国药集团,批号:10011208);MTT试剂盒、β-半乳糖苷酶染色试剂盒、ROS检测试剂盒(碧云天,批号:C0602、C0009S、S0033);TGF-β1抗体、Collagen Ⅱ 抗體、过氧化酶山羊抗兔IgG二抗、β-actin抗体(Proteintech公司,批号:21898-1-AP、28459-1-AP、SA00001-2、66009-1-Ig);Aggrecan抗体、p-Smad2抗体、Smad2抗体(Abcam公司,批号:ab36861、ab188334、ab40855);p53抗体、p21抗体(CTS公司。批号:#2527、#2947);ChamQ Universal SYBR qPCR Master Mix(南京诺唯赞生物科技股份有限公司,批号:Q711-02);超净工作台、生物安全柜(苏州安泰空气技术有限公司,型号:SW-CJ-1FD、BSC-1300 II A2);倒置生物显微镜(德国徕卡,型号:DMI 1);二氧化碳培养箱(新加坡ESCO,型号:CCL-170B-8);冷冻离心机(美国CENTURION,型号:K2015R);荧光定量RCP仪(美国Thermo Fisher,型号:PIKOREAL96);多功能酶标仪(瑞士Tecan,型号:Spark 20M);电泳仪、凝胶成像仪(美国Bio-Rad,型号:PowerPac Basic、ChemiDocXRS+)。
1.2 细胞来源
成人ADSC(海星生物科技有限公司,批号:20210113S1);人椎间盘NPC(武汉普诺赛生命科技有限公司,批号:CP-H097)。
1.3 细胞培养及NPC氧化损伤模型
细胞融合至80%~90%用胰酶消化传至下1代,按1∶2进行传代,3~5 d换液1次,第3代开始进行实验操作。分别使用不同浓度(0、100、200、300、400、500 μmol·L-1)的H2O2造模,24 h后MTT法评价其对NPC抑制率,确定细胞毒性,计算半抑制浓度,选出H2O2构建NPC氧化损伤模型的最佳浓度。
1.4 Transwell小室ADSC/NPC共培养体系的构建及实验分组
采用孔径0.4 μm的Transwell小室6孔板建立细胞共培养体系,胰酶消化后将第3代ADSC置于上层的Transwell小室内,加入ADSC培养基,待ADSC贴壁后,下层接种第3代NPC。细胞接种密度2×105,接种比例为1∶1[11]。将实验分为5组,分别为NPC组、ADSC组、NPC+ADSC组、H2O2+NPC+ADSC组、H2O2+NPC组。其中NPC+ADSC组、H2O2+NPC+ADSC组接种于Transwell小室,NPC组、ADSC组、H2O2+NPC组接种于普通6孔板。
1.5 观察指标
1.5.1 活性氧(reactive oxygen species, ROS)检测 按照1∶1 000用无血清培养液稀释DCFH-DA,使终浓度为10 μmol/L,细胞消化收集后,悬浮于稀释好的DCFH-DA中,37 ℃细胞培养箱内孵育20 min。每隔3~5 min颠倒混匀一下,使探针和细胞充分接触。用无血清细胞培养液洗涤细胞3次,以充分去除未进入细胞内的DCFH-DA。上流式仪检测,用FITC通道收集信号。
1.5.2 SA-β-Gal染色分析 吸除细胞培养液,用PBS洗涤1次,加入500 μL β-半乳糖苷酶染色固定液,室温固定15 min。吸除细胞固定液,用PBS洗涤细胞3次,每次3分钟。吸除PBS,每孔加入500 μL染色工作液。37 ℃孵育过夜,保鲜膜封住24孔板防止蒸发,普通光学显微镜下观察,各组随机采取3个视野进行统计分析。
1.5.3 Western blot检测ADSC中Collagen Ⅱ、Aggrecan及NPC中Collagen Ⅱ、p53、p21、TGF-β1、Smad2、p-Smad2蛋白表达 收集細胞,加入100 μL RIPA裂解液,冰上裂解液15 min,12 000 r/min离心15 min,离心半径9 cm,取上清转移至新的1.5 mL离心管中,测定蛋白总含量。SDS-PAGE凝胶电泳分离后,转至PVDF膜,5%脱脂奶粉封闭,加入一抗Collagen Ⅱ(1∶500);Aggrecan、P53(1∶1 000);P21(1∶1 000);TGF-β1(1:2 000);Smad2(1∶4 000);p-Smad2(1∶2 000),4 ℃孵育一抗过夜,次日取出膜,于室温摇床用PBST洗涤3次,加入二抗于室温摇床孵育1 h,再次洗膜 3 次,使用ECL化学发光液显色曝光、摄像。
1.5.4 qPCR检测ADSC中Collagen Ⅱ、Aggrecan及NPC中Collagen Ⅱ、p53、p21、TGF-β1、Smad2 mRNA表达 收集ADSC和NPC,通过Trizol法提取总RNA,以总RNA为模板,逆转录cDNA加入扩增反应体系,在NCBI上搜索目的基因的序列,运用Primer 5软件进行引物设计,引物由金斯瑞生物科技股份有限公司合成,以β-actin为内参,采用2-△△Ct法计算,相关引物序列信息见表1。
1.6 统计学方法
本实验采用GraphPad Prism 9.0进行数据分析和统计,所有实验至少重复3次,采用“x±s”表示,两组比较采用Student's t检验,多组比较采用Turkey's t检验。以P<0.05为差异具有统计学意义。
2 结果
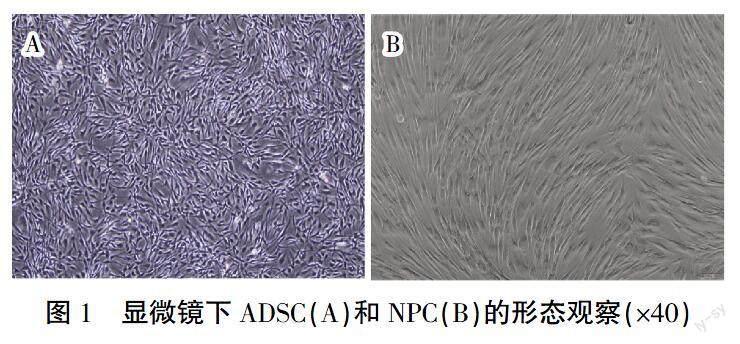
2.1 人源ADSC和NPC细胞形态学及鉴定
为避免提取原代时细胞污染,同时为提高细胞纯度和活性,已购买人源ADSC和NPC,其中ADSC形态呈纺锤形,NPC形态呈长梭形,详见图1。
2.2 NPC造模浓度及氧化损伤水平
H2O2对NPC的IC50=122 μmol/L,选择100 μmol/L为造模浓度,在造模24 h后对各组的ROS水平进行检测,与H2O2+NPC组相比,H2O2+NPC+ADSC组荧光强度降低(P<0.05)。详见图2。
2.3 NPC衰老相关的β-半乳糖苷酶染色分析
与H2O2+NPC组相比,H2O2+NPC+ADSC组中NPC的衰老数量减少(P<0.05)。详见图3。
2.4 Western blot检测各组ADSC中Aggrecan和Collagen Ⅱ蛋白表达差异
与ADSC组相比,NPC+ADSC组中ADSC的Aggrecan和Collagen Ⅱ蛋白含量明显升高(P<0.05)。详见图4。
2.5 Western blot检测各组NPC中Collagen Ⅱ、p21、p53、TGF-β1、Smad2、p-Smad2蛋白表达差异
与H2O2+NPC组相比,H2O2+NPC+ADSC组Collagen Ⅱ蛋白表达水平增加(P<0.05),p53、p21蛋白表达水平降低(P<0.05),TGF-β1、p-Samd2蛋白表达水平增加(P<0.05)。详见图5。
2.6 qPCR检测ADSC细胞中Aggrecan、 Collagen Ⅱ mRNA及NPC细胞中Collagen Ⅱ、p21、p53、TGF-β1、Smad2 mRNA表达水平
与ADSC组相比,NPC+ADSC组中ADSC的Aggrecan和Collagen Ⅱ mRNA表达量升高(P<0.05);与H2O2+NPC组相比,H2O2+NPC+ADSC组NPC中的Collagen Ⅱ mRNA表达量增加(P<0.05),p53、p21 mRNA表达量减少(P<0.05),TGF-β1、Smad2 mRNA表达量增加(P<0.05)。详见图6。
3 讨论
IDD是一个复杂的细胞介导的过程[12],炎症、氧化应激、线粒体功能障碍、异常机械负荷、端粒缩短、DNA损伤和营养不良等因素都会导致椎间盘细胞衰老和死亡,最终导致IDD[13]。其中氧化应激是由于椎间盘细胞内线粒体和过氧化物酶体代谢异常,过量的ROS产生从而引发NPC衰老和凋亡[14],而ECM降解会增加NPC内的ROS,TGF-β1/Smad通路被抑制,同时加剧氧化应激诱导的细胞衰老,上调NPC中p53和p21的表达[15],从而恶性循环,加速IDD。
TGF-β1是NPC内重要的生长因子,TGF-β1不仅可促进ADSC类髓核化[16],而且还可抑制NPC纤维化[17],其可与细胞膜上受体结合,使Smad2、Smad3磷酸化与Smad4结合进入细胞核调控靶基因的表达[18]。YANG等[19]通过检测正常和退变人椎间盘组织中TGF-β1含量,发现在正常椎间盘组织中TGF-β1是显着高于退变组织中的TGF-β1。KRETOVA等[20]实验表明TGF-β通过NF1/Smad4复合物途径,抑制氧化应激损伤、DNA损伤和炎症反应。DNA末端的不完全复制是细胞衰老首要原因,从而激活p53-p21通路诱发复制性衰老[21]。KIM等[22]通过手术获得不同程度退变的髓核标本发现随着年龄的增长和椎间盘退变的进展,p53-p21通路被激活,SA-β-Gal表达加强,端粒缩短,端粒酶活性降低,衰老特征越发明显。p53、p21是NPC内衰老标志物,当NPC氧化应激后,TGF-β1/Smad通路受到抑制,而另一分支p53-p21通路激活[23],两者在不同程度上加速Aggrecan和Collagen Ⅱ降解,导致NPC衰老。
Aggrecan和Collagen Ⅱ是髓核組织中的主要成分,共同维持椎间盘机械强度和弹性[24],随着年龄的增长,Aggrecan和Collagen Ⅱ含量减少,ECM降解,椎间盘内微环境恶化,加剧了IDD发展[25]。RAGETLY等[26]发现通过Collagen Ⅱ诱导可改善间充质干细胞的黏附和软骨生成能力。LU等[27]发现Collagen Ⅱ通过调节Rho A/Rock信号通路可使ADSC向软骨细胞分化。
中医学将IDD归属于“腰痛”或“痹病”范畴。早在《素问·脉要精微论》中就有对其论述:“腰者,肾之府,转摇不能,肾将惫矣。”人至中年,元气渐衰、五脏不荣是腰痛病的主要病因病机,而外伤、劳损形成血瘀实邪为常见诱因,肾脏虚损,经脉困阻,气血运行不畅,而造成筋骨失养,故肾虚血瘀是IDD的基本病机。再生医学中干细胞经过诱导能使其向特定的细胞增殖、分化,从精的繁衍生命、化血化气、濡养脏腑等功能角度来看,干细胞的特性与中医中肾精的功能十分贴合[28];也有学者认为,干细胞并非是单纯肾精,而是以肾精为主,脏腑经络、气血髓等共同构成的多层次结构[29]。因此,在中医理论的指导下可推测ADSC治疗氧化损伤NPC可能起到了补肾益精、活血化瘀的功效。
本文从NPC氧化应激后衰老的角度阐述与ADSC共培养机制,旨在ADSC治疗IDD提供实验依据,但本文存在一定局限性,对于造模浓度未做时间梯度;Smad家族相关蛋白未全部检测;关于NPC衰老表型的发展,如细胞周期、炎症因子、趋化因子等[30]仍有待阐明。目前,临床上干细胞注射疗法治疗IDD还处于开发阶段,其具有巨大的发展潜力[31],但由于退变椎间盘内炎症、低氧、低PH值微环境影响干细胞移植功能[32]。下一步团队将利用补肾活血的中药或复方含药血清对ADSC进行干预,观察是否能进一步促进ADSC类髓核化,修复氧化损伤后的NPC;或是利用水凝胶包裹ADSC进行椎间盘内注射的在体实验,观察体内效果,以期能更好的治疗IDD。
参考文献
[1] URITS I, BURSHTEIN A, SHARMA M, et al. Low back pain, a comprehensive review: Pathophysiology, diagnosis, and treatment[J]. Current Pain and Headache Reports, 2019, 23(3): 23.
[2] 冯帅华, 徐无忌, 仇湘中, 等. 基于网络药理学研究六味地黄丸治疗腰椎间盘退变作用机制[J]. 陕西中医, 2022, 43(9): 1301-1304.
[3] YEE A, LAM M P, TAM V, et al. Fibrotic-like changes in degenerate human intervertebral discs revealed by quantitative proteomic analysis[J]. Osteoarthritis and Cartilage, 2016, 24(3): 503-513.
[4] BINCH A L A, FITZGERALD J C, GROWNEY E A, et al. Cell-based strategies for IVD repair: Clinical progress and translational obstacles[J]. Nature Reviews Rheumatology, 2021, 17(3): 158-175.
[5] 周 清, 阮狄克. 间充质干细胞修复椎间盘退变的研究进展[J]. 中国脊柱脊髓杂志, 2022, 32(6): 547-552.
[6] 刘明强, 陈海伟, 张广智, 等. 外泌体治疗椎间盘退变的研究进展[J]. 解放军医学杂志, 2021, 46(8): 831-836.
[7] BHUJEL B, SHIN H E, CHOI D J, et al. Mesenchymal stem cell-derived exosomes and intervertebral disc regeneration: Review[J]. International Journal of Molecular Sciences, 2022, 23(13): 7306.
[8] DAI X J, GUAN Y Y, ZHANG Z Z, et al. Comparison of the differentiation abilities of bone marrow-derived mesenchymal stem cells and adipose-derived mesenchymal stem cells toward nucleus pulposus-like cells in three-dimensional culture[J]. Experimental and Therapeutic Medicine, 2021, 22(3): 1018.
[9] VELIKONJA N K, URBAN J, FR?魻HLICH M, et al. Cell sources for nucleus pulposus regeneration[J]. European Spine Journal, 2014, 23(3): 364-374.
[10] CHEN S L, LEI L C, LI Z M, et al. Grem1 accelerates nucleus pulposus cell apoptosis and intervertebral disc degeneration by inhibiting TGF-β-mediated Smad2/3 phosphorylation[J]. Experimental & Molecular Medicine, 2022, 54(4): 518-530.
[11] HAN Z H, WANG Q G, WU X M, et al. Comprehensive RNA expression profile of therapeutic adipose-derived mesenchymal stem cells co-cultured with degenerative nucleus pulposus cells[J]. Molecular Medicine Reports, 2021, 23(3): 185.
[12] MIWA S, KASHYAP S, CHINI E, et al. Mitochondrial dysfunction in cell senescence and aging[J]. The Journal of Clinical Investigation, 2022, 132(13): e158447.
[13] CHEN H W, ZHANG G Z, LIU M Q, et al. Natural products of pharmacology and mechanisms in nucleus pulposus cells and intervertebral disc degeneration[J]. Evidence-Based Complementary and Alternative Medicine: ECAM, 2021, 2021: 9963677.
[14] CAO G S, YANG S D, CAO J Y, et al. The role of oxidative stress in intervertebral disc degeneration[J]. Oxidative Medicine and Cellular Longevity, 2022, 2022: 2166817.
[15] XIANG Q, ZHAO Y Z, LIN J L, et al. The Nrf2 antioxidant defense system in intervertebral disc degeneration: Molecular insights[J]. Experimental & Molecular Medicine, 2022, 54(8): 1067-1075.
[16] OSHIMORI N, FUCHS E. The harmonies played by TGF-β in stem cell biology[J]. Cell Stem Cell, 2012, 11(6): 751-764.
[17] SUN Y, LYU M M, LU Q J, et al. Current perspectives on nucleus pulposus fibrosis in disc degeneration and repair[J]. International Journal of Molecular Sciences, 2022, 23(12): 6612.
[18] ZOU M L, CHEN Z H, TENG Y Y, et al. The smad dependent TGF-β and BMP signaling pathway in bone remodeling and therapies[J]. Frontiers in Molecular Biosciences, 2021, 8: 593310.
[19] YANG H L, CAO C, WU C S, et al. TGF-βl suppresses inflammation in cell therapy for intervertebral disc degeneration[J]. Scientific Reports, 2015, 5: 13254.
[20] KRETOVA M, SABOVA L, HODNY Z, et al. TGF-β/NF1/Smad4-mediated suppression of ANT2 contributes to oxidative stress in cellular senescence[J]. Cellular Signalling, 2014, 26(12): 2903-2911.
[21] CHEN Q Z, SUN X L, LUO X L, et al. PIK3R3 inhibits cell senescence through p53/p21 signaling[J]. Cell Death & Disease, 2020, 11(9): 798.
[22] KIM K W, CHUNG H N, HA K Y, et al. Senescence mechanisms of nucleus pulposus chondrocytes in human intervertebral discs[J]. The Spine Journal: Official Journal of the North American Spine Society, 2009, 9(8): 658-666.
[23] SAMARAKOON R, HIGGINS S P, HIGGINS C E, et al. The TGF-β1/p53/PAI-1 signaling axis in vascular senescence: Role of caveolin-1[J]. Biomolecules, 2019, 9(8): 341.
[24] RISBUD M V, SHAPIRO I M. Role of cytokines in intervertebral disc degeneration: Pain and disc content[J]. Nature Reviews Rheumatology, 2014, 10(1): 44-56.
[25] FIANI B, COVARRUBIAS C, JARRAH R. Genetic predictors of early-onset spinal intervertebral disc degeneration: Part one of two[J]. Cureus, 2021, 13(5): e15182.
[26] RAGETLY G, GRIFFON D J, CHUNG Y S. The effect of type II collagen coating of chitosan fibrous scaffolds on mesenchymal stem cell adhesion and chondrogenesis[J]. Acta Biomaterialia, 2010, 6(10): 3988-3997.
[27] LU Z F, DOULABI B Z, HUANG C L, et al. Collagen type II enhances chondrogenesis in adipose tissue-derived stem cells by affecting cell shape[J]. Tissue Engineering Part A, 2010, 16(1): 81-90.
[28] 王旭杰, 王妙然, 张 蕊, 等. “先天之精”干细胞与中医学理论相关性探析[J]. 西部中医药, 2022, 35(6): 60-63.
[29] 温昊天, 隋 华, 李 琦, 等. 干细胞与中医理论关系的思考[J]. 中华中医药杂志, 2017, 32(4): 1422-1424.
[30] XIN J G, WANG Y J, ZHENG Z, et al. Treatment of intervertebral disc degeneration[J]. Orthopaedic Surgery, 2022, 14(7): 1271-1280.
[31] XIA Y L, YANG R H, HOU Y L, et al. Application of mesenchymal stem cell-derived exosomes from different sources in intervertebral disc degeneration[J]. Frontiers in Bioengineering and Biotechnology, 2022, 10: 1019437.
[32] YU L, LIU Y, WU J X, et al. Genipin cross-linked decellularized nucleus pulposus hydrogel-like cell delivery system induces differentiation of ADSCs and retards intervertebral disc degeneration[J]. Frontiers in Bioengineering and Biotechnology, 2021, 9: 807883.
(本文編辑 苏 维)
