芹菜素调节AMPK/mTOR通路对子痫前期胎盘滋养细胞自噬的影响研究
2023-09-07王光祖,王少敏,乔素兰,李晓敬,姚春霞,布兰娜
王光祖,王少敏,乔素兰,李晓敬,姚春霞,布兰娜


〔摘要〕 目的 探究芹菜素對子痫前期(preeclampsia, PE)胎盘滋养细胞自噬的影响及可能的作用机制。方法 取人绒毛膜滋养层HTR-8/Svneo细胞,采用缺氧复氧1 h(hypoxic-reoxygenation 1 h, H1R1)诱导建立PE细胞模型,并通过MTT法检测芹菜素对HTR-8/Svneo细胞毒性的影响。取对数生长期的HTR-8/Svneo细胞,分为对照组、H1R1组、腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)激活剂阿卡地新(acadesine, AICAR)组(1 mmol/L)、芹菜素低剂量组(10 μmol/L)、芹菜素高剂量组(20 μmol/L)、芹菜素+AICAR组(芹菜素20 μmol/L+AICAR 1 mmol/L)。采用MTT法检测细胞活力;透射电子显微镜观察细胞自噬情况;划痕实验和Transwell小室实验检测细胞迁移、侵袭能力;Western blot法检测细胞AMPK/哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)通路和自噬、侵袭相关蛋白的表达。结果 与对照组比较,10、20 μmol/L芹菜素对HTR-8/Svneo细胞增殖有促进作用(P<0.05)。与对照组比较,H1R1组细胞在24、48、72 h时细胞活力、划痕愈合率和穿膜细胞数、N-钙黏蛋白(N-cadherin)表达、p-mTOR/mTOR比值显著降低(P<0.05),微管相关蛋白1轻链3-Ⅱ(microtubule-associated protein 1 light chain 3-Ⅱ, LC3Ⅱ)/微管相关蛋白1轻链3-Ⅰ(microtubule-associated protein 1 light chain 3-Ⅰ, LC3Ⅰ)比值、Beclin-1和E-钙黏蛋白(E-cadherin)表达、p-AMPK/AMPK比值显著升高(P<0.05),自噬小体数量增多(P<0.05);与H1R1组比较,芹菜素低、高剂量组细胞活力、划痕愈合率和穿膜细胞数、N-cadherin表达、p-mTOR/mTOR比值显著升高(P<0.05),LC3II/LC3I比值、Beclin-1和E-cadherin表达、p-AMPK/AMPK比值显著降低(P<0.05),自噬小体数量减少(P<0.05);与芹菜素高剂量组比较,芹菜素+AICAR组细胞在24、48、72 h时细胞活力、划痕愈合率和穿膜细胞数、N-cadherin表达、p-mTOR/mTOR比值显著降低(P<0.05),LC3II/LC3I比值、Beclin-1和E-cadherin表达、p-AMPK/AMPK比值显著升高(P<0.05),自噬小体数量增多(P<0.05)。结论 芹菜素能增强滋养细胞的侵袭能力,改善PE,其作用机制可能与抑制AMPK/mTOR通路介导的胎盘滋养细胞过度自噬有关。
〔关键词〕 芹菜素;子痫前期;胎盘滋养细胞;自噬;迁移;侵袭;腺苷酸活化蛋白激酶;哺乳动物雷帕霉素靶蛋白
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.08.008
Effects of apigenin on autophagy of placental trophoblast cells in preeclampsia by regulating AMPK/mTOR pathway
WANG Guangzu1, WANG Shaomin1, QIAO Sulan1, LI Xiaojing1, YAO Chunxia2, BU Lanna1*
1. Department of Neonatology, Handan Maternal and Child Health Hospital & Handan Children's Hospital, Handan, Hebei 056000, China; 2. School of Medicine, Hebei University of Engineering, Handan, Hebei 056038, China
〔Abstract〕 Objective To explore the effects of apigenin on autophagy of placental trophoblast cells in preeclampsia (PE) and its possible mechanism of action. Methods Human chorionic trophoblast HTR-8/Svneo cells were taken and hypoxia-reoxygenation 1 h (H1R1) was used to induce the establishment of PE cell models. The effects of apigenin on HTR-8/Svneo cytotoxicity was tested by MTT method. In addition, HTR-8/Svneo cells in logarithmic growth phase were taken and divided into control group, H1R1 group, adenosine monophosphate-activated protein kinase (AMPK) activator acadesine (AICAR) group (1 mmol/L), low-dose apigenin group (10 μmol/L), high-dose apigenin group (20 μmol/L), and apigenin+AICAR group (apigenin 20 μmol/L+AICAR 1 mmol/L). Cell viability was determined by MTT method; cell autophagy was observed by transmission electron microscope; cell migration and invasion ability were tested by scratch assay and Transwell chamber assay. Western blot method was used to examine the related protein expressions of cellular AMPK/mammalian target of rapamycin (mTOR) pathway, autophagy, and invasion. Results Compared with the control group, 10 and 20 μmol/L apigenin had a promoting effect on the proliferation of HTR-8/Svneo cells (P<0.05). Compared with the control group, the cell viability at 24, 48, and 72 h, scratch healing rate, number of transmembrane cells, N-cadherin expression, and p-mTOR/mTOR ratio of the H1R1 group were significantly lower (P<0.05), while the microtubule-associated protein 1 light chain 3 Ⅱ (LC3Ⅱ)/microtubule-associated protein 1 light chain 3 Ⅰ(LC3Ⅰ) ratio, Beclin-1 and E-cadherin expressions, p-AMPK/AMPK ratio were significantly higher (P<0.05), and the number of autophagosomes increased (P<0.05); compared with the H1R1 group, the cell viability at 24, 48, and 72 h, scratch healing rate, number of transmembrane cells, N-cadherin expression, and p-mTOR/mTOR ratio in low- and high-dose apigenin groups were significantly elevated (P<0.05), while LC3II/LC3I ratio, Beclin-1 and E-cadherin expressions, and p-AMPK/AMPK ratio were significantly reduced (P<0.05), and the number of autophagosomes became lower (P<0.05); compared with high-dose apigenin group, the cell viability at 24, 48 and 72 h, scratch healing rate, number of transmembrane cells, N-cadherin expression, and p-mTOR/mTOR ratio of apigenin+AICAR group were significantly lower (P<0.05), while LC3II/LC3I ratio, Beclin-1 and E-cadherin expressions, and p-AMPK/AMPK ratio were significantly higher (P<0.05), and the number of autophagosomes increased (P<0.05). Conclusion Apigenin can enhance the invasion ability of trophoblast cells and thus improve PE, and its mechanism of action may be related to the inhibition of the excessive autophagy of placental trophoblast cells mediated by AMPK/mTOR pathway.
〔Keywords〕 apigenin; preeclampsia; placental trophoblast cells; autophagy; migration; invasion; adenosine monophosphate-activated protein kinase; mammalian target of rapamycin
子痫前期(preeclampsia, PE)是妊娠期女性常见的一种母婴共患疾病,胎盘是PE发病机制的核心,与异常滋养层细胞浸润有关[1]。自噬在胚胎发生、植入和妊娠维持中起着重要作用,过度自噬被认为是PE发病过程中胎盘的一个重要特征[2],对滋养细胞自噬的调节是治疗PE的重点。芹菜素是一种黄酮类化合物,具有抗氧化和抗炎作用,亦可降低胰岛素抵抗,改善妊娠糖尿病,而胰岛素抵抗为PE的病因之一[3]。此外,芹菜素还可抑制内质网应激,改善妊娠糖尿病大鼠胰腺组织损伤和胰岛细胞凋亡[4],并可改善妊娠高血压[5]。芹菜素的作用可能与其控制自噬的能力有关[6-7]。然而,芹菜素是否能调节PE中滋养细胞自噬尚未可知。
哺乳动物雷帕霉素靶蛋白(mammalian target of rapamycin, mTOR)是调节细胞自噬的关键蛋白,已有研究证实,PE期间p-mTOR胎盘表达降低、mTOR信号通路抑制,通过降低滋养层细胞的侵袭能力诱导PE的发生[8];激活mTOR信号通路可增强PE大鼠胎盘滋养细胞增殖分化[9]。而在PE期间,与mTOR通路相关的基因p-AMPK胎盘表达增加,并且与正常孕妇相比,严重PE患者腺苷酸活化蛋白激酶(adenosine monophosphate-activated protein kinase, AMPK)较高[10]。AMPK是细胞能量代谢的关键调节因子,对于正常胎盘和胚胎发育至关重要。AMPK的过度激活会损害PE中滋养细胞的侵袭性[11]。mTOR是AMPK的下游靶标之一,AMPK和mTOR的活性在自噬调节方面具有拮抗作用,AMPK激活负向调节mTOR活性、正向调节自噬活性[12]。据报道,重度PE患者胎盘中mTOR活性下降,滋养细胞自噬过度激活,侵袭能力降低;抑制胎盘滋养细胞自噬,可延缓PE进展[13]。这提示,PE患者胎盘中AMPK的激活可下调mTOR活性,诱导滋养细胞过度自噬,可能是PE发病的重要机制。基于以上研究,本研究推测芹菜素可能通过AMPK/mTOR通路调控PE胎盤滋养细胞自噬,并对此展开研究。
1 材料
1.1 细胞
人绒毛膜滋养层HTR-8/Svneo细胞购自武汉普诺赛生命科技有限公司,批号:20210615;HTR-8/Svneo维持在RPMI1640培养基(含10%胎牛血清、1%青-链霉素)中,于37 ℃、5% CO2的环境中培养。
1.2 药品与主要试剂
芹菜素(纯度>98%,批号:201109,成都瑞芬思生物科技有限公司);阿卡地新(acadesine, AICAR)(AMPK激活剂,批号:20210724)、MTT试剂盒(批号:20210805)、RIPA裂解液(批号:20210622)均购自上海碧云天生物技术有限公司;胎牛血清(批号:210316)、RPMI1640培养基(批号:210409)、胰蛋白酶(批号:210420)均购自美国Gibco公司;兔源一抗微管相关蛋白1轻链3(microtubule-associated protein 1 light chain 3, LC3)Ⅱ/Ⅰ(批号:20210812)、E-钙黏蛋白(E-cadherin)(批号:20210524)、N-钙黏蛋白(N-cadherin)(批号:20210608)、AMPK(批号:20210519)、p-AMPK(批号:20210420)、mTOR(批号:20210615)、p-mTOR(批号:20210617)、Beclin-1(批号:20210506)抗体均购自英国Abcam公司。
1.3 主要仪器
超薄切片机(型号:Leica EM UC7,德国Leica公司);多功能酶标仪(型号:iMark680,美国Bio-Rad公司);倒置荧光显微镜(型号:IX73,日本Olympus公司);透射电子显微镜(型号:JEM-1230,日本Jeol公司)。
2 方法
2.1 PE细胞模型建立及芹菜素的细胞毒性实验
采用缺氧复氧1 h(hypoxic-reoxygenation 1 h, H1R1)诱导建立PE细胞模型[14]。取HTR-8/Svneo细胞(1×105个/mL),接种于96孔板(200 μL/孔),培养24 h,待细胞达到70%~80%融合时,换用含芹菜素终浓度为0、5、10、20、40、80 μmol/L的培养基处理24 h。然后,将细胞置于低氧环境(1%O2、5%CO2、94%N2)中培养1 h,再进行常氧(21%O2)处理。H1R1后,向每个孔中加入40 μL MTT溶液(5 mg/mL),继续孵育2 h。使用酶标仪检测570 nm波长下各孔吸光度(A)值,与未经芹菜素处理的对照细胞相比,计算芹菜素处理组的细胞活力。细胞活力=(芹菜素处理组A值-空白孔A值)/(未经芹菜素处理组A值-空白孔A值)×100%。
2.2 细胞分组与处理
取HTR-8/Svneo细胞,分为对照组(常氧21%O2培养,不作处理)、H1R1组(1%O2/21%O2培养)、AICAR组(给予AMPK激活剂AICAR 1 mmol/L处理)、芹菜素低剂量组(10 μmol/L)、芹菜素高剂量组(20 μmol/L)、芹菜素+AICAR组(给予芹菜素20 μmol/L和AICAR 1 mmol/L处理)。此外,AICAR组、芹菜素各剂量组和芹菜素+AICAR组细胞分别给予相应剂量的药物处理24 h后,进行H1R1诱导建立PE细胞模型。
2.3 MTT法检测细胞活力
HTR-8/Svneo细胞以2×104个/孔的密度接种于96孔板中,每孔200 μL(细胞密度为1×105个/mL),按照“2.2”项分组进行处理后,在24、48、72 h分别向每孔加入40 μL MTT溶液(5 mg/mL),孵育2 h。檢测各组细胞在570 nm处的A值(A570 nm值),评估细胞活力。
2.4 透射电子显微镜观察细胞自噬
将各组细胞用2.5%戊二醛-1%饿酸固定,PBS洗后,梯度乙醇和丙酮进行脱水,然后包埋在纯812包埋剂中,在60 ℃烘箱中聚合48 h;使用超薄切片机将样品切成60~80 nm的超薄切片。切片用3%醋酸铀-枸橼酸铅双染色,在透射电子显微镜下观察细胞自噬。
2.5 划痕实验检测细胞迁移能力
取对数生长期的HTR-8/Svneo细胞,以1×105个/mL的密度接种在60 mm培养皿中,并使其生长24 h。用无菌蓝色移液管的尖端刮擦划一道划痕。随后,按照“2.2”项进行分组与处理,并将细胞再培养24 h。在0 h和24 h时在同一位置用倒置显微镜拍照,计算划痕愈合率。划痕愈合率=(1-24 h划痕宽度/0 h划痕宽度)×100%。
2.6 Transwell实验检测细胞侵袭能力
取HTR-8/Svneo细胞按照“2.2”项进行分组和处理后,重悬在无血清培养液中(2×104个/mL)。取200 μL细胞悬液加入上室(预先包被Matrigel),600 μL培养基(含10%胎牛血清)加入下室。培养48 h后,将穿膜细胞固定在4%多聚甲醛中30 min,在结晶紫染液中染色20 min后,在倒置显微镜下对侵袭细胞进行计数。
2.7 Western blot法检测细胞AMPK/mTOR通路和自噬、侵袭相关蛋白的表达
RIPA裂解液提取经芹菜素和H1R1处理后的HTR-8/Svneo细胞总蛋白。测量蛋白浓度后,十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离等量蛋白样品(30 μg),并转至聚偏二氟乙烯膜上。将膜封闭在5%脱脂牛奶中1 h,将膜在4 ℃下与在封闭溶液中稀释的一抗(AMPK、p-AMPK、mTOR、p-mTOR、Beclin-1、LC3Ⅱ/Ⅰ、E-cadherin、N-cadherin、β-actin,1∶1 000)孵育过夜。将膜在室温下用二抗(1∶4 000)孵育1 h后,显影,检测条带灰度值,计算目的蛋白表达量。
2.8 统计学分析
采用SPSS 22.0软件进行统计分析,计量资料用“x±s”表示,数据分布的正态性和方差齐性分别通过Kolmogorov-Smirnov检验和Levene检验进行分析,多组间比较符合正态分布且方差齐时采用单因素方差分析,组间两两比较采用LSD-t检验;方差不齐时,选择Dunnett-t3检验;不服从正态分布者,采用秩和检验。P<0.05表示差异有统计学意义。
3 结果
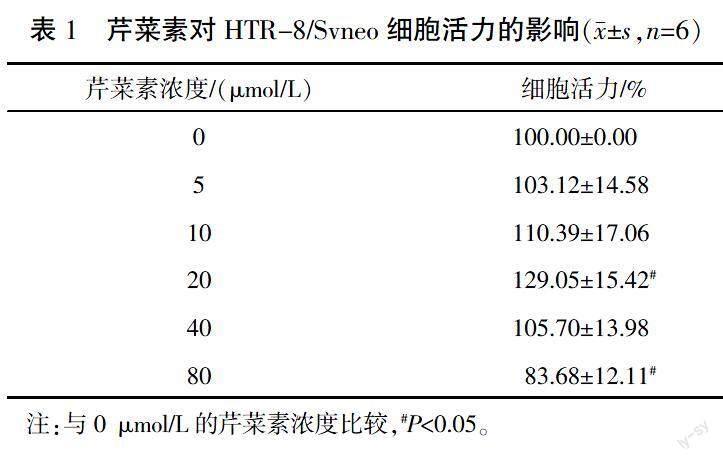
3.1 不同浓度的芹菜素对H1R1诱导的HTR-8/Svneo细胞毒性的影响
与0 μmol/L的芹菜素浓度比较,5、10、20、40 μmol/L的芹菜素对HTR-8/Svneo细胞无明显毒性作用。10 μmol/L芹菜素对HTR-8/Svneo细胞增殖有促进作用(P>0.05),20 μmol/L时促进作用更明显,差异有统计学意义(P<0.05),当剂量达到80 μmol/L时有抑制HTR-8/Svneo细胞增殖的趋势(P<0.05)。详见表1。故选择10、20 μmol/L芹菜素用于后续实验。3.2 芹菜素对H1R1诱导的HTR-8/Svneo细胞活力的影响
与对照组比较,H1R1组细胞在24、48、72 h时细胞活力显著降低(P<0.05);与H1R1组比较,AICAR组细胞活力显著降低(P<0.05),芹菜素低、高剂量组细胞活力显著升高(P<0.05);与AICAR组比较,芹菜素+AICAR组细胞活力显著升高(P<0.05);与芹菜素高剂量组比较,芹菜素+AICAR组细胞活力显著降低(P<0.05)。详见表2。
3.3 芹菜素对H1R1诱导的HTR-8/Svneo细胞自噬的影响
与对照组比较,H1R1组细胞中自噬小体数量增多(P<0.05);与H1R1组比较,AICAR组细胞中自噬小体数量增多(P<0.05),芹菜素低、高剂量组细胞中自噬小体数量减少(P<0.05);与AICAR组比较,芹菜素+AICAR组细胞中自噬小体数量减少(P<0.05);与芹菜素高剂量组比较,芹菜素+AICAR组细胞中自噬小体数量增多(P<0.05)。详见表3、图1。
3.4 芹菜素对H1R1诱导的HTR-8/Svneo细胞迁移、侵袭能力的影响
与对照组比较,H1R1组细胞划痕愈合率和穿膜细胞数显著降低(P<0.05);与H1R1组比较,AICAR组细胞划痕愈合率和穿膜细胞数显著降低(P<0.05),芹菜素低、高剂量组细胞划痕愈合率和穿膜细胞数显著升高(P<0.05);与AICAR组比较,芹菜素+AICAR组细胞划痕愈合率和穿膜细胞数显著升高(P<0.05);与芹菜素高剂量组比较,芹菜素+AICAR组细胞划痕愈合率和穿膜细胞数显著降低(P<0.05)。详见表4、图2。
3.5 芹菜素对H1R1诱导的HTR-8/Svneo细胞中自噬、侵袭相关蛋白表达的影响
与对照组比较,H1R1组细胞中LC3Ⅱ/LC3Ⅰ比值、Beclin-1和E-cadherin表达显著升高(P<0.05),N-cadherin表达显著降低(P<0.05);与H1R1组比较,AICAR组细胞中LC3Ⅱ/LC3Ⅰ比值、Beclin-1和E-cadherin表达显著升高(P<0.05),N-cadherin表达显著降低(P<0.05),芹菜素低、高剂量组细胞中LC3Ⅱ/LC3Ⅰ比值、Beclin-1和E-cadherin表达显著降低(P<0.05),N-cadherin表达显著升高(P<0.05);与AICAR组比较,芹菜素+AICAR组细胞中LC3Ⅱ/LC3Ⅰ比值、Beclin-1和E-cadherin表达显著降低(P<0.05),N-cadherin表达显著升高(P<0.05);与芹菜素高剂量组比较,芹菜素+AICAR组细胞中LC3Ⅱ/LC3Ⅰ比值、Beclin-1和E-cadherin表达显著升高(P<0.05),N-cadherin表达显著降低(P<0.05)。详见图3、表5。
3.6 芹菜素对H1R1诱导的HTR-8/Svneo细胞中AMPK/mTOR通路的影响
与对照组比较,H1R1组细胞中p-AMPK/AMPK比值升高、p-mTOR/mTOR比值降低(P<0.05);与H1R1组比较,AICAR組细胞中p-AMPK/AMPK比值升高、p-mTOR/mTOR比值降低(P<0.05),芹菜素低、高剂量组p-AMPK/AMPK比值降低、p-mTOR/mTOR比值升高(P<0.05);与AICAR组比较,芹菜素+AICAR组p-AMPK/AMPK比值降低、p-mTOR/mTOR比值升高(P<0.05);与芹菜素高剂量组比较,芹菜素+AICAR组细胞中p-AMPK/AMPK比值升高、p-mTOR/mTOR比值降低(P<0.05)。详见图4、表6。
4 讨论
在正常妊娠中,胎盘的滋养细胞侵入子宫壁并用低阻力的血管系统取代高阻力的子宫螺旋动脉和小动脉,而这种重塑在PE中是有缺陷的(可能继发于胎儿-母体间期免疫反应的改变),可能导致胎盘缺血[15]。PE长期以来一直被认为是胎盘的缺血性疾病,缺氧可引起细胞侵袭力减弱,并影响滋养细胞向侵袭性表型分化[16];此外,H1R1可诱导滋养细胞AMPK激活,可有效诱导HTR8/SVneo滋养细胞PE前期研究模型[14],因此,本研究通过H1R1诱导建立PE滋养细胞模型。结果显示,与常氧处理细胞相比,H1R1可降低滋养细胞的迁移、侵袭能力,并上调p-AMPK/AMPK比值,激活AMPK。
芹菜素是在芹菜、欧芹、洋葱、茶和葡萄柚等蔬菜和水果中发现的天然黄酮类化合物之一。黄酮类化合物可以作为抗氧化剂,保护生物分子免受氧化损伤。据报道,芹菜素可改善妊娠糖尿病和妊娠高血压,并降低胰岛素抵抗[3,5]。而氧化应激会导致胎盘功能异常,糖尿病是PE的高危因素,胰岛素抵抗为其病因之一,这提示芹菜素可能对PE具有保护作用。本研究首次探究了不同浓度的芹菜素对滋养细胞HTR-8/Svneo的影响,结果显示,5、10、20、40 μmol/L的芹菜素对HTR-8/Svneo细胞无明显毒性作用,并且10、20 μmol/L芹菜素对HTR-8/Svneo细胞有促增殖作用,而当剂量达到80 μmol/L时有抑制HTR-8/Svneo细胞增殖的趋势,表明高浓度的芹菜素对HTR-8/Svneo细胞有明显毒性,因此,选择低浓度芹菜素(10、20 μmol/L)进一步研究其对HTR-8/Svneo细胞迁移与侵袭的影响,后续将在此试验剂量范围内设置多个浓度来进一步评估剂量依赖性。在妊娠期,滋养细胞通过上皮-间充质转化获得迁移、侵袭能力,进而侵入子宫内膜以重塑螺旋动脉,胎盘功能障碍与滋养细胞的迁移和侵袭不足密切相关[17]。本研究结果显示,10、20 μmol/L芹菜素可显著增加经H1R1处理后的HTR-8/Svneo细胞的迁移与侵袭能力;Western blot结果也证实,芹菜素可降低E-cadherin表达,升高N-cadherin表达。这表明芹菜素可增强H1R1处理后的HTR-8/Svneo细胞的迁移和侵袭能力,在PE中具有重要作用,然而,其调控HTR-8/Svneo细胞迁移和侵袭的机制尚不明确。
自噬在胚胎发生、植入和妊娠维持中起着重要作用,NAKASHIMA等[18-19]研究显示,自噬机制在PE中受损,自噬抑制与胎盘不良有关,是PE胎盘的一个重要特征。然而,过度自噬也被认为是PE发病过程中胎盘的一个重要特征[2,20]。当mTOR的磷酸化被阻止时,滋养细胞自噬过度激活,妊娠早期滋养细胞侵袭能力降低[21];通过mTOR途径调节自噬可进一步影响滋养细胞的侵袭和黏附[22]。以上研究表明,mTOR介导的细胞自噬可影响滋养细胞的侵袭。AMPK是mTOR的上游调控因子,也是调节细胞自噬的关键蛋白[12]。AMPK协调细胞生长、分化和营养运输以维持细胞存活,在多种缺血性疾病中发挥重要作用[23]。AMPK的适当调节对于正常胎盘和胚胎发育至关重要,其失调可能导致妊娠相关疾病,如宫内生长受限、胎盘功能不全或PE。据报道,胎盘滋养层细胞中AMPK敲低会导致细胞形态和功能改变[24],AMPK激活可诱导滋养细胞分化,改善受异常胎盘影响的人胎盘中滋养细胞的功能[25]。但是,AMPK的过度激活会降低PE中滋养细胞的侵袭性[11]。TSAI等[8]研究指出,在PE期间,胎盘中p-mTOR表达降低,p-AMPK表达增加;KOROGLU等[10]也发现,严重PE患者的AMPK表达水平显著高于健康孕妇和无严重特征的PE患者。本研究结果显示,H1R1后HTR-8/Svneo细胞中p-AMPK/AMPK比值升高,p-mTOR/mTOR比值降低,并且采用AMPK激活剂AICAR上调p-AMPK/AMPK后,p-mTOR/mTOR比值进一步降低,HTR-8/Svneo细胞的自噬增加,侵袭能力减弱,这与TSAI等[8]的研究结果一致,与NAKASHIMA等[18-19]研究结果不一致,推测其原因可能与自噬的双重作用有关。由此猜想:在PE患者胎盘中,过度激活的AMPK可能通过抑制mTOR活化,诱导滋养细胞过度自噬。而经芹菜素处理后,HTR-8/Svneo细胞中AMPK的激活被抑制,mTOR活化增加,细胞自噬减少,迁移与侵袭能力增强;并且使用AICAR可明显减弱芹菜素对AMPK激活和自噬的抑制作用,并削弱芹菜素对HTR-8/Svneo细胞迁移和侵袭的促进作用。上述结果提示芹菜素可能通过抑制AMPK的激活,促进mTOR活化,进而抑制滋养细胞过度自噬,增强其侵袭能力。AICAR为AMPK/mTOR通路的激活剂,可进一步增强自噬,降低滋养细胞的迁移、侵袭能力,芹菜素与AICAR联合使用后,AICAR对AMPK/mTOR通路的激活作用减弱了芹菜素对胎盘滋养细胞过度自噬的抑制作用,表明芹菜素可能通过抑制AMPK/mTOR通路发挥作用。
芹菜素可增强滋养细胞的侵袭能力,改善PE,其作用机制可能与抑制AMPK/mTOR通路介导的胎盘滋养细胞过度自噬有关。本研究结果尚需体内动物模型进一步证实。
参考文献
[1] RANA S, LEMOINE E, GRANGER J P, et al. Preeclampsia: Pathophysiology, challenges, and perspectives[J]. Circulation Research, 2019, 124(7): 1094-1112.
[2] GU S Y, ZHOU C C, PEI J D, et al. Esomeprazole inhibits hypoxia/endothelial dysfunction-induced autophagy in preeclampsia[J]. Cell and Tissue Research, 2022, 388(1): 181-194.
[3] 赵 岗, 杨 丽, 樊秀梅. 芹菜素通过PI3K/Akt通路对妊娠期糖尿病大鼠胰岛素抵抗的作用[J]. 药物评价研究, 2020, 43(3): 417-422.
[4] 陳雪宁, 黄 河, 蔡志善, 等. 芹菜素对妊娠期糖尿病大鼠内质网应激CHOP信号通路的影响[J]. 中国比较医学杂志, 2021, 31(2): 45-50.
[5] BOGACZ A, MIKO?覵AJCZAK P , WOLEK M, et al. Combined effects of methyldopa and flavonoids on the expression of selected factors related to inflammatory processes and vascular diseases in human placenta cells-an in vitro study[J]. Molecules, 2021, 26(5): 1259-1277.
[6] MENG Z Q, GAO M, WANG C Y, et al. Apigenin alleviated high-fat-diet-induced hepatic pyroptosis by mitophagy-ROS-CTSB-NLRP3 pathway in mice and AML12 cells[J]. Journal of Agricultural and Food Chemistry, 2023, 71(18): 7032-7045.
[7] ZHANG Y Z, YANG Y, YU H T, et al. Apigenin protects mouse retina against oxidative damage by regulating the Nrf2 pathway and autophagy[J]. Oxidative Medicine and Cellular Longevity, 2020, 2020: 9420704.
[8] TSAI K, TULLIS B, JENSEN T, et al. Differential expression of mTOR related molecules in the placenta from gestational diabetes mellitus (GDM), intrauterine growth restriction (IUGR) and preeclampsia patients[J]. Reproductive Biology, 2021, 21(2): 100503-100511.
[9] LAI W S, DING Y L. GNG7 silencing promotes the proliferation and differentiation of placental cytotrophoblasts in preeclampsia rats through activation of the mTOR signaling pathway[J]. International Journal of Molecular Medicine, 2019, 43(5): 1939-1950.
[10] KOROGLU N, TOLA E, TEMEL YUKSEL I, et al. Maternal serum AMP-activated protein kinase levels in mild and severe preeclampsia[J]. The Journal of Maternal-Fetal & Neonatal Medicine, 2019, 32(16): 2735-2740.
[11] YANG X T, XU P, ZHANG F M, et al. AMPK hyper-activation alters fatty acids metabolism and impairs invasiveness of trophoblasts in preeclampsia[J]. Cellular Physiology and Biochemistry, 2018, 49(2): 578-594.
[12] HAN D D, JIANG L L, GU X L, et al. SIRT3 deficiency is resistant to autophagy-dependent ferroptosis by inhibiting the AMPK/mTOR pathway and promoting GPX4 levels[J]. Journal of Cellular Physiology, 2020, 235(11): 8839-8851.
[13] 薛平平, 樊文强, 王慧艳, 等. 滋养细胞自噬在子痫前期胎盘中的形成及调控机制[J]. 中华围产医学杂志, 2017, 20(10): 712-717.
[14] 杨晓涛, 韩顶立, PHILIP N B, 等. 体外缺氧诱导子痫前期滋养细胞模型优化及代谢组学鉴定[J]. 重庆医科大学学报, 2017, 42(8): 1045-1052.
[15] ZHOU W B, WANG H Y, YANG Y Q, et al. Trophoblast cell subtypes and dysfunction in the placenta of individuals with preeclampsia revealed by single-cell RNA sequencing[J]. Mole cules and Cells, 2022, 45(5): 317-328.
[16] 杨 娟, 谢莹莺. miR-182调控HIF-2α通路对低氧诱导子痫前期滋养细胞侵袭的影响[J]. 安徽医科大学学报, 2020, 55(6): 62-67.
[17] 方 婕, 何 洁, 吴侠霏, 等. 基于生物信息学筛选的CEBPA在子痫前期胎盘组织的表达及对滋养细胞上皮间质转化的影响[J]. 实用妇产科杂志, 2022, 38(5): 358-363.
[18] NAKASHIMA A, CHENG S B, IKAWA M, et al. Evidence for lysosomal biogenesis proteome defect and impaired autophagy in preeclampsia[J]. Autophagy, 2020, 16(10): 1771-1785.
[19] NAKASHIMA A, TSUDA S, KUSABIRAKI T, et al. Current understanding of autophagy in pregnancy[J]. International Journal of Molecular Sciences, 2019, 20(9): 2342-2354.
[20] 殷 荷, 王艳华, 吴琪瑞, 等. MiR-5088-5p在子痫前期患者胎盘组织中的表达及其对滋养细胞自噬的影响[J]. 实用医学杂志, 2020, 36(24): 3312-3316.
[21] KNUTH A, LIU L, NIELSEN H, et al. Placenta growth factor induces invasion and activates p70 during rapamycin treatment in trophoblast cells[J]. American Journal of Reproductive Immunology, 2015, 73(4): 330-340.
[22] YANG D Y, DING J L, WANG Y Q, et al. YY1-PVT1 affects trophoblast invasion and adhesion by regulating mTOR pathway-mediated autophagy[J]. Journal of Cellular Physiology, 2020, 235(10): 6637-6646.
[23] 肖颖馥, 王 能, 盛 文, 等. 莓茶提取物对2型糖尿病大鼠糖脂代谢及肝脏SIRT1、AMPK、PGC-1α蛋白表达的影响[J]. 湖南中医药大学学报, 2023, 43(5): 807-813.
[24] CAREY E A, ALBERS R E, DOLIBOA S R, et al. AMPK knockdown in placental trophoblast cells results in altered morphology and function[J]. Stem Cells and Development, 2014, 23(23): 2921-2930.
[25] DREWLO S, JOHNSON E, KILBURN B A, et al. Irisin induces trophoblast differentiation via AMPK activation in the human placenta[J]. Journal of Cellular Physiology, 2020, 235(10): 7146-7158.
(本文編辑 周 旦)
