连翘酯苷A对IL-1β诱导的软骨细胞损伤的影响
2023-09-07詹和道,姚江凌,崔红旺
詹和道,姚江凌,崔红旺
〔摘要〕 目的 探討连翘酯苷A对白细胞介素-1β(interleukin-1β, IL-1β)诱导的软骨细胞损伤的影响及其可能的作用机制。方法 采用50 mg/L IL-1β诱导人关节软骨细胞建立细胞损伤模型,记为模型组;另取未处理细胞为对照组。采用1.25、2.5、5.0 μmol/L不同浓度的连翘酯苷A处理软骨细胞,依次记为连翘酯苷A低、中、高剂量组。ELISA法检测炎症因子[IL-1β、白细胞介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)]水平;采用流式细胞术检测细胞凋亡率,qRT-PCR检测circSERPINE2表达量。pcDNA、pcDNA-circSERPINE2转染至软骨细胞后用IL-1β处理,si-NC、si-circSERPINE2分别转染至软骨细胞后用连翘酯苷A与IL-1β共同处理24 h,采用ELISA法检测IL-1β、IL-6、TNF-α的水平;流式细胞术检测细胞凋亡率;Western blot法检测Bax、Bcl-2蛋白表达量。结果 连翘酯苷A作用于IL-1β诱导的软骨细胞后,炎症因子(IL-1β、IL-6、TNF-α)水平、细胞凋亡率、Bax蛋白水平降低(P<0.05),Bcl-2蛋白、circSERPINE2表达水平升高(P<0.05);转染pcDNA-circSERPINE2后炎症因子(IL-1β、IL-6、TNF-α)表达水平及细胞凋亡率、Bax蛋白水平降低(P<0.05),Bcl-2蛋白水平升高(P<0.05);转染si-circSERPINE2后,炎症因子(IL-1β、IL-6、TNF-α)水平、细胞凋亡率、Bax蛋白水平升高(P<0.05),Bcl-2蛋白水平降低(P<0.05)。结论 连翘酯苷A可通过上调circSERPINE2表达而抑制细胞炎症因子表达及细胞凋亡,从而减轻IL-1β诱导的关节软骨细胞损伤。
〔关键词〕 连翘酯苷A;circSERPINE2;白细胞介素-1β;人关节软骨细胞;炎症;细胞凋亡;Bax蛋白;Bcl-2蛋白
〔中图分类号〕R285.5 〔文献标志码〕A 〔文章编号〕doi:10.3969/j.issn.1674-070X.2023.08.009
Effects of forsythoside A on IL-1β-induced chondrocyte injury
ZHAN Hedao, YAO Jiangling, CUI Hongwang*
The First Hospital of Hainan Medical College, Haikou, Hainan 570102, China
〔Abstract〕 Objective To investigate the effects of forsythoside A on IL-1β-induced chondrocyte injury and its possible mechanism of action. Methods Cell injury models of Human articular chondrocytes were established using 50 mg/L interleukin-1β (IL-1β), which were denoted as model group. The untreated chondrocytes were taken as control group. Chondrocytes treated with 1.25, 2.5 and 5.0 μmol/L forsythoside A were recorded as low-, medium- and high-dose forsythoside A groups, respectively. The levels of inflammatory factors [IL-1β, interleukin-6 (IL-6), and tumor necrosis factor-α (TNF-α)] were measured by ELISA; the apoptosis rate was determined by flow cytometry; the expression of circSERPINE2 was measured by qRT-PCR. The pcDNA and pcDNA-circSERPINE2 were separately transfected into chondrocytes which were treated with IL-1β for 24 h afterwards; the si-NC and si-circSERPINE2 were separately transfected into chondrocytes which were co-treated with forsythoside A and IL-1β for 24 h afterwards. Then, the levels of IL-1β, IL-6, and TNF-α were determined by ELISA; the apoptosis rate was measured by flow cytometry; the protein expression levels of Bax and Bcl-2 were determined by Western blot. Results After forsythoside A acting on IL-1β-induced chondrocytes, the levels of inflammatory factors (IL-1β, IL-6, and TNF-α), apoptosis rate, and Bax protein level decreased (P<0.05), while the expression levels of Bcl-2 protein and circSERPINE2 increased (P<0.05). After transfection of pcDNA-circSERPINE2, the levels of inflammatory factors (IL-1β, IL-6, and TNF-α), apoptosis rate and Bax protein level decreased (P<0.05), while Bcl-2 protein level increased (P<0.05). After transfection of si-circSERPINE2, the levels of inflammatory factors (IL-1β, IL-6, and TNF-α), apoptosis rate and Bax protein level increased (P<0.05), while Bcl-2 protein level decreased (P<0.05). Conclusion Forsythoside A could reduce IL-1β-induced chondrocyte injury by up-regulating circSERPINE2 expression and thus inhibiting the expressions of cellular inflammatory factors and apoptosis.
〔Keywords〕 forsythoside A; circSERPINE2; interleukin-1β; human articular chondrocytes; inflammation; apoptosis; Bax protein; Bcl-2 protein
骨关节炎是常见的一种骨关节疾病,常发生于中老年人群中,关节软骨细胞凋亡是造成细胞损伤的重要原因[1-2]。目前,尚缺乏有效治疗骨关节炎的方法。研究表明,中医药及其活性成分可通过抑制软骨细胞凋亡从而达到治疗骨关节炎的目的[3-4]。连翘属于我国传统中药,被广泛用于治疗炎症、发热等疾病。连翘酯苷A是从连翘中分离出的主要活性成分之一,具有抗炎、抗氧化等作用,可抑制由巨噬细胞活化引起的炎症及氧化性疾病[5]。然而,连翘酯苷A对骨关节炎的治疗效果及其可能的作用机制尚未可知。失调的环状RNA(circRNA)与骨关节炎的发展有关[6]。据报道,circRNA丝氨酸蛋白酶抑制剂家族E成员2(circSERPINE2)在骨关节炎中表达下调,其过表达可减弱白细胞介素-1β(interleukin-1β, IL-1β)引起的软骨细胞凋亡和细胞外基质降解,是骨关节炎治疗的新靶点[7-8]。本研究通过IL-1β诱导建立人关节软骨细胞损伤模型,探讨连翘酯苷A是否可通过调控circSERPINE2表达影响IL-1β诱导的软骨细胞损伤。
1 材料与方法
1.1 主要药物、试剂及仪器
连翘酯苷A(上海诗丹德标准技术服务有限公司,批号:20191201,纯度≥98%);人关节软骨细胞(上海中乔新舟生物科技有限公司,批号:20191006);IL-1β(美国Sigma公司,批号:20190819);DMEM培养液(上海碧云天公司,批号:20200225);胎牛血清(美国Gibco公司,批号:20200114);Trizol试剂、LipofectamineTM 3000转染试剂(美国Invitrogen公司,批号:20190907、20190903);反转录和荧光定量PCR试剂盒(美国Thermo Fisher公司,批号:20191106);pcDNA、pcDNA-circSERPINE2、si-NC、si-circSERPINE2(上海吉玛制药技术有限公司,批号:20190828、20190817、20200108、20200112);IL-1β、白细胞介素-6(interleukin-6, IL-6)、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α)检测试剂盒(美国Abcam公司,批号:20190206、20200324、20190907);细胞凋亡检测试剂盒(北京索莱宝公司,批号:20190706)。流式细胞仪(美国BD公司,型号:FACS-Calibur);高速离心机(赛默飞世尔科技公司,型号:Micro17R);PCR儀(美国ABI公司,型号:HT9700)。
1.2 方法
1.2.1 分组及处理 于6孔板(1×104个/孔)接种软骨细胞,用含50 mg/L IL-1β的DMEM培养基培养24 h[9],记为模型组,未处理细胞作为对照组。用含1.25、2.5、5.0 μmol/L连翘酯苷A[10]与50 mg/L IL-1β的DMEM培养基培养24 h,依次记为连翘酯苷A低剂量组、连翘酯苷A中剂量组、连翘酯苷A高剂量组。
1.2.2 细胞转染 于6孔板(1×104个/孔)接种软骨细胞,培养24 h,待细胞融合至80%时,参照转染试剂操作说明书分别将pcDNA、pcDNA-circSERPINE2、si-NC、si-circSERPINE2转染至软骨细胞,实验分为IL-1β+pcDNA组(转染pcDNA后,用含50 mg/L IL-1β的DMEM培养基培养24 h)、IL-1β+pcDNA-circSERPINE2组(转染pcDNA-circSERPINE2后,用含50 mg/L IL-1β的DMEM培养基培养24 h)、IL-1β+连翘酯苷A+si-NC组(转染si-NC后,用含5.0 μmol/L连翘酯苷A与50 mg/L IL-1β的DMEM培养基培养24 h)、IL-1β+连翘酯苷A+si-circSERPINE2组(转染si-circSERPINE2后,用含5.0 μmol/L连翘酯苷A与50 mg/L IL-1β的DMEM培养基培养24 h)。转染后收集各组细胞行后续实验。
1.3 观察指标
1.3.1 ELISA法检测IL-1β、IL-6、TNF-α的水平 将各组细胞培养上清液离心(350×g、10 min),取上清液,利用IL-1、IL-6、TNF-α ELISA试剂盒检测IL-1β、IL-6、TNF-α水平。严格根据试剂盒说明书进行实验,各组细胞离心后取上清液行后续检测,按照倍比稀释制作标准品。将各组细胞上清液加入96孔板,分别加入样品及标准品后洗板,加入生物素化抗体100 μL/孔,室温下孵育60 min,洗板5次后加入辣根过氧化物酶标记的链霉亲和素100 μL/孔,孵育20 min后洗板5次,加入显色剂TMB溶液100 μL/孔孵育20 min,加入终止液50 μL/孔后检测450 nm处的吸光度(A)值,通过标准品曲线计算浓度。
1.3.2 流式细胞术检测细胞凋亡 收集各组细胞并悬浮在1×结合缓冲液中,然后加入5 μL的AnnexinV-FITC溶液和10 μL PI(1 g/mL),在室温和黑暗条件下对细胞进行15 min染色。采用流式细胞仪检测细胞凋亡的比例,计算细胞凋亡率。细胞凋亡率(%)=早期细胞的凋亡比例+晚期细胞的凋亡比例。
1.3.3 Western blot法检测Bax、Bcl-2蛋白表达量
提取各组细胞中总蛋白,BCA法测定蛋白质浓度后,将总蛋白(30 μg)通过10%十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离后,转至聚偏二氟乙烯膜,用5%脱脂牛奶封闭1 h后,将膜分别与Bax(1∶1 000)、Bcl-2(1∶1 000)、GAPDH一抗(1∶2 000)在4 ℃下孵育12 h,洗膜,再与辣根过氧化物酶偶联的二抗(1∶3 000)在室温下孵育1 h。使用增强的化学发光试剂显影,曝光,Tanon600图像分析蛋白条带灰度值,以GAPDH为内参计算目的蛋白的相对表达量。
1.3.4 qRT-PCR法检测circSERPINE2的表达水平
取Trizol试剂提取各组细胞中总RNA,反转录为cDNA,随后,将该cDNA与SYBR Green和特异性引物一起在qRT-PCR仪上进行PCR扩增。反应系统(20 μL):10 μL SYBR■ Premix Ex TaqTM(2×)、0.8 μL PCR正向引物(10 μmol/L)、0.8 μL PCR反向引物(10 μmol/L)、2 μL cDNA(200 ng/μL)和6.4 μL无菌水。PCR反应条件如下:95 ℃,30 s(预变性);95 ℃,5 s(变性),55 ℃,10 s(退火),72 ℃,15 s(延伸),共计40个循环。GAPDH为circSERPINE2的内参基因,采用2-ΔΔCt法分析circSERPINE2相对GAPDH的表达水平。引物序列如下:circSERPINE2,正向5'-CGGGAAATCCTATCAAGTGC-3',反向5'-ATTGAAGTGGGAGCAGATGG-3';GAPDH,正向5'-GAAAGCCTGCCGGTGACTAA-3',反向5'-TTCCCGTTCTCAGCCTTGAC-3'。
1.4 统计学处理
采用SPSS 21.0软件进行数据分析,各检测指标均为计量资料,以“x±s”表示。多组间比较采用单因素方差分析;组间比较采用SNK检验;两组间均数比较采用t检验。以P<0.05为差异具有统计学意义。
2 结果
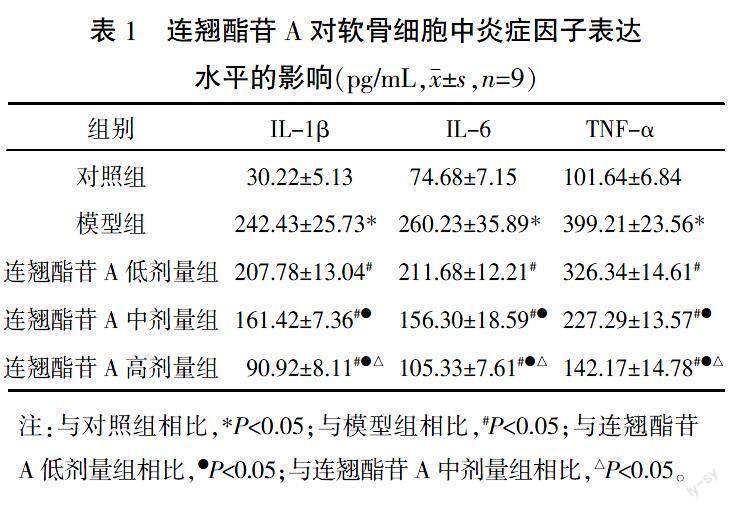
2.1 连翘酯苷A抑制IL-1β诱导的软骨细胞中炎症因子表达
与对照组比较,模型组IL-1β、IL-6、TNF-α水平升高(P<0.05);与模型组比较,连翘酯苷A低、中、高剂量组IL-1β、IL-6、TNF-α水平随剂量升高而降低(P<0.05)。详见表1。
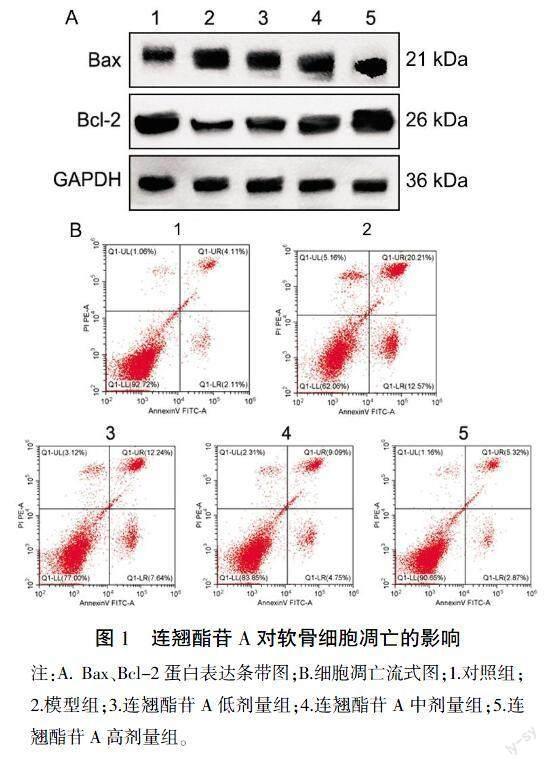
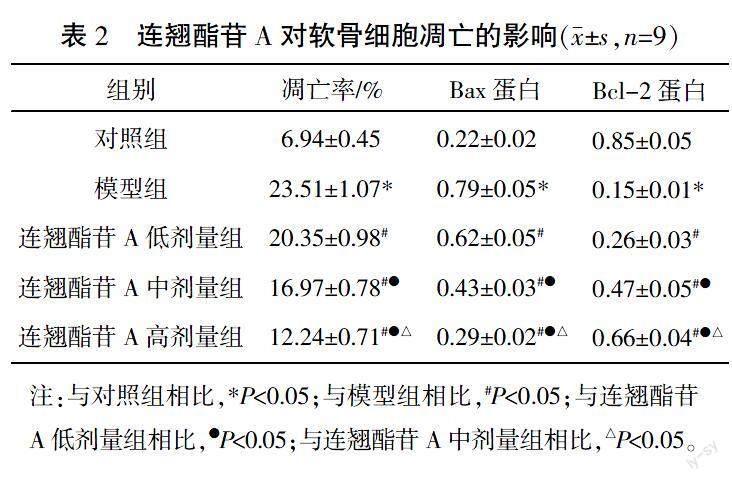
2.2 连翘酯苷A抑制IL-1β诱导的软骨细胞凋亡
与对照组比较,模型组细胞凋亡率、Bax蛋白水平升高(P<0.05),Bcl-2蛋白水平降低(P<0.05);与模型组比较,连翘酯苷A低、中、高剂量组细胞凋亡率、Bax蛋白水平随剂量升高而降低(P<0.05),Bcl-2蛋白水平随剂量升高而升高(P<0.05)。详见图1、表2。
2.3 连翘酯苷A对IL-1β诱导的软骨细胞中circSERPINE2表达的影响
与对照组比较,模型组circSERPINE2表达量降低(P<0.05);与模型组比较,连翘酯苷A低、中、高剂量组circSERPINE2的表达量升高(P<0.05)。详见表3。
2.4 转染后circSERPINE2表达比较
与pcDNA组比较,pcDNA-circSERPINE2组circSERPINE2表达量升高(P<0.05);与si-NC组比较,si-circSERPINE2组circSERPINE2表达量降低(P<0.05)。详见表4。
2.5 circSERPINE2对IL-1β诱导的软骨细胞中炎症因子表达及细胞凋亡的影响
与IL-1β+pcDNA组比较,IL-1β+pcDNA-circSERPINE2组炎症因子(IL-1β、IL-6、TNF-α)水平、细胞凋亡率、Bax蛋白水平降低(P<0.05),Bcl-2蛋白水平升高(P<0.05)。詳见图2、表5。
2.6 抑制circSERPINE2对软骨细胞中炎症因子表达及细胞凋亡的影响
与IL-1β+连翘酯苷A+si-NC组比较,IL-1β+连翘酯苷A+si-circSERPINE2组炎症因子(IL-1β、IL-6、TNF-α)水平、细胞凋亡率、Bax蛋白水平升高(P<0.05),Bcl-2蛋白水平降低(P<0.05)。详见表6、图3。
3 讨论
IL-1β属于促炎细胞因子,可诱导软骨细胞产生过度炎症反应,甚至凋亡,促进骨关节炎的发生和发展,被广泛应用于骨关节炎的病理生理学研究[11-12]。骨关节炎属中医学“痹病”范畴,与“痹病”中“鹤膝风”“骨痹”“筋痹”相类似。膝关节骨性关节炎的发病与肝、脾、肾亏虚,风、寒、湿及瘀血客于局部有关,最终都导致局部血瘀气滞、经络痹阻不通而发病。研究表明,中医药及其活性成分具有抗骨关节炎作用[13]。circRNA可充当miRNA的海绵分子调节软骨细胞增殖及凋亡,进而参与骨关节炎发生及发展过程[14]。但circRNA是否可作为中医药治疗骨关节炎的潜在靶点尚未阐明。
连翘是一种传统中药材,由于其抗氧化、抗菌和抗病毒活性,在治疗发热、炎症和溃疡等疾病方面发挥着重要作用[15]。连翘酯苷A是从连翘中提取的主要生物活性成分,具有多种生物学特性,尤其是抗炎特性[16]。据报道,连翘酯苷A可抑制高葡萄糖诱导的足细胞氧化应激和炎症损伤[17]。在脂多糖诱导的急性肺损伤中,连翘酯苷A可通过上调miR-124表达,抑制TNF-α和IL-6的产生,在体外和体内减轻脂多糖诱导的炎症反应,进而减轻肺损伤[18]。本研究结果显示,IL-1β处理可促进软骨细胞炎症反应的发生和软骨细胞凋亡的增加,与既往研究报道结果相似[19-20]。给予连翘酯苷A干预后,随着浓度的升高,IL-1β诱导的软骨细胞上清液中IL-1β、IL-6、TNF-α的水平降低,同时细胞凋亡率和Bax蛋白水平降低,Bcl-2表达水平升高,提示连翘酯苷A可抑制IL-1β诱导的软骨细胞凋亡。
circSERPINE2源自SERPINE2基因,已被证实是骨关节炎中的保护性circRNA[6-7]。本研究检测了IL-1β处理的软骨细胞中circSERPINE2的表达,发现circSERPINE2表达水平降低,circSERPINE2过表达可抑制IL-1β诱导的软骨细胞炎症反应及细胞凋亡,表明circSERPINE2的减少可能与IL-1β诱导的软骨细胞损伤有关。给予连翘酯苷A处理后,IL-1β诱导的软骨细胞中circSERPINE2的表达量升高,提示连翘酯苷A可能通过上调circSERPINE2表达而减轻IL-1β诱导的软骨细胞损伤。为进一步验证circSERPINE2是否介导连翘酯苷A的抗骨关节炎作用,本研究在IL-1β诱导的软骨细胞中敲低circSERPINE2,进行功能回复实验。结果显示,抑制circSERPINE2表达可拮抗连翘酯苷A对IL-1β诱导的软骨细胞损伤的作用。
综上所述,连翘酯苷A对IL-1β诱导的软骨细胞炎症因子表达及细胞凋亡具有抑制作用,这可能与其上调circSERPINE2表达有关。本研究表明,连翘酯苷A具有治疗骨关节炎的潜在价值,但连翘酯苷A作用的circSERPINE2下游调控通路尚需进一步探究。
参考文献
[1] YU H, YAO S, ZHOU C C, et al. Morroniside attenuates apoptosis and pyroptosis of chondrocytes and ameliorates osteoarthritic development by inhibiting NF-κB signaling[J]. Journal of Ethnop?鄄
harmacology, 2021, 266: 113447.
[2] JIN J, LV X H, WANG B, et al. Limonin inhibits IL-1β-induced inflammation and catabolism in chondrocytes and ameliorates osteoarthritis by activating Nrf2[J]. Oxidative Medicine and Cellular Longevity, 2021, 2021: 7292512.
[3] 陈永健, 吴晶金, 钱富艳, 等. 益气养血方抗兔膝骨关节炎模型软骨退变的作用及机制研究[J]. 湖北中医药大学学报, 2017, 19(4): 5-9.
[4] LI S, XIE F Q, SHI K W, et al. Gossypol ameliorates the IL-1β-induced apoptosis and inflammation in chondrocytes by suppressing the activation of TLR4/MyD88/NF-κB pathway via downregulating CX43[J]. Tissue & Cell, 2021, 73: 101621.
[5] 唐赫鹏, 车 楠, 刘函晔, 等. 连翘酯苷A通过抑制PI3K/Akt通路并激活Nrf2/HO-1通路抑制LPS诱导的炎症及氧化应激[J]. 免疫学杂志, 2021, 37(5): 390-396.
[6] 乔凌晖, 袁 涛, 韩 杰, 等. 原发性膝骨关节炎患者滑膜组织中与炎症相关circRNA的筛选和生物学功能分析[J]. 中国组织工程研究, 2022, 26(23): 3683-3690.
[7] SHEN S Y, WU Y Z, CHEN J X, et al. CircSERPINE2 protects against osteoarthritis by targeting miR-1271 and ETS-related gene[J]. Annals of the Rheumatic Diseases, 2019, 78(6): 826-836.
[8] ZHANG Q P, QIAO X M, XIA W W. CircSERPINE2 weakens IL-1β-caused apoptosis and extracellular matrix degradation of chondrocytes by regulating miR-495/TGFBR2 axis[J]. Bioscience Reports, 2020, 40(11): BSR20201601.
[9] 胡 蔚, 毛 強. 刺五加苷B对IL-1β诱导的骨关节炎软骨细胞凋亡的影响[J]. 中国现代应用药学, 2020, 37(21): 2570-2575.
[10] 马忠英, 张 迪, 孙 金, 等. 连翘酯苷A通过TLR4/NF-κB抑制PC12细胞低氧/再复氧诱导的炎症反应[J]. 安徽医科大学学报, 2021, 56(5): 730-734.
[11] JIANG J Q, CAI M S. Cardamonin inhibited IL-1β induced injury by inhibition of NLRP3 inflammasome via activating Nrf2/NQO-1 signaling pathway in chondrocyte[J]. Journal of Microbiology and Biotechnology, 2021, 31(6): 794-802.
[12] 陈浩凡, 马燕妮, 陈健文, 等. 红花黄色素上调miR-140-5p影响IL-1β诱导的骨关节炎软骨细胞自噬、凋亡及炎性因子分泌的机制研究[J]. 中国临床药理学杂志, 2021, 37(24): 3350-3353.
[13] MO Z S, XU P Q, LI H Y. Stigmasterol alleviates interleukin-1beta-induced chondrocyte injury by down-regulatingsterol regulatory element binding transcription factor 2 to regulateferroptosis[J]. Bioengineered, 2021, 12(2): 9332-9340.
[14] CHEN C J, YIN P, HU S X, et al. Circular RNA-9119 protects IL-1β-treated chondrocytes from apoptosis in an osteoarthritis cell model by intercepting the microRNA-26a/PTEN axis[J]. Life Sciences, 2020, 256: 117924.
[15] 郭健敏, 富 力, 秦麗莉, 等. 连翘苷体内外抗病毒及解热作用机制[J]. 中国药理学通报, 2022, 38(8): 1170-1175.
[16] 王 蓉, 赵戈蕾, 韩 亮. 连翘酯苷A对脂多糖介导的急性肺损伤小鼠肺组织的保护作用研究[J]. 中医药导报, 2020, 26(16): 10-13.
[17] QUAN X H, LIU H H, YE D M, et al. Forsythoside A alleviates high glucose-induced oxidative stress and inflammation in podocytes by inactivating MAPK signaling via MMP12 inhibition[J]. Diabetes, Metabolic Syndrome and Obesity, 2021, 14: 1885-1895.
[18] LU Z B, YANG H Y, CAO H H, et al. Forsythoside A protects against lipopolysaccharide-induced acute lung injury through up-regulating microRNA-124[J]. Clinical Science, 2020, 134(19): 2549-2563.
[19] ZHANG Y W, ZHENG H H, LI B T. Circ_0110251 overexpression alleviates IL-1β-induced chondrocyte apoptosis and extracellular matrix degradation by regulating miR-3189-3p/SPRY1 axis in osteoarthritis[J]. Autoimmunity, 2022, 55(3): 168-178.
[20] ANSARI M Y, NOVAK K, HAQQI T M. ERK1/2-mediated activation of DRP1 regulates mitochondrial dynamics and apoptosis in chondrocytes[J]. Osteoarthritis and Cartilage, 2022, 30(2): 315-328.
(本文编辑 周 旦)
