黄芪多糖辐照预处理提取工艺及活性研究
2023-09-07倪茂君张晓彬王静霞彭朝荣
倪茂君 张晓彬 王静霞 彭朝荣,* 黄 敏 先 丽
(1四川省原子能研究院,四川 成都 610199;2辐照保藏四川省重点实验室,四川 成都 610199)
黄芪是我国传统药食两用中药材之一,有“十药九 芪”之称,应用广 泛[1-2]。黄芪多糖(Astragalus polysaccharides,APS)是黄芪中重要的天然有效成分之一,具有增强免疫力[3]、抗过氧化[4]、抗感染[5]、抗肿瘤[6]、预防衰老[2]及双向调节血糖[7]等作用,已成为医疗、食品、养殖等方面的研究热点[8-10]。在现有黄芪多糖提取方法中[11-12]:热水浸提法提取效率低,且需要高温长时间提取,经济效益低,但适用于工业化大规模提取;微生物发酵则需要解决如何选育优良菌种的问题;酸、碱提取中,滤液不易过滤和浓缩,大量酸碱使用及废水在一定程度上限制了其在实际生产中的应用;超声、微波辅助提取对工艺设备要求高,不适合大规模生产应用;酶辅助提取高效,但对环境要求高。可见,每种提取方法各有优劣,如何扬长避短,实现低温、高效提取是黄芪多糖提取的研究重点。
黄芪根结构中的纤维束和木质部等是影响多糖提取的主要结构因素。已有研究表明,高能射线可以诱发纤维素的降解,从而使纤维素聚合度下降,结构松散,活性和可及度提高[13-14]。对木聚糖的辐照降解机理研究表明,辐照处理可以破坏木聚糖分子间和分子内氢键,同时降解糖苷键[15]。此外,当降解作用于植物多糖时,能够降低多糖分子量、特性黏度值等,提高多糖活性[16-17]。与其他降解方法相比,辐照技术具有常温常压操作、处理效率高等优势,辐照结合常规热水提法是实现植物多糖工业化高效提取和生物活性提升的潜在有效方法。Quynh[18]通过γ 辐照预处理提取干蛹虫草子实体粗多糖、Akram 等[19]通过γ 辐照改进香菇水溶性多糖提取、龚志华[20]通过辐照预处理提取茯苓多糖,均发现多糖提取率随辐照剂量增大而增大,多糖抗氧化活性提高,辐照预处理对多糖结构影响不显著。上述研究结果表明,通过辐照预处理促进植物多糖的提取和活性提升的方法具有较高的可行性。
本试验以黄芪多糖提取率和抗氧化活性为考察指标,通过单因素试验和正交试验设计优选黄芪多糖辐照预处理提取工艺,比较优选辐照预处理提取工艺与常规热水提取黄芪多糖的提取率、结构、分子量与抗氧化活性的差异性,以期为黄芪多糖的工业化高效提取和利用提供新方法和理论依据。
1 材料与方法
1.1 材料与试剂
黄芪:膜荚黄芪,产地甘肃省,北京同仁堂健康药业(福州)有限公司;无水乙醇、无水甲醇、硫酸、冰醋酸,分析纯,成都市科龙化工试剂厂;1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH),分析纯,美国Sigma公司;超纯水(18.25 MΩ·cm),实验室自制;5%苯酚水溶液,北京博奥森生物技术有限公司。
1.2 仪器与设备
Nicolet IS10红外光谱仪、Evolution 220紫外分光光度计,美国Thermo Fisher Scientific 公司;Inspect F50 场发射扫描电子显微镜(SEM),美国FEI 公司;凝胶渗透色谱仪:Waters 515 液相色谱仪,Waters 2410 示差检测器,Waters Ultrahyrdogel Linear 凝胶色谱柱(300 mm×7.8 mm),Waters凝胶色谱专用软件,美国Waters公司。
1.3 试验方法
1.3.1 黄芪样品处理 参照唐雨薇等[21]的方法处理黄芪样品。取黄芪片粉碎后过20目筛,加入5倍量(v/w)的95%乙醇回流提取2 次,每次2 h,过滤脱去色素及小分子物质,滤渣于50 ℃干燥备用。
1.3.2 辐照预处理方法 将干燥后的黄芪粉用真空包装袋密封包装,采用γ 射线进行辐照预处理。辐照源:四川省原子能研究院(8×105Ci)60Co 源,动态辐照;吸收剂量采用硫酸亚铁化学剂量计标定。每个样品设3个平行样,平均偏差不大于±2.0。
1.3.3 黄芪多糖的提取 参照Yu 等[22]的方法,精确称取10 g 处理黄芪样品加入250 mL 平底烧瓶,预先加入20 mL 超纯水充分溶胀,再分别按1∶10(g∶mL)和1∶8(g∶mL)加入超纯水回流提取2次,每次2 h;合并滤液,旋转蒸发使滤液浓缩至20 mL,缓慢加入95%乙醇调醇浓度为80%,收集并冷冻干燥沉淀多糖。将沉淀多糖复溶,加入冰乙酸调节pH值为4.5,离心除去不溶性蛋白和沉淀,缓慢加入95%乙醇调醇浓度为80%,收集并干燥沉淀。重复溶解和醇沉操作1 次至无不溶性沉淀,所得产物为黄芪多糖(APS)。
1.3.4 黄芪总糖含量的测定 参照蓝永锋等[23]的方法,采用苯酚-硫酸法测定黄芪多糖的总糖含量。取经105 ℃干燥至恒重的葡萄糖10 mg,置于100 mL 容量瓶中加水溶解,并稀释至刻度,摇匀,配成0.1 mg·mL-1的葡萄糖标准溶液。准确吸取葡萄糖标准溶液0.2~1.0 mL,共5份,分别置于25 mL容量瓶中,加蒸馏水补充至2 mL,再加入5%苯酚溶液1.0 mL,摇匀,迅速加浓硫酸5.0 mL,摇匀,放置5 min,置沸水浴中加热15 min,取出,迅速水冷却至室温。另取2.0 mL蒸馏水同上操作作为空白对照,在490 nm波长处测定吸光度。以质量浓度为横坐标、吸光度值为纵坐标绘制标准曲线,进行线性回归,得回归方程y=15.610 0x-0.013 7,R2=0.998 8,结果表明葡聚糖在10~50 μg·mL-1线性关系良好。
配置1 mg·mL-1黄芪多糖样品溶液备用,取多糖样品溶液0.2 mL,置于25 mL容量瓶中,加蒸馏水补充至2 mL,按标准曲线测定方法测定黄芪多糖光密度(optical density,OD)值,并计算总糖含量。
1.3.5 黄芪多糖提取率的计算 按照公式(1)计算黄芪粗糖提取率:
式中,CR 为粗糖提取率(%);Mi为粗多糖的质量(g);M为黄芪粉末质量(g)。
按照公式(2)计算黄芪总糖提取率:
式中,TR 为总糖提取率(%);Mi为粗多糖的质量(g);Ci为总糖含量(%);M为黄芪粉末质量(g)。
1.3.6 DPPH 清除能力 参照张宇[24]的方法测定样品的抗氧化活性。配置一定浓度的黄芪多糖溶液,取2 mL 加入试管,并加入2 mL 浓度为 0.04 mg·mL-1的DPPH-甲醇溶液,以2 mL DPPH 溶液和2 mL超纯水为阴性对照样,混合均匀后避光于37 ℃反应30 min,于3 000 r·min-1离心6 min,在517 nm处检测吸光度A值。DPPH清除率按式(3)计算:
式中,IR 为DPPH 自由基清除率(%);Ac为阴性对照样的吸光度值;Ai为多糖样品溶液的吸光度值;Ai0为样品本底的吸光度值。
1.3.7 单因素试验 固定提取料液比和提取次数,分别考察不同辐照剂量(0、25、50、75、100 kGy)、提取温度(60、70、80、90、100 ℃)和提取时间(1、1.5、2、2.5、3 h)对黄芪多糖提取率和DPPH 清除率的影响。采用SPSS 26软件对试验结果进行显著性分析。
1.3.8 正交试验 在单因素考察基础上,以辐照剂量(A)、提取温度(B)、提取时间(C)为试验因素,每个因素选择3 个水平,以粗多糖提取率、总多糖提取率和DPPH 清除率为考察指标,根据权重进行综合评分,设计L9(34)正交试验,确定辐照预处理提取黄芪多糖的最佳提取工艺。对正交试验结果进行直观分析和方差分析,因素水平见表1。

表1 提取工艺正交试验因素水平表Table 1 Factors and level table of orthogonal experiment of extraction process
1.3.9 辐照黄芪粉微观结构观察 将不同辐照预处理的黄芪粉于低温真空干燥,用镊子取少量粉体均匀地撒在双面导电胶上,吹走多余粉末,再将样品粘在样品台上,喷金处理90 s,扫描电镜观察粉体表面形貌结构。
1.3.10 红外光谱检测 将辐照预处理提取黄芪多糖与未辐照对照样品在真空干燥箱中低温干燥,分别取5~10 mg样品粉末,采用KBr压片,在4 000~500 cm-1进行傅里叶变换红外光谱扫描。
1.3.11 分子量测定 采用凝胶渗透色谱(gel permeation chromatography,GPC)法[25]测定分子量。将窄分布的葡聚糖标准品(2 500~5 348 000)和待测样品配成5 mg·mL-1流动相溶液,经0.45 μm 滤膜过滤后进样检测,根据保留时间和标准分子量校正曲线,由GPC软件计算样品分子量。检测条件:Waters 515液相色谱仪,检测器为Waters 2410 示差检测器;色谱柱为Waters Ultrahyrdogel Linear凝胶色谱柱(300 mm×7.8 mm);流动相为0.2 mol·L-1硫酸钠(NaNO3),流速0.60 mL·min-1,色谱柱柱温为40 ℃,进样体积20 μL。
2 结果与分析
2.1 单因素试验结果与分析
2.1.1 辐照预处理对黄芪多糖提取率和抗氧化性的影响 辐照预处理对黄芪多糖提取率的影响如图1 所示。随着辐照剂量增大,黄芪粗多糖提取率显著增加(P<0.05),从0 kGy的6.34%提高到100 kGy的14.05%;总多糖提取率则随着辐照剂量增加呈现先增大后减小的趋势,即多糖纯度先增大后减小(P<0.05),75 kGy辐照下黄芪多糖提取效果最佳,总多糖提取率为10.72%,多糖纯度达到80%。当辐照剂量低于75 kGy时,随着辐照剂量增大,纤维素结构逐渐破坏,多糖溶出度增大,提取率和多糖含量逐渐提高;当辐照剂量高于75 kGy 后,除纤维结构破坏外,黄芪多糖降解加剧,多糖含量降低。如图2 所示,在检测浓度为1 mg·mL-1时,随着辐照剂量的增加,黄芪多糖对DPPH 自由基的清除率逐渐增大,抗氧化活性提高,这可能与总多糖含量增加和多糖分子量的降低相关。
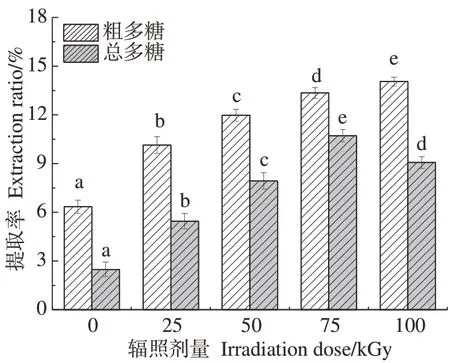
图1 辐照剂量对APS提取率的影响Fig.1 Effect of irradiation dose on extraction rate of APS
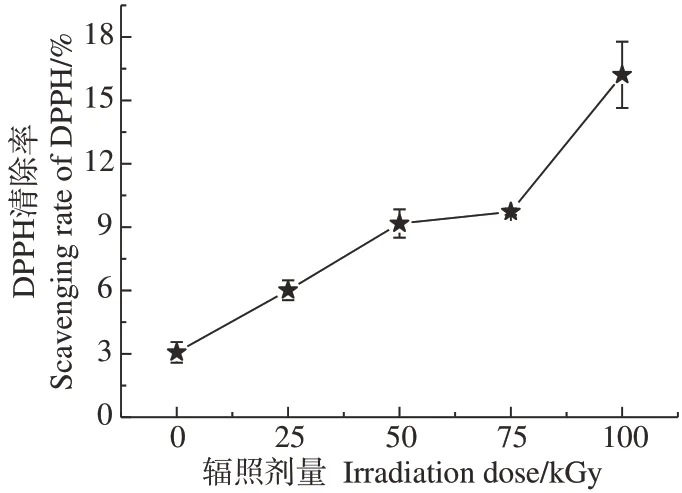
图2 辐照剂量对APS抗氧化活性的影响Fig.2 Effect of irradiation dose on antioxidant activity of APS
2.1.2 提取温度对黄芪多糖提取率和抗氧化活性的影响 以25 kGy 辐照预处理黄芪粉,提取温度对黄芪多糖提取率的影响如图3所示。结果显示,随着提取温度升高,黄芪粗多糖和总多糖提取率均显著增大(P<0.05),其中粗多糖提取率从8.15%提高到10.94%,总多糖提取率则从4.04%提高到6.59%;提取温度大于90 ℃后提取率提高不大,这可能是由于高温会加速多糖的降解,当多糖扩散速率较多糖结构破坏速率相当或减小时,多糖提取率将会下降。在检测浓度为1 mg·mL-1时,抗氧化活性结果如图4 所示,当提取温度低于90 ℃时,随着提取温度的升高,黄芪多糖对DPPH 自由基的清除率逐渐降低,在100 ℃提取时略有升高。这一结果可能是由于随着提取温度的逐渐升高,更多大分子多糖被溶出,抗氧化活性降低;而100 ℃提取下,多糖降解导致分子量降低,活性略有增大,与提取率结果相一致。
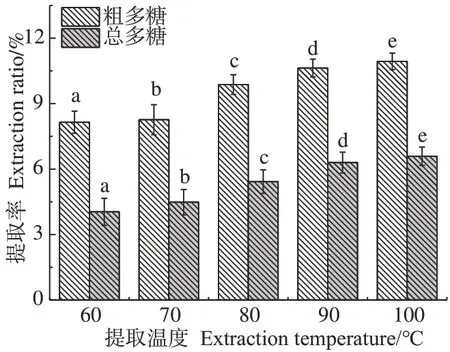
图3 提取温度对APS提取率的影响Fig.3 Effect of extraction temperature on antioxidant activity of APS
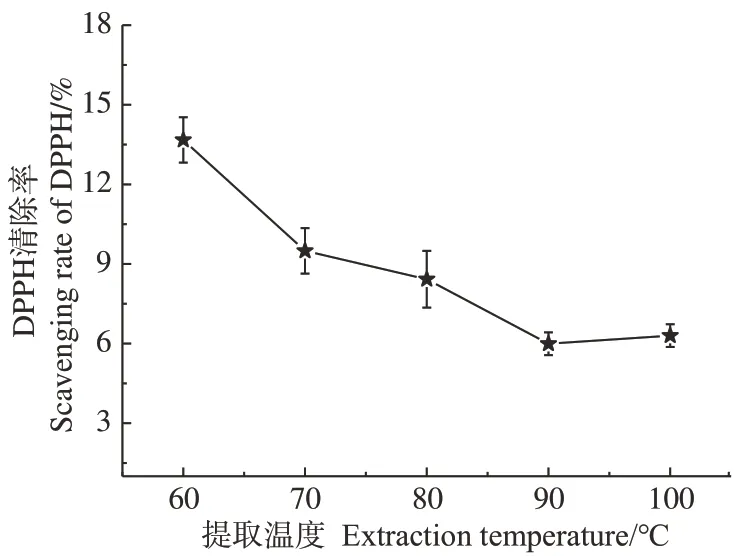
图4 提取温度对APS抗氧化活性的影响Fig.4 Effect of extraction temperature on antioxidant activity of APS
2.1.3 提取时间对黄芪多糖提取率和抗氧化活性的影响 以25 kGy 辐照预处理黄芪粉,提取时间对黄芪多糖提取率的影响如图5所示。结果显示,多糖提取率随着提取时间的增加先减小后增大;在2 h内提取率无显著性差异(P>0.05),多糖提取率分别为10.94%和10.97%;提取时间大于等于2 h时具有显著性差异(P<0.05),粗多糖提取率逐渐增大到12.01%;但随着提取时间增加,多糖纯度降低。这可能是因为多糖提取是扩散过程,当梯度差减小则扩散速度变慢。辐照对纤维结构和多糖分子量的降解有利于提取初期多糖的快速溶出和扩散,从而缩短多糖的提取时间,提高提取效率。如图6所示,在检测浓度为1 mg·mL-1时,提取时间对抗氧化活性的影响显示,不同提取时间下多糖对DPPH自由基的清除率差异不大,但在3 h提取时则有明显提高,可能是由于长时间高温提取引起大分子多糖降解导致的。
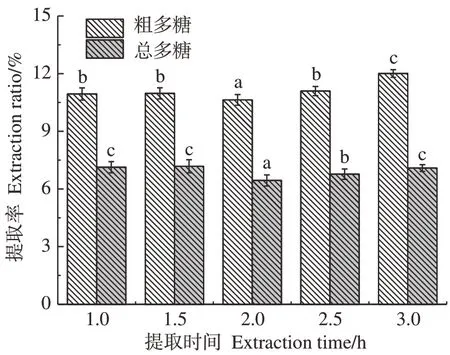
图5 提取时间对APS提取率的影响Fig.5 Effect of extraction time on antioxidant activity of APS
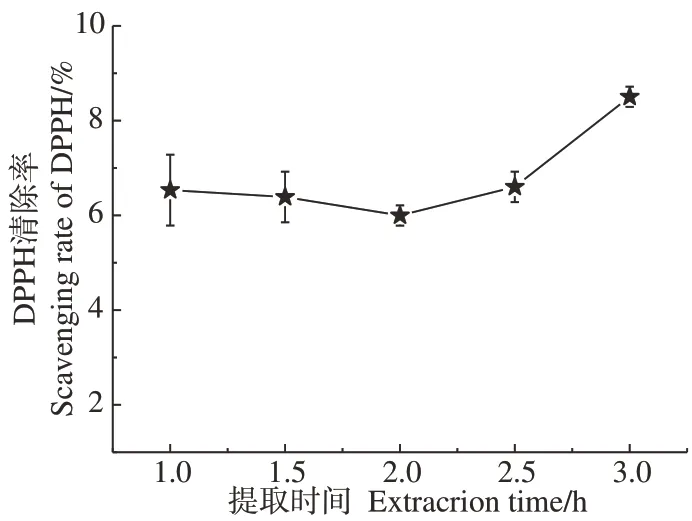
图6 提取时间对APS抗氧化活性的影响Fig.6 Effect of extraction time on antioxidant activity of APS
2.2 正交试验结果
2.2.1 正交试验结果与分析 按照已定检测方法,检测各试验样品的粗多糖含量、总糖含量和DPPH 清除率,并根据权重对正交试验结果进行综合评分及直观分析和方差分析,优选黄芪多糖辐照预处理提取最佳工艺,结果见表2和表3。
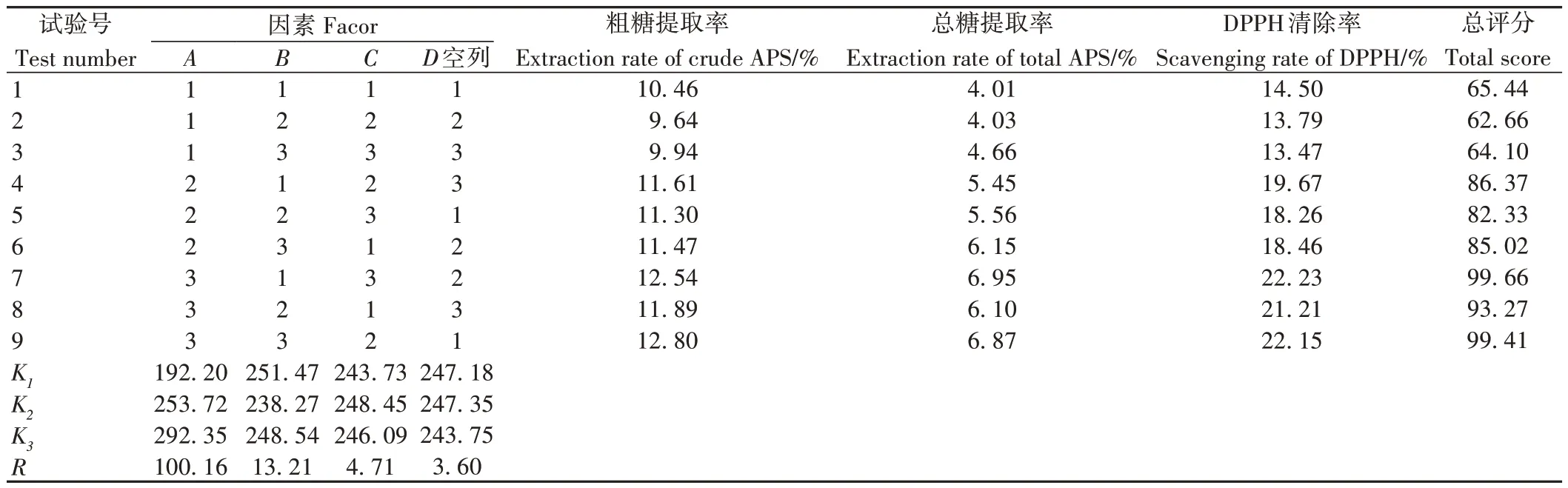
表2 正交试验设计与结果Table 2 Design and results of orthogonal test
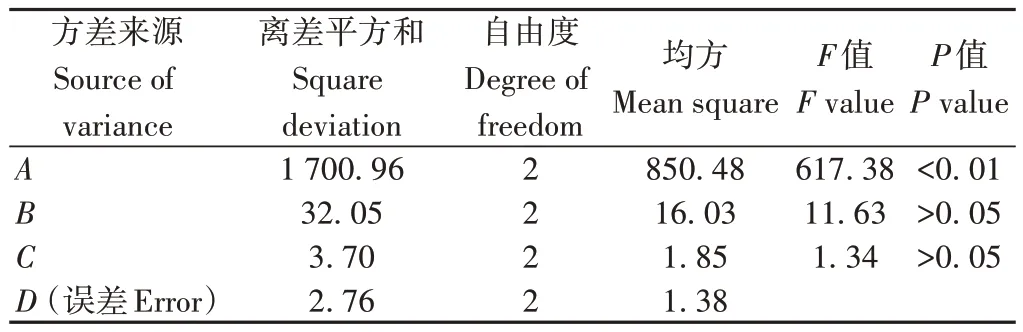
表3 方差分析结果Table 3 Results of variance analysis
正交试验直观分析结果显示(表2),各因素对辐照预处理提取黄芪多糖工艺的影响表现为A>B>C,即辐照剂量>提取温度>提取时间。方差分析结果显示(表3),因素A(辐照剂量)对试验结果具有极显著性影响(P<0.01),其他两个因素则无显著性影响(P>0.05)。综合考虑省时节能、降低成本和对指标综合评分的影响大小,确定最佳工艺参数为A3B1C3,即75 kGy辐照,70 ℃提取2次。
2.2.2 验证试验 为验证正交优选工艺的准确性和合理性,按照正交试验结果对黄芪多糖辐照预处理提取进行重复试验,结果表明,粗糖提取率、总糖提取率和抗氧化活性的平均值分别为12.56%,6.97% 和22.96%,综合评分平均值为99.32,相对标准偏差(relative standard deviation, RSD)值为0.17%。表明该提取工艺稳定可行,可用于黄芪多糖的水提工艺。
2.3 辐照对黄芪微观结构的影响
不同辐照剂量处理黄芪粉的微观形貌结构见图7。未辐照(0 kGy)的黄芪粉呈松散颗粒,颗粒较大;经辐照处理(25~100 kGy)的黄芪粉末颗粒间较为紧实,颗粒表面和颗粒间呈现逐渐融合趋势,表面圆滑,棱角消失,并且在100 kGy 时可见明显的表面损伤,与辐照剂量对黄芪多糖提取率的影响相一致,表明辐照对黄芪纤维结构产生了降解作用。

图7 辐照对黄芪粉微观形貌的影响Fig.7 Effect of irradiation on morphology of Astragalus powder
2.4 辐照预处理提取与常规提取黄芪多糖差异分析
2.4.1 两种提取方式对多糖提取率的影响 以正交优选辐照预处理工艺提取黄芪多糖(RAPS),并以此工艺提取未辐照黄芪多糖(APS),对比两种方法下黄芪多糖提取率的差异,结果如图8 所示。在优选提取工艺下,未辐照提取黄芪多糖(APS)的粗多糖提取率为6.78%,总多糖提取率仅1.42%,所得多糖纯度较低,提取效率低;辐照预处理提取黄芪多糖(RAPS)粗多糖提取率为12.56%,总多糖提取率6.97%,多糖提取率和纯度显著提高(P<0.05)。
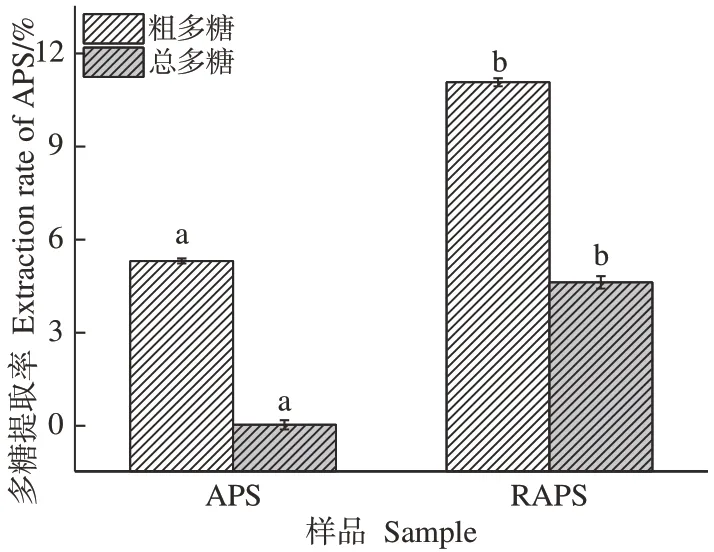
图8 APS与RAPS提取率Fig.8 Extraction yield of APS and RAPS
2.4.2 两种多糖抗氧化活性研究 由图9 可知,两种多糖对DPPH 自由基的清除率均随着多糖浓度的增大而增大,抗氧化活性提高,并且与糖浓度呈线性相关;其中,APS 的线性斜率为8.91,IC50为5.23 mg·mL-1;RAPS的线性斜率为16.03,IC50为2.78 mg·mL-1;RAPS抗氧化活性明显高于APS。
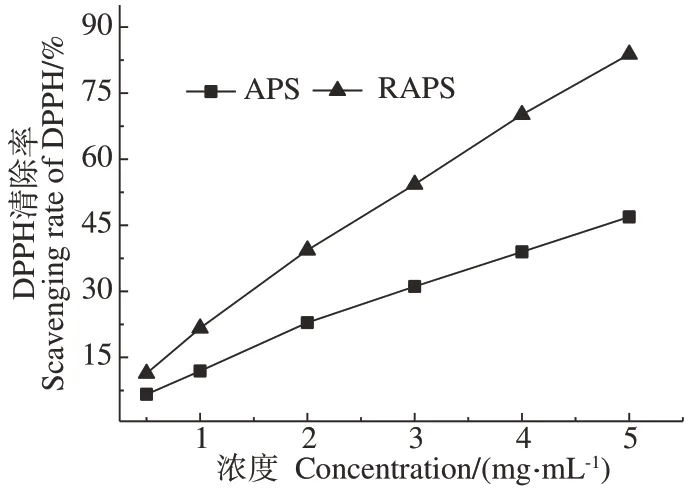
图9 RAPS和APS的抗氧化活性Fig.9 Antioxidant activity of RAPS and APS
2.4.3 两种多糖红外结构分析 RAPS与APS的红外光谱分析结果如图10 所示。红外谱图显示,RAPS 和APS 中均含有多糖特征峰:3 431 cm-1处为羟基伸缩振动;2 918 cm-1处为C—H 伸缩振动;1 630 cm-1处为羟基弯曲振动;1 412 cm-1处为—CH2和—CH3基团;1 236 cm-1处有酯键特征峰;1 150 cm-1处为糖环上C—O—C 伸缩振动;1 079 和1 044 cm-1处为醇羟基变角吸收峰;882 和844 cm-1处表明多糖中可能同时含α-型和β-型糖苷键;700~500 cm-1为环呼吸峰等;表明两种黄芪多糖均是吡喃型糖链结构。RAPS 与APS 在红外结构上无明显差异,其中,RAPS在1 715 cm-1处出现微量吸收峰,可能为醛基或羰基结构。

图10 RAPS与APS红外光谱图Fig.10 FTIR spectrum of RAPS and APS
2.4.4 两种多糖的分子量测定结果 RAPS与APS分子量及其分布分析结果如图11 所示。结果表明,APS 的重均分子量(weight-average molecular weight,Mw)为34.21×104,分子量的多分散性系数为7.265;RAPS的Mw为16.16×104,多分散性系数为7.977。与未辐照相比,辐照预处理提取黄芪多糖的重均分子量显著降低,多分散性系数略有增大,表明辐照预处理提取在降解纤维素的同时可使大分子黄芪多糖同样产生降解反应。
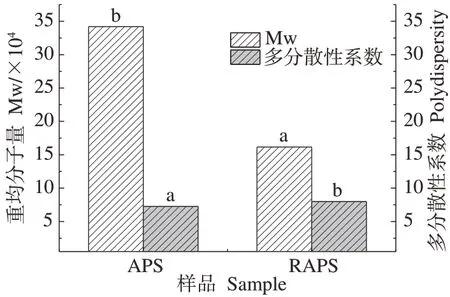
图11 RAPS与APS分子量及其分布Fig.11 Molecular weight and polydispersity of RAPS and APS
3 讨论
本试验发现辐照预处理提取可以显著提升黄芪多糖的提取率和多糖纯度,是适用于黄芪多糖工业化高效提取的有效方法。通过正交试验优化黄芪多糖的辐照预处理提取工艺发现,辐照剂量对黄芪多糖提取率和抗氧化活性的影响达到极显著水平(P<0.01),随着辐照剂量的增大,多糖提取率先增加后减小。Akram等[19]采用γ 辐照法改进香菇水溶性多糖提取工艺,多糖提取率和纯度从0 kGy 的2.01%和78.8%提高到15 kGy的7.17%和85.6%,多糖分子量明显降低。龚志华[20]通过γ 辐照热水提取茯苓多糖,在1 000 kGy 时,水溶性糖和水溶性多糖的含量分别提高18 和19 倍。Li 等[26]通过辐照处理改善脐橙皮中可溶性膳食纤维(orange soluble dietary fiber,OSDF)提取工艺,辐照后OSDF含量显著提高,并呈剂量依赖性。这可能是辐照预处理提取同时实现了纤维素及大分子多糖的降解。辐照激发的电子与质子的库仑力相互作用天然地倾向于诱导二者发生复合作用,纤维素结构的高刚性阻止了复合作用的发生,因此纤维素糖链的降解过程明显大于其聚合过程,以降解为主;而柔性大分子多糖则同时存在激发电子与质子的复合与降解,降解速率低[13]。黄芪多糖存在于黄芪纤维质中,因此其提取率和纤维质的溶胀作用及溶解性有着直接关系[11]。辐照可以改变纤维的结晶区域,随着辐照剂量增加,纤维结晶区被破坏,共价键断裂,纤维结构疏松,溶胀度和可及度提高[26];同时大分子多糖降解成低分子量多糖,更有利于传质过程的发生,提高提取率。
对比分析辐照前后黄芪多糖红外结构、抗氧化活性和分子量,结果显示,辐照后黄芪多糖分子量降低,抗氧化活性明显升高,红外结构中多糖结构基本无差异,在1 715 cm-1处出现C=O 峰,相似结果出现在黄海潮等[27]和Hussaina 等[28]的研究中。Li 等[29]研究认为,25 kGy的γ 辐照是制备高水溶性、低黏度、低分子量黄芪多糖(IAPS)的有效方法;IAPS 通过增加淋巴器官的相对重量改善免疫功能,促进生长,有效性高于天然APS。Yin 等[30]研究发现γ-辐照处理可以显著提高裂褶菌多糖(irradiated schizophyllum polysaccharide,ISFP)的纯度,降低分子量,改变其理化性质;辐照后裂褶菌多糖较未辐照多糖具有更好的预防小鼠体重增加和调节肠道菌群的作用。植物多糖的分子量、聚合度以及结构均能影响多糖的生物活性,并且多糖聚合度越高,平均分子质量越大,越不利于其活性作用的发挥和利用[16]。在不改变多糖结构的情况下,降低分子量是获得高活性多糖的有效方法。γ 辐照被认为是一种通过降解糖苷键和暴露更多具有更高迁移率的官能团来修饰多糖结构的方法,可以快速、方便、环境友好地提高多糖的生物活性[30]。辐照处理过程中糖苷键和链的断裂导致多糖的极性增加以及随后链间氢键的减少,有助于增加亲水性和溶解度,提高多糖生物活性浓度[29-30];双键等的形成有利于抗氧化活性的提高[27-28];小分子多糖容易被肠黏膜穿透,启动肠黏膜免疫,进而刺激全身免疫系统,提高多糖体内免疫活性[29]。辐照预处理提取黄芪多糖在提高多糖提取率和纯度的同时,实现了多糖的生物活性改性,但更多相关的结构和药理活性仍有待进一步研究分析。
4 结论
通过单因素和正交试验对辐照预处理提取黄芪多糖的工艺进行优化,最终辐照剂量75 kGy、提取温度70 ℃、提取时间2 h 的黄芪多糖提取率、抗氧化性综合评分最高。与未辐照预处理提取相比,辐照预处理提取黄芪多糖的提取率、多糖纯度和抗氧化活性整体显著提高,多糖分子量降低,多糖红外结构无明显变化,产生含C=O官能团的结构。
